陈咏君陈咏玫张立群夏莉吴丽霞郭晶
219株铜绿假单胞菌感染分布与耐药性分析*
陈咏君①陈咏玫②张立群③夏莉①吴丽霞①郭晶①
目的:了解铜绿假单胞菌的感染情况及其耐药性,为临床合理应用抗生素提供科学依据。方法:收集本院临床分离铜绿假单胞菌,分析其科室分布、标本来源及耐药情况。结果:铜绿假单胞菌主要分布于干诊三病房(53.9%),主要以痰液分离最多(91.3%);其耐药率分别为:复方新诺明(100%)、头孢噻肟(83.94%)、庆大霉素(53.42%)、头孢他啶(51.83%)、氨曲南(50.55%)、头孢西林(50.27%)、环丙沙星(48.62%)、左氧氟沙星(44.95%)、妥布霉素(43.38%)、头孢吡肟(42.66%)、阿米卡星(26.30%)、哌拉西林/他唑巴坦(22.57%)、美罗培南(16.90%)、亚胺培南(14.39%)。结论:铜绿假单胞菌的耐药机制复杂,应加强医院耐药菌株的监测,指导临床合理使用抗生素,采取有效的防范措施最大限度减少铜绿假单胞菌感染。
铜绿假单胞菌; 耐药; 分布
铜绿假单胞菌(Pseudomonas aeruginosa PA)广泛分布于周围环境及正常人的皮肤、呼吸道和消化道等部位,是医院感染最常见的条件致病菌之一[1]。随着抗菌药物的广泛使用和各种创伤性检查、治疗手段的增加,各种条件致病菌的感染机会大幅增加,尤其是当机体免疫力低下时,可引起多种感染。临床报道铜绿假单胞菌是分离率最高的条件致病菌之一,而且呈逐年上升趋势,铜绿假单胞菌是院内感染的主要病原菌。本文对2013年本院住院患者各类标本的铜绿假单胞菌分离株的临床分布特征和耐药趋势进行回顾性分析。
1 资料与方法
1.1 一般资料 收集本院2013年门诊及住院患者各类标本,如痰、脓液、尿液、腹腔引流液等临床标本中分离的铜绿假单胞菌219株(排除重复菌株)。质控菌株为ATCC27853(购自辽宁省临检中心)。
1.2 仪器与试剂 采用法国生物梅里埃公司提供的ATB Expression细菌分析系统,试剂采用配套的ID32GN及ATB ATB G-5药敏试验板条。
1.3 方法 菌株分离与药敏试验:标本采集和分离培养严格按照《全国临床检验操作规程》进行[2],获得纯培养后,经革兰染色、氧化酶试验等初筛,再用ID32GN鉴定条在ATB Expression细菌分析系统上进行菌株鉴定,严格按仪器操作规程进行操作。药敏试验使用配套假单胞菌药敏试剂条ATB ATB G-5检测最低抑菌浓度。每周用铜绿假单胞菌ATCC27853做质控,参照美国临实验室标准化协会药敏判断标准判读结果[3]。
1.4 统计学处理 采用WHONET 5.6软件进行数据统计分析。
2 结果
2.1 219株铜绿假单胞菌的来源分布 219株铜绿假单胞菌分布来源比例可以看出,痰液比例最高,达91.3%(200/219);其次为分泌物5.9%(13/219)、尿标本1.4%(3/219)、脓液0.5% (1/219)、血液0.5%(1/219)、其他0.5%(1/219)。
2.2 219株铜绿假单胞菌的科室分布 219株铜绿假单胞菌科室分布分别为干诊三病房118株(53.9%),心外科病房37株(16.9%),呼吸病房28株(12.8%),干诊二病房16株(7.4%),干一病房6株(2.7%),普外病房4株(1.8%),耳鼻喉病房3株(1.4%),其他科室7株(3.2%)。
2.3 219株铜绿假单胞菌对14种抗菌药物的耐药率 其中敏感率较高的抗菌药物有亚胺培南(14.39%)、美罗培南(16.90%)、阿米卡星(26.3%)、哌拉西林/他唑巴坦(22.6%),而对复方新诺明(100%)、头孢噻肟(83.94%)、庆大霉素(53.42%)、环丙沙星(48.62%)、头孢他啶(51.83%)等耐药率均较高,见表3。
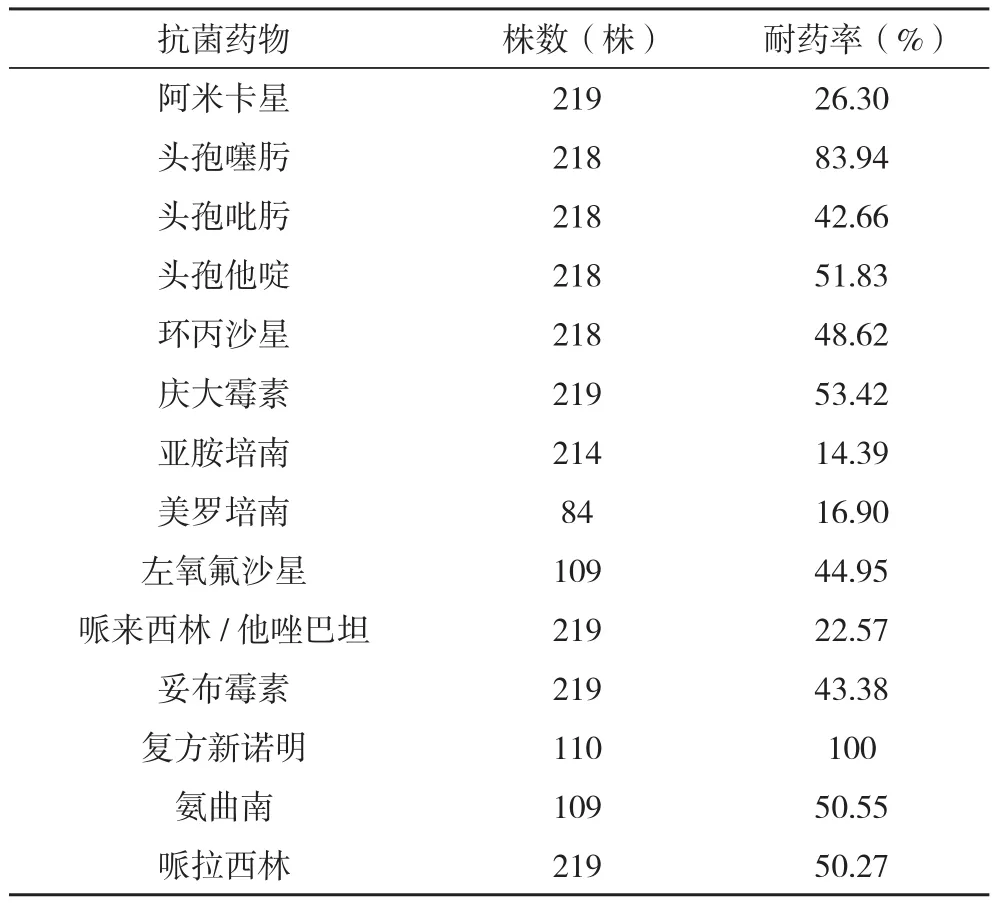
表3 219株铜绿假单胞菌对14种抗菌药物的耐药率
3 讨论
铜绿假单胞菌分布广泛,是正常人皮肤、黏膜、呼吸道和消化道中常见的定植菌,因此也是医院感染最常见的病原菌之一[1]。本研究资料显示,铜绿假单胞最常见分离自痰标本(91.3%),其次是分泌物(5.9%),表明铜绿假单胞菌在本院院内感染中最常见的感染部位是呼吸道。这与国内的报道相同[4-8]。219株铜绿假单胞菌科室分布以干诊三病房分离率为最高118株(53.9%),其次为心外病房37株(16.9%),再次为呼吸病房28株(12.9%),提示干诊三病房、心外病房、呼吸病房的患者为医院感染的高危人群,应加以注意。
本研究显示铜绿假单胞菌对复方新诺明、头孢噻肟的耐药率分别为100%和83.94%,因此在治疗中应首先排除此类药物。本研究显示:对铜绿假单胞菌耐药率较低的抗菌药物依次为亚胺培南(14.39%)、美罗培南(16.90%)阿米卡星(26.30%)、哌拉西林/他唑巴坦(22.57%)。哌拉西林是半合成青霉素中抗菌作用最强的,在临床大量使用抗生素的情况下,耐药率逐年上升,为50.27%,而当与β内酰胺酶抑制剂他唑巴坦联合使用时耐药率可降至22.57%。因此临床治疗应首选以上耐药率低的药物。
铜绿假单胞菌对亚胺培南的耐药机制包括:Opr D2的缺失、金属酶的产生、主动泵出系统和Amp C酶的超水平表达等等[9]。亚胺培南产生耐药有两个危险因素:主要因素是曾经使用过亚胺培南药物;因为用过亚胺培南药物治疗的患者产生耐药的概率是未用过的24倍;其次是患者接受过其他内酰胺类药物进行抗感染治疗,则可能会激活β‐内酰胺酶生成脱抑制,继而会诱导铜绿假单胞菌失去其孔蛋白Opr D2,形成亚胺培南耐药[10]。本研究结果显示,铜绿假单胞菌对亚胺培南耐药率为14.39%,可见临床应合理使用抗菌药物,特别是亚胺培南的使用应谨慎,以延缓铜绿假单胞菌对亚胺培南的耐药性发展。
本研究中铜绿假单胞菌对头孢吡肟、头孢他啶、环丙沙星、哌拉西林、庆大霉素、妥布霉素、和左氧氟沙星的耐药率>40%,其中喹诺酮类抗菌药中环丙沙星与左氧氟沙星的耐药率分别为48.62%和44.95%,与2010年全国铜绿假单胞菌耐药监测结果基本一致[11]。环丙沙星与左氧氟沙星的耐药,可能由于本院临床这两种药的使用率较高,致使其易发生细菌DNA旋转酶A亚单位的结构突变和细胞膜通透性改变,因此应注意限制其使用,降低此类抗菌药物的选择压力,以期恢复其敏感性。
铜绿假单胞菌的耐药机制十分复杂,包括外膜通透性障碍、作用靶位改变、产生灭活酶、形成生物膜和主动外排泵系统等,且其对不同抗生素耐药机制也有所不同,往往是几种耐药机制共同作用,使其对多种抗生素产生耐药[12-13]。因此,应加强医院耐药菌株的监测,并且及时报告给各临床科室,指导其合理使用抗生素,采取有效的预防措施最大限度限制铜绿假单胞菌的医院感染。
[1]许宏涛,张秀珍.医院感染铜绿假单胞菌多重耐药机制的研究[J].中国抗感染化疗杂志,2005,5(3):141-145.
[2]叶应妩,王毓三,申子瑜.全国临床检验操作规程[M].第3版.南京:东南大学出版社,2006:827-829.
[3] Clinical and Laboratory Standards Institute (CLSI).Performance standards for antimicrobial ausceptibility testing[S].Twenty-Second Informational Supplement,2012:M100-S22.
[4]魏爱萍,陈鹏飞.98株铜绿假单胞菌的来源分布及耐药性分析[J].武警医学,2012,7(23):640-641.
[5]李静,蔡木发,崔国辉.123株铜绿假单胞菌感染分布及耐药性分析[J].海南医学,2012,6(23):101-102.
[6]祁安宁.118株铜绿假单胞菌医院感染分布与耐药性分析[J].检验医学与临床,2012,10(9):2621-2622.
[7]朱胜波,刘春明,韦柳华,等.277株铜绿假单胞菌的分布及耐药性分析[J].广西医学,2013,10(35):1387-1991.
[8]燕成岭,肖伟利,潘晓萍,等.铜绿假单胞菌感染分布及耐药性分析[J].内蒙古医科大学学报,2013,6(3):212-215.
[9]陈瑞,唐英春,朱家馨,等.耐亚胺培南铜绿假单胞菌的耐药性及分子流行病学研[J].中华医院感染学杂志,2006,16(4):371-373.
[10]钟国权,郑淑妹,邱文影,等.铜绿假单胞菌医院感染分析[J].中华医院感染学杂志,2003,13(6):588-590.
[11]张讳博,倪语星,孙景勇,等.2010年中国CHINET铜绿假单胞菌耐药性监测[J].中国感染与化疗杂,2012,3(12):161-166.
[12]韦柳华,黄志卓,李梦薇,等.耐碳青霉烯类革兰阴性杆菌的耐药性分析[J].中华医院感染学杂志,2013,23(8):1920-1922.
[13]胡冬梅.铜绿假单胞菌的耐药性分析[J].中国医学创新,2012,9(25):156-157.
Infection Distribution and Drug Resistance Analysis of 219 Strains of Pseudomonas Aeruginosa
CHEN Yongjun,CHEN Yong-mei,ZHANG Li-qun,et al.//Medical Innovation of China,2014,11(12):080-082
Objective:To understand Pseudomonas aeruginosa infection and drug resistance for clinical rational use of antibiotics and provide scientific basis.Method:219 strains of clinical isolated pseudomonas aeruginosa were collected in our hospital, its distribution, specimen source department and drug resistance were analyzed.Result:Pseudomonas aeruginosa was mainly distributed in the three veteran cadres wards (53.9%), was mainly the separation of sputum specimens (91.3%);drug resistance rate: cotrimoxazole (100%), cefotaxime (83.94%), gentamicin (53.42%), ceftazidime (51.83%) aztreonam (50.55%), cephalosporins amoxicillin (50.27%), ciprofloxacin (48.62%), levofloxacin (44.95%), tobramycin (43.38%),cefepime (42.66%), amikacin (26.3%), piperacillin / tazobactam (22.57%), meropenem (16.9%), imipenem (14.39%).Conclusion:Drug resistance of Pseudomonas aeruginosa mechanism is complex, should strengthen the monitoring of hospital drug resistant strains, to guide clinical rational use of antibiotics, take effective measures to prevent minimize Pseudomonas aeruginosa infection.
Pseudomonas aeruginosa; Resistance; Distributed
10.3969/j.issn.1674-4985.2014.12.030
2014-02-11) (本文编辑:蔡元元)
沈阳医学院科技基金项目(2013020);辽宁省教育厅科学技术研究项目(L2013399)
①沈阳医学院附属第二医院 辽宁 沈阳 110002
②北京海淀妇幼保健院
③沈阳医学院
陈咏君
First-author’s address:The Second Affiliated Hospital of Shenyang Medical College,Shenyang 110002,China



