崔建鹏周力
应用免疫印迹法探讨血清幽门螺杆菌抗体谱与上消化道疾病的关系*
崔建鹏①周力①
目的:用免疫印迹法检测幽门螺杆菌(Hp)感染中不同血清分型与慢性浅表性胃炎(CSG)、慢性萎缩性胃炎(CAG)、消化性溃疡(PU)和胃癌(GC)的关系。方法:选取确诊为Hp感染的上消化道疾病患者205例,用Western blot法(免疫印迹法)测血清幽门螺杆菌抗体谱,检测Hp抗体分型,分析CagA和/ 或VacA抗体阳性的表达情况。结果:在Hp现症感染中,CSG、CAG、PU、GC患者的HpⅠ型感染比例明显高于Ⅱ型感染(P<0.01);PU及GC中HpⅠ型感染率高于CSG(P<0.05)。不同年龄段及不同性别中HpⅠ型感染比例均高于Ⅱ型感染(P<0.01)。各组的Hp I型感染者中以CagA+VacA抗体为主,检出率为77.4%;其中以CSG组最低(70.4%)、GC组最高(81.8%)。各组CagA+VacA抗体检出率显着高于单一CagA/VacA抗体检出率(P<0.01)。结论:应用免疫印迹法进行幽门螺杆菌血清学分型检测对于上消化道疾病的判断有临床指导意义,Ⅰ型Hp感染更需要进行根治。
幽门螺杆菌; 免疫印迹法; 分型; CagA; VacA
幽门螺杆菌(Hp)是一种人类最常见的慢性致病菌。目前已经确认Hp与4种上消化道疾病疾病有密切关联:(1)慢性胃炎;(2)消化性溃疡病;(3)胃癌;(4)胃黏膜相关性淋巴样组织(mucosaassociated lymphoid tissue MALT)淋巴瘤[1]。目前认为细胞毒素相关蛋白A(Cytotoxin associated gene A, CagA)、空泡毒素(Vacuolating cytotoxin A,VacA)与Hp的致病力密切相关[2]。本研究使用免疫印迹法对确诊Hp感染的上消化道疾病患者进行血清Hp抗体检测,并进行分型,探讨血清幽门螺杆菌抗体谱与上消化道疾病的关系。
1 资料与方法
1.1 一般资料 收集2013年2-12月因上腹痛、饱胀、纳差、黑便等症状在本院消化内科门诊就诊及住院的患者205例。所有调查者均行胃镜检查,其中慢性萎缩性胃炎、胃溃疡、胃癌均行病理活检确诊。分别为:慢性浅表性胃炎(CSG)、慢性萎缩性胃炎(CAG)、消化性溃疡(PU)、胃癌(GC)。患者中男121例,女84例,年龄14~86岁,平均(44.91±16.66)岁。入选标准:(1)除外近期服用NSAIDs;(2)1个月内未服用抗生素、抑酸剂、PPI及铋剂;(3)14C呼气试验及免疫印迹实验阳性;(4)除外孕妇和儿童。
1.2 试剂14C尿素胶囊1粒(1 μCi)及呼气卡,由安徽养和医疗器械有限公司生产;Hp抗体分型检测试剂盒由深圳市帕劳特生物制品有限公司提供。
1.3 方法14C呼气试验:患者应空腹或禁食4 h,阳性提示Hp现症感染;Hp抗体分型检测:严格按试剂盒说明进行操作。
1.4 Hp抗体分型判断标准 Ⅰ型Hp(HpⅠ):显示CagA和/或VacA抗体阳性;Ⅱ型Hp(HpⅡ):仅UreA和/或UreB(尿素酶)抗体阳性,CagA和VacA抗体阴性;Hp阴性:CagA、VacA、UreA、UreB抗体均阴性。
1.5 统计学处理 应用SPSS 19.0统计学软件对数据进行处理,计量资料以(±s)表示,比较采用单因素方差分析,方差齐采用LSD分析进行两两比较,计数资料比较采用 χ2检验,以P<0.05表示差异有统计学意义。
2 结果
2.1 Hp不同血清分型在不同年龄组中阳性率的比较 205例患者均为Hp现症感染,其中HpⅠ型感染173例,阳性率为84.4%;HpⅡ型感染32例,阳性率为15.6%。在不同年龄组中HpⅠ型感染率比较差异无统计学意义(P>0.05),但HpⅠ型感染的发生率明显高于HPⅡ型感染(P<0.01),见表1。

表1 Hp不同血清分型在不同年龄组中阳性率的比较 例(%)
2.2 Hp不同血清分型在不同性别中阳性率的比较 121例男性患者中100例为HpⅠ型感染,阳性感染率为82.6%;84例女性患者中73例为HpⅠ型感染,阳性感染率为86.9%。男女患者HpⅠ型感染阳性率比较差异无统计学意义(P>0.05),但HpⅠ型感染的发生率明显高于HPⅡ型感染(P<0.01),见表2。

表2 Hp不同血清分型在不同性别中阳性率的比较 例(%)
2.3 Hp血清学分型在消化系统疾病中的表达情况 CSG、CAG、PU、GC组中的HpⅠ型感染率显着高于Ⅱ型(P<0.01)。其中PU、GC组HpⅠ型感染率高于CSG组,差异均有统计学意义(P<0.05);PU、GC、CAG 组HpⅠ型感染率比较差异无统计学意义(P>0.05);CAG、CSG组HPⅠ型感染率比较差异无统计学意义(P>0.05),见表3。

表3 Hp血清分型在消化道疾病中的表达情况 例(%)
2.4 不同疾病的Hp I型中CagA、VacA抗体的表达 在四组的Hp I型感染者中检测CagA、VacA抗体的表达情况,发现以CagA+VacA抗体为主,检出率为77.4%;其中以CSG组最低(70.4%)、GC组最高(81.8%),各组间CagA+VacA抗体的检出率比较差异无统计学意义(P>0.05);但各组疾病中CagA+VacA抗体检出率显着高于单一CagA/VacA抗体检出率(P<0.01),见表4。
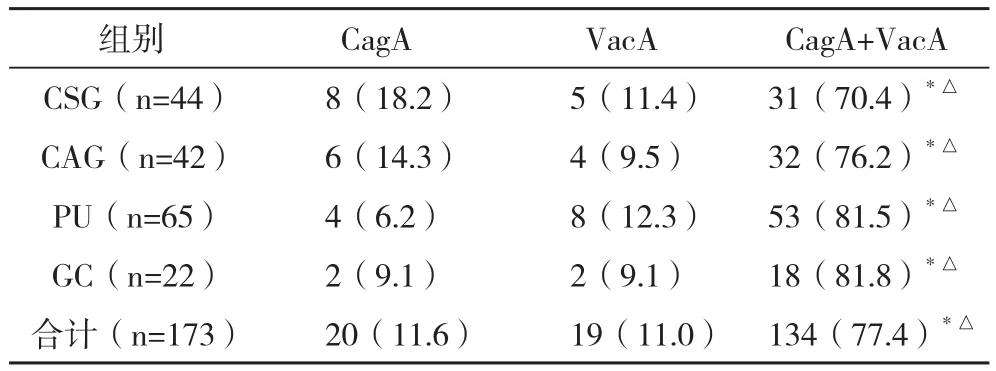
表4 不同疾病的Hp I型中CagA、VacA抗体的表达 例(%)
3 讨论
Hp感染是人类最常见的慢性细菌性感染性疾病之一,在全世界流行广泛。Hp在人群之间通过粪-口、口-口、胃-口传播,Hp凭借其产生尿素酶、空泡毒素、细胞毒素相关蛋白等导致细胞损伤,促进上皮细胞释放多种炎症介质,使炎症反应迁延不愈,而Hp毒株、胃内微生态环境及宿主个体差异等多种综合因素影响胃黏膜炎症进一步发展及转归[3]。细胞毒素相关蛋白基因A(CagA)和空泡毒素A(VacA)是Hp两种主要的致病毒素,CagA蛋白能够破坏胃黏膜上皮细胞的顶端连接,使基底膜降解,干扰上皮细胞正常分化,从而使上皮细胞失去细胞黏附性及极性,伸出具有侵袭性的迁移伪足,导致广泛的组织炎症,进而促使溃疡病的形成与发展[4];VacA主要通过改变离子通透性导致上皮细胞空泡形成,进一步使胃黏膜损伤,甚至导致糜烂或溃疡[5]。目前根据Hp的致病因子分为:Ⅰ型Hp菌株分泌CagA和或VagA,为高毒力菌株,与消化性溃疡和胃癌的发生极为密切;Ⅱ型Hp菌株不含细胞毒素相关基因A(CagA),不表达VacA和CagA,这类菌株毒性小[6]。临床上常用13C或14C尿素呼气试验检测Hp感染,因其敏感性及特异性高,为非侵入性方法中Hp检测的“金标准”方法之一;而免疫印迹法检测幽门螺杆菌抗体可用于Hp流行病学筛查[7]。本试验用14C尿素呼气试验确定Hp感染,免印迹法进行血清学Hp抗体谱检查,测出CagA、VacA、UreA、UreB 4种抗体,确定其Hp分型。
文献[8]报道CagA基因阳性菌株率占Hp菌株的比例大,西方国家为60%~70%。亚洲有报道含有CagA基因的Hp菌株感染率接近100%[9]。我国目前各地报道不一,在70%~100%之间[10-11]。许定红等[12]应用ELISA法检测贵州省黔东南地区含Hp-CagA抗体阳性的Hp菌株占84.25%。本次调查发现本地区Hp现症感染中,I型Hp感染占84.4%,与之相符,其中CSG为72.1%、CAG为82.4%、GC 为91.7%,PU最高达94.2%,调查表明本地区I型Hp感染与消化性溃疡及胃癌的发生密切相关,与相关报道相符[13-14]。本调查还发现患有上消化道疾病的Hp感染者,I型Hp菌株感染率与年龄、性别无明显相关性。
有学者用ELISA法在贵州地区检测到Hp阳性的消化性溃疡中,含CagA抗体菌株的感染率为70%左右,与本次调查差别较大,分析原因考虑可能为所用检测方法、调查人群不同,另一个原因可能为本研究入选标准排除近期服用NSAIDs的病例。流行病学调查显示,在服用NSAIDs的人群中,15%~30%的人可患消化性溃疡,与Hp感染同为消化性溃疡的两个独立的危险因子[15]。
通过本次调查发现,在本院消化内科门诊就诊及住院且患有上消化道疾病的患者,Hp现症感染中以Ⅰ型菌株为主,且Ⅰ型Hp感染与消化性溃疡、胃癌关系密切,其中Ⅰ型Hp菌株中同时表达CagA和VacA抗体的亚型是上消化道疾病的主要致病菌。患有上消化道疾病且为Ⅰ型Hp菌株感染的患者,更应及时、严格的行Hp根除治疗。
[1] Björkholm B,Befrits R,Jaup B,et al.Rapid PCR detection of Helicobacter pylori-associated virulence and resistance genes directly from gastric biopsy material[J].Journal of Clinical Microbiology,1998,36(12):3689-3690.
[2] Lemke L B,Ge Z,Whary M T,et al.Concurrent Helicobacter bilis infection in C57BL/6 mice attenuates proinflammatory H. pyloriinduced gastric pathology[J].Infection and Immunity,2009,77(5):2147-2158.
[3]胡伏莲.幽门螺杆菌感染相关疾病—幽门螺杆菌感染的流行病学[J].中国医刊,2007,42(2):17-18.
[4]朱海玲,田旭,柴树花.幽门螺旋杆菌感染109例护理干预效果[J].中国医学创新,2013,10(6):75-76.
[5] Manente L,Perna A,Buommino E,et al.The Helicobacter pylori's protein VacA has direct effects on the regulation of cell cycle and apoptosis in gastric epithelial cells[J].Journal of Cellular Physiology,2008,214(3):582-587.
[6] Gatti L L,Fagundese Souza E K,Leite K R,et al.CagA,vacA alelles and babA2 genotypes of Helicobacter pylori associated with gastric disease in Brazilian adult patients[J].Diagnostic Microbiology and Infectious Disease,2005,51(4):231-235.
[7]刘文忠,谢勇,成虹,等.第四次全国幽门螺杆菌感染处理共识报告[J].胃肠病学,2012,17(10):618-625.
[8] Thjodleifsson B,Arnsdottir H,Sigurjonsdottir R B,et al.Seroprevalence of Helicobacter pylori and cagA antibodies in Iceland, Estonia and Sweden[J].Scandinavian Journal of Infectious Diseases,2007,39(8):683-689.
[9] Abadi T B,Rafiei A,Ajami A,et al.Helicobacter pylori homB, but not cagA, is associated with gastric cancer in Iran[J].Journal of Clinical Microbiology,2011,49(9):3191-3197.
[10]张凤娟,江月萍,赵清喜.幽门螺杆菌vacA及cagA基因型与胃疾病的关系[J].青岛大学医学院学报,2010,46(2):98-100.
[11]何源,周力,许茂涛.贵州安顺地区汉族与布依族人群感染幽门螺杆菌cagA 抗体分布特征及与胃相关性疾病的关系[J].贵州医药,2011(5):445-447.
[12]许定红,周力.黔东南地区门诊人群200例幽门螺杆菌的血清学调查[J].贵州医药,2013,37(10):915-918.
[13]王韶英,陈锡美,王迎昕.幽门螺杆菌血清分型与上消化道疾病的关系[J].实用医学杂志,2008,24(22):3869-3871.
[14]刘聪,王宇美,李哲轩,等.胃癌高发区人群幽门螺杆菌血清学分型及其与胃黏膜病变的关系[J].中华肿瘤杂志,2013,35 (7):547-551.
[15]吴开春,刘震雄.非甾体类抗炎药与消化性溃疡[J].中华消化杂志, 2009,28(7):439-441.
Discussion of the Relationship between the Serum Helicobacter Pylori Antibody Spectrum and the Disease of Upper Digestive Tract Using Western Blot
CUI J ian-peng,ZHOU Li.//Medical Innovation of China,2014,11 (24):028-030
Objective:To detect the relationship between the different serotype of Helic-obacter pylori infection among the disease of the chronic superficial gastritis, chronic atrophic gastritis, peptic ulcer and gastric cancer using the Western blot.Method:205 patients with upper gastrointestinal diseases who diagnosed Hp infection were selected,the helicobacter pylori antibody spectrum was detected by the Western blot, the positive expression of the CagA and / or VacA antibody were analyzed.Result:Among the patients with Hp infection,the infection ratio of Hp Ⅰamong the disease of CSG, CAG, PU, GC were obviously higher than Hp Ⅱ(P<0.01);Hp Ⅰinfection ratio in PU, GC were higher than in CSG(P<0.05). Hp Ⅰtype infection in the different age groups and different gender ratio were higher than type Ⅱ infection (P<0.01). The CagA + VacA antibodies was priority in the HpI type of each groups, the detection rate was 77.4%; the CSG group was the lowest (70.4%),the GC group was the highest (81.8%). CagA + VacA antibody detection rate of each groups was significantly higher than that of single CagA/VacA antibody detection rate (P<0.01).Conclusion:It is significance in clinical to use the Western blot to detect the different serotype of Helicobacter pylori in diagnoses the disease of upper digestive tract. HPⅠinfection should be cured for more reasons.
Helicobacter pylori; Western blot; Serotype; CagA; VacA
10.3969/j.issn.1674-4985.2014.24.009
2014-02-22) (本文编辑:蔡元元)
贵州省高层次人才科研条件特助经费项目(TZJF-2008-56)
①贵阳医学院附属医院 贵州 贵阳 550004
周力
First-author’s address:The Affiliated Hospital of Guiyang Medical School,Guiyang 550004,China



