陈咏君 陈咏玫 张立群 夏莉 吴丽霞 郎华
【摘要】 目的:分析2015-2017年本院铜绿假单胞菌临床分布及耐药性,为临床合理选用抗菌药物提供依据。方法:对本院临床标本分离出的铜绿假单胞菌的检出率、科室分布特点及药敏结果进行回顾性分析。结果:铜绿假单胞菌在痰标本中检出率最高,为94.86%;呼吸病房检出率最高,为26.88%;铜绿假单胞菌对多粘菌素B敏感性最好,耐药率最低,其次是环丙沙星。结论:本院铜绿假单胞菌感染以上呼吸道为主,同时可引起多部位感染,其耐药性高,应规范临床用药,加强铜绿假单胞菌耐药性监测,有效控制感染。
【关键词】 铜绿假单胞菌; 抗菌药物; 耐药性; 多重耐药
铜绿假单胞菌(pseudomonas aeruginosa,PAE)为非发酵革兰阴性杆菌,是医院感染最常见的条件致病菌之一。近年来由于临床上各种插管、导管和机械通气等侵袭性诊疗手段应用的不断增加,免疫抑制剂的广泛应用,使铜绿假单胞菌成为医院感染的常见病原菌之一,特别是抗菌药物的不合理应用又使得多重耐药。近年来,随着广谱抗菌药物的广泛使用以及抗菌药物使用量的不断增加,多重耐药铜绿假单胞菌(multi-drug resistance Pseudomonas aeruginosa,MDRP)及泛耐药PAE不断产生,给临床治疗及医院感染控制带来了巨大的挑战[1]。为了明确PAE在本院的分布情况以及耐药趋势,进一步为临床抗感染治疗提供理论依据,本研究对沈阳医学院附属第二医院2015年1月-2017年12月所有送检临床样本中分离的PAE进行耐药性统计,为临床合理选择抗菌药物治疗PAE感染提供参考。现报道如下。
1 资料与方法
1.1 材料
1.1.1 菌株来源 收集沈阳医学院附属第二医院2015年1月-2017年12月所有临床送检样本中分离的253株铜绿假单胞菌为研究对象。来自同一患者相同部位的菌株只分析第1株。标本包括痰、脓、咽拭子等。铜绿假单胞菌(ATCC27853),由卫生部临床检验中心提供。所有患者均知情同意并签署知情同意书,本研究经医院伦理委员会批准。
1.1.2 抗菌药物药敏纸片 所有抗菌药物药敏纸片为英国Oxoid产品。
1.1.3 培养基 血培养基购自法国生物梅里埃公司,伊红美蓝平板购自郑州贝瑞特生物技术有限公司。
1.2 培养鉴定和药敏试验 细菌培养及鉴定严格按照《全国临床检验操作规程》第三版进行操作[2],鉴定和药敏系统为法国生物梅里埃公司ATB半自动微生物分析系统,所用鉴定和药敏试剂均为法国生物梅里埃配套板条,结果判定依据美国临床和实验室标准化协会(CLSI)标准[3-5]。药物敏感性试验的抗菌药物为哌拉西林、头孢哌酮-舒巴坦、哌拉西林-他唑巴坦、头孢他啶、头孢吡肟、氨曲南、亚胺培南、美罗培南、阿米卡星、庆大霉素、环丙沙星和多粘菌素B。其中对5类(头孢菌素类、碳青霉烯类、β-内酰胺酶抑制剂、喹诺酮类和氨基糖苷类)抗菌药物中的3类及以上药物耐药,定义为MDRP[6]。
1.3 统计学处理 采用WHONET 5.6软件分析耐药性,并进行统计分析。
2 结果
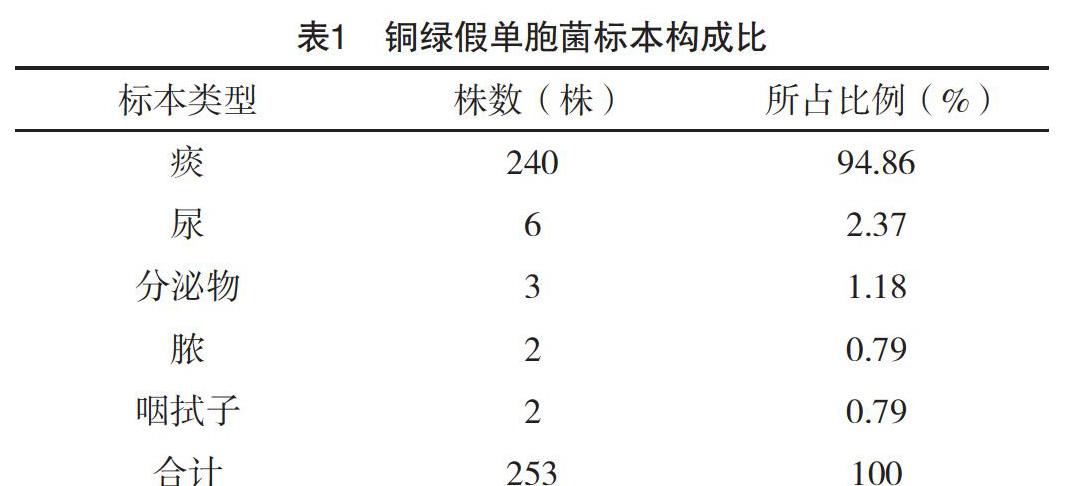
2.1 标本分布 2015年1月-2017年12月,沈阳医学院附属第二医院共分离出253株铜绿假单胞菌。253株铜绿假单胞菌感染主要以痰标本为主,共240株,占94.86%;其次为尿液,6株,占2.37%;分泌物3株,占1.19%;脓汁为2株,占0.79%。标本类型,见表1。
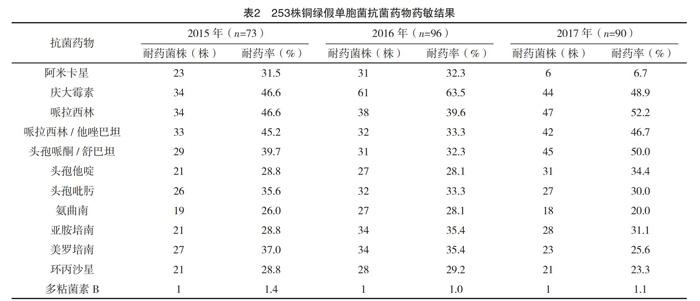
2.2 药敏试验结果 2015年1月-2017年12月,沈阳医学院附属第二医院分离的253株铜绿假单胞菌药敏情况,庆大霉素、哌拉西林、哌拉西林/他唑巴坦、头孢哌酮/舒巴坦的耐药率均较高,在2016年庆大霉素的耐药率达到63.5%,为耐药率最高,多粘菌素B为三年来耐药率最低,见表2。
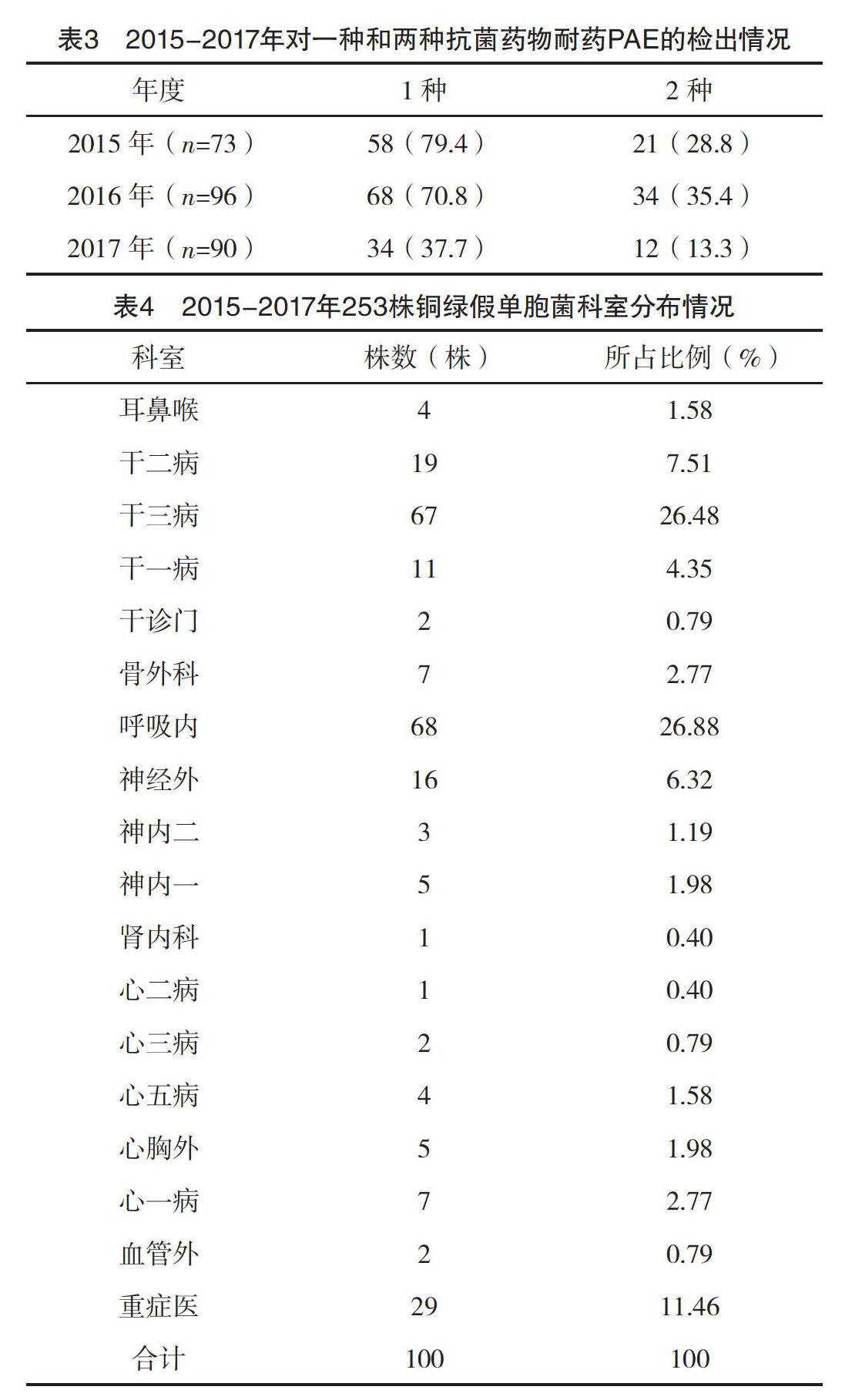
2.3 一种或两种抗菌药物结果 2015年1月-2017年12月,连续3年内菌均未检出MDRP。对于一种及两种抗菌药物耐药的PAE检出率2015年79.5%、28.8%;2016年70.8%、35.4%;2017年37.7%、13.3%,在2017年呈明显,下降趋势,见表3。
2.4 科室分布 从病房的分布情况来看,检出菌株率分别为呼吸、干诊三病房、CCU、干病房、神经外科病房等;其中呼吸病房共检出68株,占26.88%;干三病房共检出67株,占26.48%;CCU共检出29株,占11.46%。科室分布情况,见表4。
3 讨论
铜绿假单胞菌是临床常见的条件致病菌之一,广泛存在于医院的环境中,常导致免疫力低下的患者局部或全身性的感染[7]。本研究回顾性分析了2015年1月-2017年12月,沈阳医学院附属第二医院分离出的253株铜绿假单胞菌。253株铜绿假单胞菌感染主要以痰标本为主,共240株,占94.86%;其次是尿液、分泌物等。连续3年中每年均以痰检出铜绿假单胞菌位居第一,这与税剑等[8]报道一致,说明此菌在本院是引起呼吸道感染的主要原因之一。分析本院连续三年的标本类型,发现本院送检标本中无菌体液标本过少,应该加强本院临床科室的标本送检率和标本类型相关培训学习,以提高送检率和无菌体液标本。
从病房的分布情况来看,检出菌株率分别是呼吸、干诊三病房、CCU等病房。本研究中,铜绿假单胞菌对氨曲南的耐药率呈上升状态,分别为26.0%、28.1%、20.0%,均高于2015-2017 CHINET细菌耐药性监测的报道[9-11],这可能与本院近些年习惯用氨曲南有关。其次,本研究中PEA对亚胺培南耐药率分别是28.8%、35.4%、31.1%,2016年耐药率最高,在2017年得到控制;美罗培南分别是37.0%、35.4%、31.1%,呈现逐年下降状态,这是非常好的现象;环丙沙星的耐药率分别为28.8%、29.2%、23.3%;阿米卡星的耐药率分别是31.5%、32.3%、6.7%,在2017年得到非常好的控制,这与临床的高度重视有很大的关系。其中,耐药率非常高的是庆大霉素、哌拉西林、哌拉西林/他唑巴坦、头孢哌酮/舒巴坦。这可能与本院的用药习惯有关,因此经验用药不建议使用以上药物。对多粘菌素B的耐药率较低,分别为1.4%、1.0%、1.1%。回顾性分析过去三年本院的耐药情况,总体在2017年得到有效控制。
多重耐药的铜绿假单胞菌的出现给临床的抗感染治疗带来的极大的挑战,本院目前未分离出MDRP。但铜绿假单胞菌的耐药机制十分复杂,众多文献均有不同程度的相关报道[12-14],临床一定要引起高度的重视。目前认为MDRP的出现往往是多种耐药机制共同作用的结果,如对β-内酰胺酶类耐药,多与产生β-内酰胺酶(如金属酶)和外膜泵出系统异常(如MexAB-OprM系统)有关,对喹诺酮类耐药,多与细菌DNA拓扑异构酶改变、外膜泵出系统异常等相关[15-16]。目前很多研究证实,铜绿假单胞菌具有多种耐药机制,其中包括微孔蛋白表达的改变导致的细胞膜通透性的下降;耐药蛋白与拓扑酶结构变化影响了抗菌药物作用靶点,使得铜绿假单胞菌耐药的增加;生物膜的形成以及一些活性酶的产生增加;另外铜绿假单胞菌主动泵出系统的异常活化等,均是铜绿假单胞菌发生耐药的主要机制[17-20]。所以,还需要更多的实验证实不同科室,不同耐药菌株发生耐药的具体机制,为临床避免耐药的发生提供进一步证据。
此次回顾性分析,发现铜绿假单胞菌在本院对多数药物的耐药性维持稳定或有降低趋势,近3年来多重耐药的铜绿假单胞菌的分离率也趋于平稳。但是,铜绿假单胞菌耐药仍然是目前临床上常见问题,给临床治疗带来了极大的不便。为此,全院医护人员在临床工作中应该做好手以及器械的消毒,以避免由于操作导致的感染。同时还应该加强抗菌药物的合理应用,进一步降低铜绿假单胞菌耐药的发生。加强细菌耐药监测,关注本院细菌耐药的发展趋势,及时采取医院感染管理控制措施,防止多重耐药菌在医院内的播散。
参考文献
[1]朱荔清,邱广斌.多重耐药铜绿假单胞菌的临床分布特征及耐药性分析[J/OL].中华实验和临床感染病杂志(电子版),2015,9(3):352-354.
[2]叶应妩,王毓三,申子瑜.全国临床检验操作规程[M].3版.南京:东南大学出版社,2006:736-827.
[3] Clinical and Laboratory Standards Institute.Performance standards for antimicrobial susceptibility testing[S].Twenty-fifth informational supplement,2015,M100S.
[4] Clinical and Laboratory Standards Institute.Performance standards for antimicrobial susceptibility testing[S].Twenty-sixth informational supplement,2016,M100S,26th Edition.
[5] Clinical and Laboratory Standards Institute.Performance standards for antimicrobial susceptibility testing[S].Twenty-seventh informational supplement,2017,M100S,27th Edition.
[6]胡必杰,刘荣辉,陈文森.SIFIC医院感染预防与控制临床实践指引(2013年)[M].上海:上海科学技术出版社,2013:173-174.
[7]师静霞,杜雪飞,陈国玉.376株铜绿假单胞菌的临床分布及耐药性分析[J].哈尔滨医药,2015,35(2):132-134.
[8]税剑,邹明祥,李军,等.某院2016年ICU与普通病房铜绿假单胞菌耐药性对比分析[J].中国感染控制杂志,2018,17(1):6-9.
[9]胡付品,朱德妹,汪复,等.2015年中国CHINET 细菌耐药性监测[J].中国感染与化疗杂志,2016,16(6):685-694.
[10]胡付品,郭燕,朱德妹,等.2016年中国CHINET 细菌耐药性监测[J].中国感染与化疗杂志,2017,17(5):481-491.
[11]胡付品,郭燕,朱德妹,等.2017年中国CHINET 细菌耐药性监测[J].中国感染与化疗杂志,2018,18(3):241-251.
[12]王琼,李军,吴晓春,等.铜绿假单胞菌多重耐药危险因素分析[J/OL].临床检验杂志(电子版),2018,7(3):437.
[13]舒文,钱颖,刘庆中,等.上海市某教学医院2010至2014年铜绿假单胞菌耐药性变迁分析[J].检验医学,2016,12(31):1055-1060.
[14]王拧,孙珊.某大型教学医院2013-2015年铜绿假单胞菌的耐药性监测[J].中国抗生素杂志,2017,42(7):586-591.
[15] Cerceo E,Deitelzweig S B,Sherman B M,et al.Multidrug-Resistant Gram-Negative Bacterial Infections in the Hospital Setting:Overview,Implications for Clinical Practice,and Emerging Treatment Options[J].Microb Drug Resist,2016,22(5):412-431.
[16]龚美亮,丛玉隆.铜绿假单胞菌耐药机制研究现状[J].医学检验与临床,2017,28(4):50-53.
[17]李玲,周飞,姜涛,等.综合医院住院患者感染的铜绿假单胞菌分布特点及耐药趋势[J].中国医学创新,2016,13(12):45-48.
[18] Saeed M,Rasheed F,Afzal R K,et al.Pseudomonas aeruginosa:Evaluation of Pathogen Burden and Drug-Resistance Trends in a Tertiary Care Hospital[J].J Coll Physicians Surg Pak,2018,28(4):279-283.
[19] Potron A,Poirel L,Nordmann P.Emerging broad-spectrum resistance in Pseudomonas aeruginosa and Acinetobacter baumannii:Mechanisms and epidemiology[J].Int J Antimicrob Agents,2015,45(6):568-585.
[20] Poole K.Stress responses as determinants of antimicrobial resistance in Pseudomonas aeruginosa:multidrug efflux and more[J].Can J Microbiol,2014,60(12):783-791.
(收稿日期:2018-07-31) (本文编辑:程旭然)



