韩月 宋丽萍
肺癌是全球发病率及死亡率最高的癌症之一,对人类的生存与健康造成极大的威胁,其中80%~85%的肺癌为非小细胞肺癌(non-small cell lung cancer,NSCLC)[1]。相比小细胞肺癌,NSCLC生长及转移缓慢,根治性手术切除是早期NSCLC的首选治疗手段[2],并且预后相对较好,而准确的纵隔淋巴结分期是治疗方案选择的重要依据之一[3]。计算机体层成像(computed tomography,CT)是肺癌患者常规的检查之一,通过CT 图像上淋巴结的形态和大小,可对其性质进行初步评估,影像医生通常以淋巴结短径≥1 cm 作为发生转移的诊断标准[4]。但临床工作中发现,这一方式对淋巴结早期转移诊断并不准确,并且炎症所导致反应性增生的淋巴结也存在假阳性的情况[5],因此临床上亟需一种可以更准确评估淋巴结性质的方法。近年来,18氟-脱氧葡萄糖正电子发射计算机断层显像(18F-fluorodeoxyglucose positron emission tomography/computed tomography,18F-FDG PET/CT)被广泛应用于恶性肿瘤的术前检查,其优点是将解剖结构与代谢信息相结合,从分子层面上诊断组织的良恶性,其效能明显优于常规CT[6],但其以SUVmax≥2.5 作为恶性病变诊断标准仍存有争议,本研究旨在引入新代谢参数以提高PET/CT 对NSCLC 纵隔淋巴结转移的诊断效能。
1 资料与方法
1.1 一般资料 回顾性分析锦州医科大学附属第一 医院2019 年4 月-2020 年12 月的44 例NSCLC 患者,术前行18F-FDG PET/CT 检查。纳入标准:(1)无18F-FDG PET/CT 检查及手术禁忌证;(2)延迟显像在注射显像剂后110~160 min 范围内完成采集;(3)淋巴结短径≥0.3 cm;(4)行18F-FDG PET/CT检查后两周内进行根治性切除+淋巴结清扫,术后病理证实为NSCLC,明确各区淋巴结性质。排除标准:(1)合并其他恶性肿瘤病史;(2)检查前曾进行放化疗等辅助治疗;(3)合并肺部严重炎性疾病。其中男24 例,女20 例;年龄46~76 岁,中位年龄65 岁;腺癌30 例,鳞癌12 例,多形性癌1 例,大细胞癌1 例。44 例患者经手术切除的淋巴结共198 枚,其中非转移淋巴结(非转移组)150 枚,转移淋巴结(转移组)48 枚。本研究已经医学伦理委员会批准,免除受试者知情同意。
1.2 方法
1.2.1 图像采集 患者检查前6 h 应禁食,禁输注葡萄糖溶液,血糖控制在4~11 mmol/L;静脉注射显像剂18F-FDG 4.4.~5.5 MBq/kg(由南京江原安迪科正电子研究发展有限公司沈阳分公司生产,放化纯度>95%)。嘱患者于等待室休息1 h 同时饮水500~1 000 mL;患者排尿后行PET/CT 检查,(显像设备为上海联影医疗科技有限公司uMI780 型PET/CT),CT 管电压120 kV,电流40 mAs,螺距9.875 mm,采集范围为颅顶至大腿中段,仰卧位采集4~5 个床位,2 min/床位;采集的CT 图像与PET 图像融合成PET/CT 图像;早期显像采集完成后1 h 同法采集延迟图像。
1.2.2 图像分析 由两名资深核医学医师以双盲法分别进行图像分析及半定量分析,测量淋巴结短径;测量早期SUVmax 及延迟SUVmax,计算最大滞留指数RImax[(延迟SUVmax-早期SUVmax)/早期SUVmax];测量早期纵隔血池SUVmean(在降主动脉最大截面上勾画直径1 cm 的感兴趣区),计算早期SUV L/M(早期淋巴结SUVmax/ 纵隔SUVmean);测量肿瘤代谢体积(metabolic tumor volume,MTV)及病灶糖酵解总量(total lesion glycolysis,TLG)[7],若两名医师测量结果不一致,且差值小于或等于两者中最大值的10%,则最终测量结果取其平均值;若两者差值大于两者中最大值的10%,则再由更高资历的核医学科专家对其进行测量,取差异最小的两个数据的平均值作为最终测量结果,见图1。
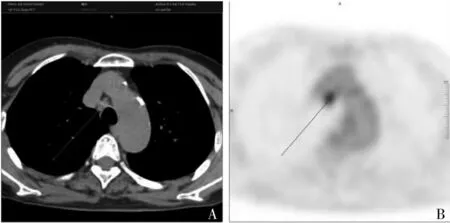
图1 非小细胞肺癌患者转移淋巴结的CT图像及PET图像
1.3 观察指标 比较转移组与非转移组淋巴结各参数,包括淋巴结短径、早期SUVmax、RImax、早期SUV L/M、MTV、TLG。分析NSCLC 纵隔淋巴结转移的独立危险因素,并建立NSCLC 纵隔淋巴结转移的联合诊断模型,比较传统诊断模型(淋巴结短径联合早期SUVmax)[8]与建立的联合诊断模型的诊断效能。
1.4 统计学处理采用SPSS(v.25.0,IBM,Armonk,NY)及MedCalc(Medcalc Softeware BVBA,Ostend,Belgium)进行数据处理,正态分布计量资料采用(x-±s)表示,进行t检验,非正态分布计量资料采用M(P25,P75)表示,进行Mann-WhitneyU检验,进一步运用多因素logistic 回归分析确定独立危险因素,建立联合诊断模型,通过绘制ROC 曲线,比较曲线下面积AUC 值对比联合诊断模型与传统诊断标准的诊断效能,最后运用Z检验比较其诊断效能有无统计学差异。P<0.05 作为差异有统计学意义的标准。
2 结果
2.1 转移组与非转移组一般资料比较 转移组和非转移组的年龄、性别及肿瘤类型比较,差异均无统计学意义(P>0.05),见表1。
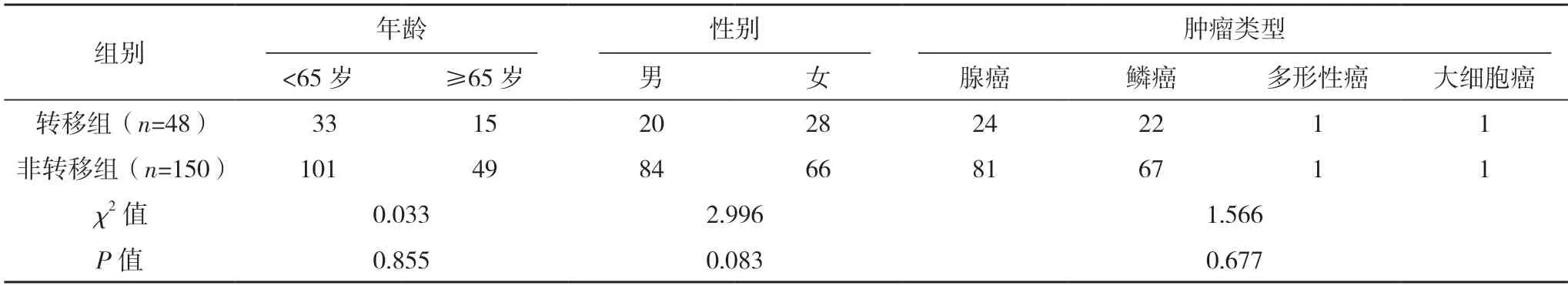
表1 转移组与非转移组一般资料比较(例)
2.2 转移组与非转移组淋巴结各参数比较 44 例患者经手术切除的198 枚淋巴结短径为(0.580±0.241)cm,早期SUVmax 为1.925(1.438,3.595),RImax 为(4.727±0.300)%,早期SUV L/M 为1.038(0.701,1.998),MTV 为0.407(0.193,0.954),TLG 为0.576(0.268,2.612)。转移组淋巴结短径、早期SUVmax、RImax、早期SUV L/M、MTV、TLG均高于非转移组(P<0.05)。见表2。
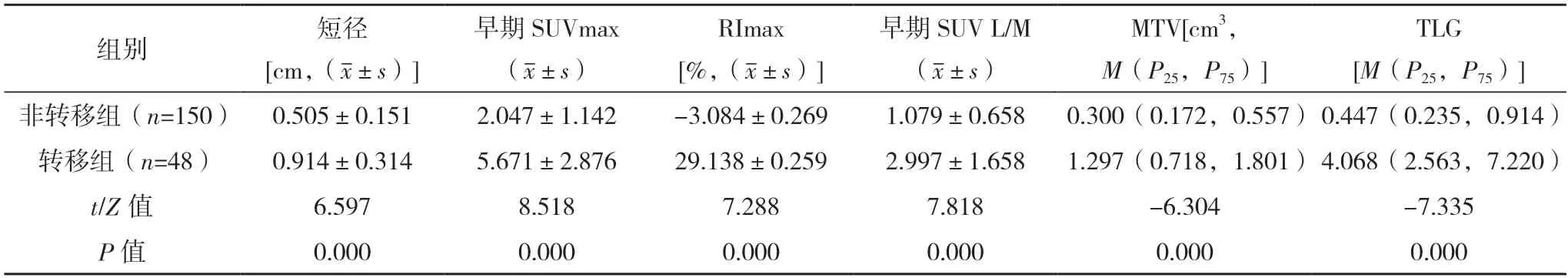
表2 转移组与非转移组淋巴结各参数比较
2.3 多因素logistic 回归分析 将淋巴结短径、早期SUVmax、RImax、早期SUV L/M、MTV、TLG 用逐步法进行多因素logistic 回归分析,最终纳入方程的变量为早期SUVmax 及RImax,方程系数分别为1.007(P=0.000)、0.046(P<0.05),早 期SUVmax及RImax 为NSCLC 纵隔淋巴结转移的独立危险因素,并建立NSCLC 纵隔淋巴结转移的联合诊断模型y=-5.184+1.007x1+0.046x2(x1为早期SUVmax,x2为RImax)。见表3。
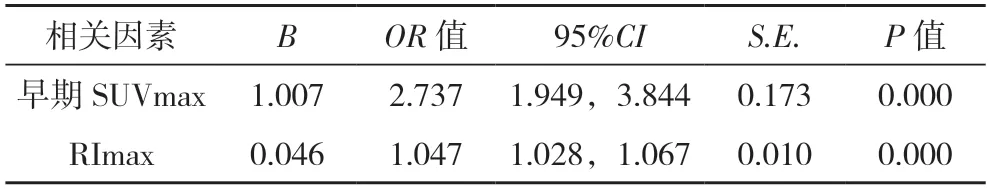
表3 多因素logistic 回归分析纳入方程的参数
2.4 两种诊断模型的诊断效能比较 分别绘制传统诊断模型(淋巴结短径联合早期SUVmax 和联合诊断模型(早期SUVmax 联合RImax)的ROC 曲线,见图2。联合诊断模型的诊断效能高于传统诊断模型(Z=2.181,P=0.030),见表4。
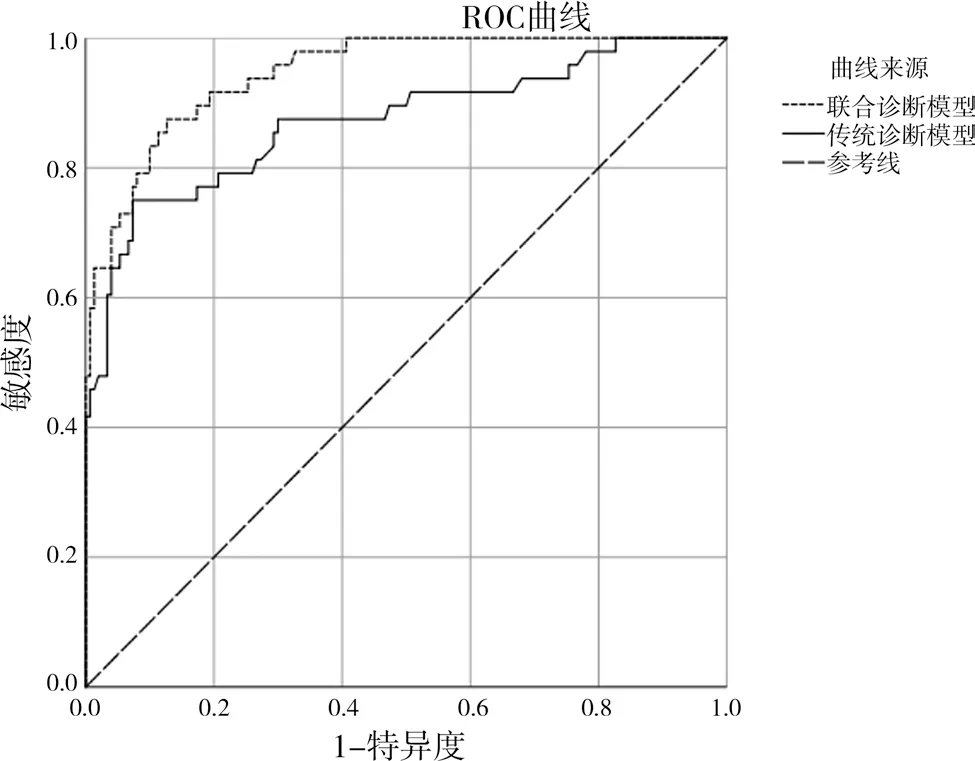
图2 传统诊断模型和联合诊断模型的ROC曲线
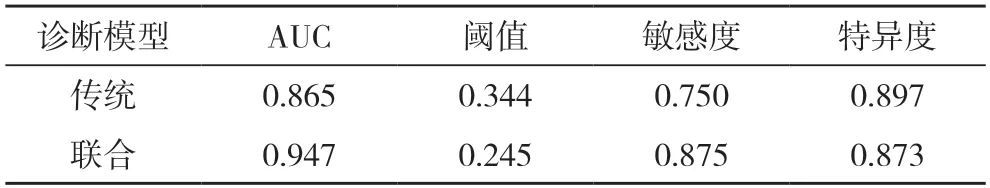
表4 传统诊断模型与联合诊断模型的诊断效能比较
3 讨论
近年来,NSCLC 的死亡率呈持续下降趋势,很大程度上得益于医学诊疗方面的提升[9]。尤其对于无远处转移的NSCLC 患者来说,提高纵隔淋巴结分期的准确性对患者的治疗及预后至关重要。作为一种新兴的无创影像学检查,PET/CT 不仅可以全身显像,发现有无远处转移病灶,还可以在常规CT显示解剖结构的基础上反应代谢功能,大大提高了纵隔转移淋巴结的检出率[10]。但目前仍没有完善的NSCLC 纵隔淋巴结转移诊断标准,传统诊断标准以淋巴结短径≥1 cm 及早期SUVmax≥2.50 来诊断淋巴结转移经大量研究证明准确率并不十分理想[11]。
本研究引入了18F-FDG PET/CT 的参数,包括淋巴结短径、早期SUVmax、RImax、早期SUV L/M、MTV、TLG,探究其与纵隔淋巴结转移的关系。转移淋巴结较非转移淋巴结生长代谢活跃,其倍增时间相对较短,体积普遍较大,代谢较高,所以引入短径、MTV、早期SUVmax 及TLG 这些参数。炎性疾病也可以导致淋巴结反应性增生,糖代谢增高,但并不像恶性肿瘤般持续摄取显像剂,继而结合了延迟显像SUVmax,引入RImax 这个参数。基于个体的基础代谢率不同,可能出现某个体的各组织SUVmax 普遍增高,因此又引入了早期SUV L/M 来进行研究。
本研究结果表明以上参数对诊断NSCLC 纵隔淋巴结转移均有一定价值,但多因素分析结果显示早期SUVmax 和RImax 是NSCLC 患者纵隔淋巴结转移的独立危险因素,早期SUVmax、RImax 值越高,该淋巴结转移的可能性越大。早期SUVmax 的诊断价值一直被国际所认可,对临床有着重要意义,但目前其诊断阈值尚不统一[12-13],18F-FDG PET/CT传统诊断方法以早期SUVmax=2.50 为阈值作为诊断恶性病变的标准,但这一标准未将各个系统或不同病理类型的肿瘤加以区分,特异性和准确性较低。并且,传统方法以短径或单独的早期SUVmax作为诊断标准的方法存在偏差,反应性增生的炎性淋巴结体积普遍较大,早期显像代谢增高但延迟显像多下降,这与恶性病变持续高代谢的特征明显不同,本研究利用这一特性,研究延迟显像的代谢参数,发现RImax 也是NSCLC 纵隔淋巴结转移的独立危险因素,进一步将RImax 和早期SUVmax纳入logistic 回归分析,共同建立联合诊断模型y=-5.184+1.007x1+0.046x2,其ROC 曲线下面积为0.947,其敏感度和特异度分别为0.875 和0.873,预测效能与张婷婷[14]的研究结果相似,这说明本研究建立的联合模型可以很好地诊断NSCLC 纵隔淋巴结转移。
Yang 等[15]研究表明参数早期SUV L/M 有着重要临床意义,且早期SUV L/M=1.7 时诊断效能最高,Mallorie 等[16]也认为早期SUV L/M 的敏感度最高,但其只考虑了个体之间的差异,如血糖、基础代谢率等,没有考虑转移淋巴结的生物学特征,当加入延迟显像的PET/CT 代谢参数,并减少混杂因素的影响后,则RImax 成为NSCLC 的独立危险因素,此结果说明虽早期SUV L/M 对诊断NSCLC 纵隔淋巴结转移有意义,但其并不是诊断NSCLC 纵隔淋巴结转移的最佳标准。Gedik 等[17]认为在评估纵隔淋巴结受累方面MTV 比其他参数更有价值,因其勾画的感兴趣区为淋巴结代谢体积,相比于短径更加能反应淋巴结的整体。SUVmax 代表某一截面勾画的感兴趣区中SUV 最大值,TLG 代表在三维结构上勾画的该淋巴结的糖酵解总量,有研究表明TLG相比于SUVmax 更能体现淋巴结的代谢功能[18],因TLG 可以在三维层面上对淋巴结的整体进行更客观的评价,克服了早期SUVmax 的局限性。而本研究MTV 和TLG 虽有一定诊断价值,但其受测量者主观影响较大,且并不能准确的勾画出ROI,导致测量误差较大,有待在技术等方面得以改进。
本研究的不足在于是样本量较小的回顾性分析,未进行各病理类型的分组或根据淋巴结的大小分组,还需大样本的研究加以改进。综上所述,早期SUVmax 和RImax 是NSCLC 淋巴结转移的独立危险因素,联合诊断模型有着很高的诊断价值,对临床有着重要意义。



