王金彩,王淑雨,刘小红,路平,李小瑞
新乡医学院第一附属医院1药学部,3肿瘤科,河南新乡453100
2郑州大学医学科学院药理系,郑州450001
肝癌的病死率位居全部恶性肿瘤的第2位[1],严重危害人类的生命健康。目前,肝癌的主要治疗手段包括手术治疗和放化疗,虽然取得一定效果,但仍然不满足要求,寻找安全有效的治疗方法是研究的热点。水飞蓟宾于水飞蓟果实中提取,属于黄酮木质类化合物,可保护肝细胞,且对肝组织炎症和其他损伤具有治疗作用[2]。研究表明,水飞蓟宾具有抗癌作用,对卵巢癌、宫颈癌、皮肤癌、舌鳞癌均有抑制作用[3-6]。本研究探讨水飞蓟宾对肝癌细胞增殖和侵袭能力的影响,以期为肝癌的治疗提供新思路,现报道如下。
1 材料与方法
1.1 细胞、主要试剂和仪器
人肝癌细胞HepG2购自中国科学院细胞库。试剂:青霉素、链霉素均购自上海紫一试剂厂,水飞蓟宾、胰蛋白酶、RPMI1640培养基均购自美国Sigma公司,胎牛血清购自美国Gibco公司,信号转导及转录激活因子3(signal transducers and activators of transcription 3,STAT3)单克隆抗体、磷酸化的STAT3(p-STAT3)单克隆抗体、基质金属蛋白酶-9(matrix metalloprotease-9,MMP-9)单克隆抗体、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)单克隆抗体均购自美国Stanta公司,二喹啉甲酸(bicinchoninic acid,BCA)蛋白浓度检测试剂盒、细胞蛋白提取试剂盒均购自碧云天生物技术研究所。仪器:HBS-1096A酶联免疫检测仪购自南京德铁实验设备有限公司,TS100倒置显微镜购自日本尼康公司。
1.2 实验方法
1.2.1 细胞培养取出保存于液氮罐中的肝癌细胞HepG2,37℃融化60 s,以5 ml的细胞培养液(含10%胎牛血清、100 U/ml青霉素、0.1 mg/ml链霉素的RPMI1640培养基)重悬细胞,离心半径为8 cm,1000 r/min离心10 min,吸除上清液,加入5 ml的细胞培养液悬浮细胞,接种至细胞培养瓶,置于37℃、饱和湿度、5%CO2培养箱中培养。细胞融合度达到90%左右时,吸除细胞培养液,以0.25%的胰蛋白酶37℃消化2 min,转移至离心管中,离心半径为8 cm,1000 r/min离心10 min,加入适量的细胞培养液,根据实验要求将细胞按照不同比例接种至细胞培养瓶中继续培养。
1.2.2 噻唑蓝检测细胞的增殖能力 取对数生长期的肝癌细胞,胰蛋白酶消化后,调整细胞浓度为6×104/ml,以每孔100 μl的细胞悬浮液接种至96孔细胞培养板,培养过夜后,分别将细胞培养液更换为含有0、50、100、200和400 μmol/L的水飞蓟宾细胞培养液,设置空白组,空白组中不加细胞,每个浓度梯度设置6个复孔。将上述细胞于CO2培养箱中培养48 h,加入5 mg/ml的噻唑蓝(methylthiazolyldiphenyl-tetrazolium bromide,MTT)溶液,20 μl/孔,37 ℃反应 4 h,吸除上清液后,加入150 μl的二甲基亚砜溶液孵育10 min。观察结晶物完全溶解后,酶联免疫检测仪检测490 nm处每孔的吸光度值(A值),以0 μmol/L的水飞蓟宾作用组为对照,计算细胞存活率。细胞存活率=(水飞蓟宾作用组A值-空白组A值)(/0 μmol/L水飞蓟宾作用组A值-空白组A值)×100%。
1.2.3 Transwell小室检测细胞的侵袭能力于Transwell小室中每孔加入50 μl的基质胶,37℃湿化2 h。取培养至对数生长期的肝癌细胞,分别用含0、200 μmol/L的水飞蓟宾细胞培养液(不含10%胎牛血清)重悬细胞,使每毫升细胞悬浮液中含有1×105个细胞。在Transwell小室的上室加入400 μl的细胞悬浮液,下室加入600 μmol/L的含有10%胎牛血清的细胞培养液,37℃、5%CO2培养箱中培养48 h后,用棉签擦掉没有穿膜的细胞,无水乙醇固定20 min后,苏木素染色。显微镜下随机选取5个视野观察侵袭细胞数目。
1.2.4 蛋白质印迹法(Western blot)检测细胞中STAT 3、p-STAT 3和MMP- 9蛋白的表达水平肝癌细胞经0、200 μmol/L的水飞蓟宾作用48 h后,按照蛋白提取试剂盒说明书提取细胞总蛋白,采用BCA蛋白浓度检测试剂盒检测提取的蛋白浓度。取蛋白样品加入等体积的2×Loading buffer混合后,100℃煮沸5 min至蛋白变性,加入至聚丙烯酰胺凝胶电泳(10%分离胶,5%浓缩胶)上样孔中,每孔加入50 μl的变性蛋白样品进行电泳,初始电压80 V,观察溴酚蓝进入分离胶后,将电压调整为120 V至溴酚蓝进入分离胶底端,电泳结束。4℃、90 V将蛋白转膜,转膜时间为90 min,用5%脱脂奶粉37℃封闭90 min。加入一抗(500倍稀释,4℃孵育过夜)、二抗(2000倍稀释,37℃孵育60 min),滴加显色液,以GAPDH为内参,分析STAT3、p-STAT3、MMP-9蛋白的表达水平。
1.2.5 STAT 3信号通路激活剂SD19对肝癌细胞存活率、侵袭细胞数目和STAT 3、p-STAT 3、MMP- 9蛋白表达的影响根据处理方法不同,将肝癌细胞分为未处理组、药物作用组和激活剂组,其中未处理组不加入任何药物,药物作用组细胞培养液中加入200 μmol/L的水飞蓟宾,激活剂组在药物作用组的基础上再加入8 μmol/L的STAT3信号通路激活剂SD19。将3组细胞培养48 h后,MTT检测细胞存活率,Transwell小室检测侵袭细胞数目,Western blot检测细胞中 STAT3、p-STAT3、MMP-9蛋白的表达水平。
1.3 统计学方法
采用SPSS 22.0软件对数据进行统计分析。计量资料以均数±标准差(±s)表示,两组间比较采用两独立样本t检验,多组间比较采用单因素方差分析,多组间两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 细胞存活率的比较
分别采用0、50、100、200和400 μmol/L的水飞蓟宾处理后的肝癌细胞,细胞存活率随水飞蓟宾浓度升高而逐渐下降,半数抑制浓度(half maximal inhibitory concentration,IC50)为(198.64 ± 25.61)μmol/L。(图1)

图1 不同浓度水飞蓟宾作用于肝癌细胞后的细胞存活率
2.2 侵袭细胞数目比较
200 μmol/L的水飞蓟宾作用于肝癌细胞后侵袭细胞数目为(96.35±13.24),明显少于0 μmol/L的水飞蓟宾作用后的(192.58±13.64),差异有统计学意义(t=16.94,P<0.01)。
2.3 STAT 3、p-STAT 3和MMP- 9蛋白表达水平的比较
Western blot结果显示,与 0 μmol/L 的水飞蓟宾作用的肝癌细胞相比,200 μmol/L的水飞蓟宾作用于肝癌细胞后,p-STAT3和MMP-9蛋白表达水平均明显下降,差异有统计学意义(P<0.01);而0 μmol/L与200 μmol/L的水飞蓟宾作用的肝癌细胞STAT3蛋白表达水平比较,差异无统计学意义(P>0.05)。(图2、表1)
2.4 3组细胞存活率、侵袭细胞数目、STAT 3、p-STAT 3和MMP- 9蛋白表达水平的比较

图2 Western blot检测肝癌细胞中STAT 3、p-STAT 3和MMP- 9蛋白的表达情况
表1 不同浓度水飞蓟宾处理后肝癌细胞中STAT 3、p-STAT 3和MMP- 9蛋白表达情况的比较(± s)

表1 不同浓度水飞蓟宾处理后肝癌细胞中STAT 3、p-STAT 3和MMP- 9蛋白表达情况的比较(± s)
水飞蓟宾浓度0 μ m o l/L 2 0 0 μ m o l/L t值P值3.2 5±0.2 4 0.6 8±0.0 6 1 7.9 9 0.0 0 0.9 6±0.1 1 0.3 6±0.0 4 8.8 8 0.0 0 1.3 6±0.2 3 1.4 5±0.1 7 0.5 4 0.6 1 M M P-9 p-S T A T 3 S T A T 3
3组细胞存活率、侵袭细胞数目、p-STAT3和MMP-9蛋白表达水平比较,差异均有统计学意义(P<0.05)。药物作用组和激活剂组的细胞存活率、侵袭细胞数目、p-STAT3和MMP-9蛋白表达水平均明显低于未处理组,且激活剂组的细胞存活率、侵袭细胞数目、p-STAT3和MMP-9蛋白表达水平均明显高于药物作用组,差异均有统计学意义(P<0.01),但3组肝癌细胞中STAT3蛋白表达水平比较,差异无统计学意义(P>0.05)。(图3、表2)
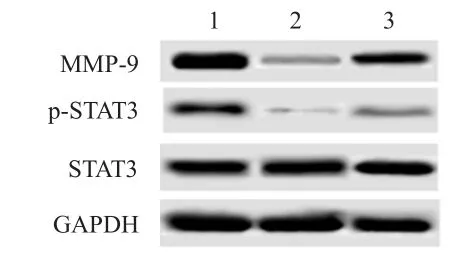
图3 Western blot检测 3组细胞中STAT 3、p-STAT 3和MMP- 9蛋白的表达情况
表2 3组细胞存活率、侵袭细胞数目、STAT 3、p-STAT 3和MMP- 9蛋白表达水平的比较(± s)

表2 3组细胞存活率、侵袭细胞数目、STAT 3、p-STAT 3和MMP- 9蛋白表达水平的比较(± s)
注:a与未处理组比较,P<0.01;b与药物作用组比较,P<0.01
指标细胞存活率(%)侵袭细胞数目S T A T 3 p-S T A T 3 M M P-9 1 0 0.0 5±1 1.2 8 1 9 8.5 4±2 0.6 6 1.1 2±0.1 3 0.8 6±0.0 9 1.1 4±0.0 8 5 6.8 4±6.9 2 a 7 9.6 9±8.2 1 a 1.1 0±0.1 4 0.2 9±0.0 3 a 0.1 5±0.0 3 a 8 0.6 7±4.9 7 ab 1 2 8.6 7±1 6.8 3 ab 1.1 3±0.1 2 0.4 5±0.0 4 ab 0.6 7±0.0 9 ab未处理组药物作用组激活剂组
3 讨论
水飞蓟宾是一种黄酮类的化合物,由1分子的松柏醇和1分子的紫杉叶素构成[7]。水飞蓟宾具有抗自由基、降血压、抑制氧合酶、抑制肝纤维化、降血脂和增加心肌细胞抵抗力等多种作用[8-9]。研究表明,水飞蓟宾可抑制人黑色素瘤细胞A375-S2[10]、肝癌细胞[11]、乳腺癌细胞SKBR3[12]、前列腺癌细胞PC-33[13]、卵巢癌细胞A2780[14]等多种细胞的增殖。本研究分别以0、50、100、200和400 μmol/L的水飞蓟宾作用于肝癌细胞48 h后,MTT法检测细胞的增殖能力,结果发现,随水飞蓟宾作用浓度的升高,细胞存活率呈下降趋势。表明水飞蓟宾可抑制肝癌细胞的增殖能力,且呈浓度依赖性,与之前的报道一致[10-14],均说明其具有抗肿瘤作用。
肿瘤细胞的侵袭是肿瘤发生远处转移的前提条件。目前,研究发现,基质金属蛋白酶家族与肿瘤侵袭能力相关,因需要金属离子如钙、锌等的辅助才能够发挥作用而得名,具有降解细胞外基质的作用[15]。MMP-9由9个内含子和13个外显子组成,可维持细胞外基质平衡,其多种作用底物能够作用于Ⅳ、Ⅴ、Ⅶ、Ⅹ和Ⅺ胶原蛋白[16]。研究表明,MMP-9在肿瘤组织中的表达异常升高,可促进肿瘤细胞侵袭[17]。本研究中以0 μmol/L、200 μmol/L的水飞蓟宾作用于肝癌细胞,Transwell小室检测侵袭细胞数目,结果发现,200 μmol/L水飞蓟宾作用后的侵袭细胞数目和MMP-9表达水平均明显降低,表明水飞蓟宾可能通过抑制MMP-9的表达抑制肝癌细胞的侵袭。
STAT3是一个关键的信号传导蛋白,磷酸化后可形成二聚体进入细胞核内调控靶基因的转录[18]。STAT3信号转导通路与肿瘤发生有关,能够通过调控肿瘤细胞的生长、侵袭过程,影响肿瘤的发生和发展。肿瘤组织中,STAT3信号转导通路异常激活可促进肿瘤细胞生长,而肿瘤组织中的p-STAT3蛋白表达升高,可抑制STAT3信号转导通路激活,从而抑制肿瘤细胞的生长[19]。研究表明,肝癌组织中p-STAT3水平升高,其恶性程度随STAT3表达水平的降低而降低,抑制STAT3表达后,肝癌小鼠模型的肿瘤细胞生长受到抑制[20-22]。本研究首先检测了200 μmol/L的水飞蓟宾作用后的肝癌细胞中STAT3信号通路的活化水平,结果发现,200 μmol/L的水飞蓟宾作用后,肝癌细胞中p-STAT3的表达水平降低。进一步用8 μmol/L的SD19和200 μmol/L的水飞蓟宾共同作用于肝癌细胞,结果发现,8 μmol/L的SD19和200 μmol/L的水飞蓟宾共同作用的激活剂组的细胞存活率、侵袭细胞数目、p-STAT3和MMP-9蛋白表达水平均明显高于单纯水飞蓟宾药物作用组(P<0.01)。表明STAT3信号通路激活剂能够部分逆转水飞蓟宾对肝癌细胞的抑生长和抑侵袭作用。本研究尚存在一定的不足之处,本研究仅于体外进行了细胞实验,后续将进一步进行体内的临床研究。
综上所述,水飞蓟宾能够抑制肝癌细胞增殖、侵袭,作用机制可能与抑制STAT3信号通路有关。



