张猛,沙林,马庆防,安刚,于如同,黎军#
1徐州市中心医院神经外科,江苏 徐州221000
2徐州医科大学附属医院神经外科,江苏 徐州221000
恶性胶质瘤是最常见的颅内原发性肿瘤,其恶性程度高、进展快、预后差,即使采用手术、放疗和化疗等综合治疗手段,疗效仍不理想,主要是由于胶质瘤细胞无限增殖所致。因此,探索胶质瘤细胞无限增殖的分子机制,发现潜在的分子治疗靶点,开展肿瘤分子靶向治疗是当今肿瘤研究领域的趋势与热点。遗传技术和生物学技术分析表明,高尔基体磷蛋白3(golgi phosphoprotein 3,GOLPH3)是一个全新的癌基因,能促进人类肿瘤细胞的增殖[1]。在对GOLPH3调节高尔基体的分泌和转运功能的研究中发现,VPS35能够与GOLPH3相互作用调控囊泡运输。通过这些发现可以推断GOLPH3、VPS35可能是蛋白转运中的关键分子,并且影响WNT信号通路下游信号发挥一系列的作用。WNT/β-catenin经典信号通路的激活参与胶质瘤的发生和发展,有可能成为治疗胶质瘤的新靶点。因此,本研究拟采用胶质瘤U251细胞系为研究对象,应用蛋白质印迹法(Western blot)、EdU等方法,检测GOLPH3对胶质瘤细胞增殖的影响,阐明GOLPH3通过调节WNT/β-catenin信号通路影响胶质瘤细胞增殖的分子机制,为胶质瘤的分子靶向治疗提供新的潜在靶点。
1 材料与方法
1.1 细胞与材料
U251胶质瘤细胞系购自中国科学院上海细胞库。siRNA oligo由上海吉玛制药技术有限公司设计及合成,兔抗β-肌动蛋白(β-actin)单克隆抗体购自美国Millipore Chemicon公司,兔抗GOLPH3单克隆抗体、兔抗WNT2单克隆抗体、兔抗G1/S-特异性细胞周期蛋白D1(cyclin D1)单克隆抗体、山羊抗VPS35单克隆抗体、兔抗β-catenin单克隆抗体均购自艾博抗(上海)贸易有限公司。其他常规试剂为进口分装或国产分析纯。
1.2 细胞培养
U251胶质瘤细胞用含10%小牛血清的DMEM培养基,在37℃、5%CO2、相对湿度为90%的培养箱中培养,细胞呈贴壁生长。待细胞长满瓶底后,弃掉培养液,用0.25%胰蛋白酶消化,2~3天后分瓶传代培养,取对数生长期的细胞用于实验。
1.3 细胞转染与分组
将转染negative control siRNA oligo和各siRNA oligo的细胞分别设为阴性对照组(siNC组)和下调组(siGOLPH3组、siWNT2组、siβ-catenin组)。将GOLPH3、WNT2、β-catenin基因序列交于上海吉玛制药技术有限公司设计及合成目的小干扰序列及阴性对照小干扰序列。negative control siRNA oligo正义:5'-UUCUCCGAACGUGUCACGUdTdT-3',negative control siRNA oligo反义5'-ACGUGACACGUUCGGAGAAdTdT-3';GOLPH3-siRNA oligo正义:5'-GUUAAGAAAUGUACGGGAATT-3',GOLPH3-siRNA oligo反义:5'-UUACAGAUUACCUUUCUUGTT-3';WNT2-siRNA oligo正义:5'-GACGAUGGGAAGCGCCAAGTT-3',WNT2-siRNA oligo反义:5'-CUUGGCGCUU-CCCAUCUUCTT-3';β-catenin siRNA oligo正义:5'-CAUGCAGAAUACAAAUGAUTT-3',β-catenin siRNA oligo反 义 :5'-GUACGUCUUAUGUUUACUATT-3'。 将脂质体与siRNA按1∶2混合,每孔用量为脂质体5µl,siRNA 10µl,各用 opti-MEM 培养基 250µl稀释,室温静置5 min,将两者混匀室温静置孵育20 min,然后直接将混合物加入6孔板中。轻轻摇晃混匀,于培养箱内培养5 h后换为含10%小牛血清的DMEM培养基继续培养,48 h后收集细胞。
1.4 EdU实验检测细胞增殖率
EdU是一种胸腺嘧啶核苷类似物,能够在细胞增殖时期代替胸腺嘧啶(T)渗入正在复制的DNA中,通过基于EdU与Apollo荧光染料的特异性反应快速检测细胞DNA复制活性,染色后荧光显微镜下增殖期细胞核呈红色。Hoechst33342染色液是一种适用于活细胞细胞核染色的溶液,染色后荧光显微镜下细胞核呈蓝色荧光,本研究通过检测荧光强度而统计细胞的增殖情况。
1.4.1 细胞培养与转染 细胞培养与转染方法同上,共设 siNC组、siGOLPH3组、siWNT2组、siβcatenin组,每组设3个复孔,采用EdU实验检测转染效果及细胞增殖率。
1.4.2 EdU标注 将细胞培养基按1000∶1的比例稀释EdU溶液,制备适量50 μmol/L EdU培养基;每孔加入100 μl 50 μmol/L EdU培养基孵育2 h,弃培养基;磷酸盐缓冲液(phosphate buffered saline,PBS)清洗细胞2次,每次5 min。
1.4.3 细胞固定 每孔加50 μl细胞固定液(即含4%多聚甲醛的PBS),室温孵育30 min,弃固定液;每孔加入50 μl 2 mg/ml的甘氨酸,脱色摇床孵育5 min,弃甘氨酸溶液;每孔加入100 μl PBS,脱色摇床清洗5 min,弃PBS;每孔加入100 μl渗透剂(含0.5%Triton X-100的PBS),脱色摇床孵育 10 min,PBS清洗5 min。
1.4.4 Apollo染色 每孔加入100 μl的1×Apollo染色反应液,避光,室温,脱色摇床孵育30 min后,弃反应液;加入100 μl渗透剂(含0.5%Triton X-100的PBS)脱色摇床清洗3次,每次10 min,弃渗透剂;每孔加入100 μl甲醇清洗2次,每次5 min,PBS清洗5 min。
1.4.5 DNA染色 用去离子水按100∶1的比例稀释Hoechst33342反应液,制备适量1×Hoechst33342反应液,避光保存;每孔加入100 μl 1×Hoechst33342反应液,避光,室温,脱色摇床孵育30 min后,弃染色反应液;每孔加入100 μl PBS清洗3次,每次10 min。
1.4.6 获取图像 荧光显微镜下随机取5个100倍视野,计算细胞总数(Hoechst)及增殖的细胞总数(EdU),计算增殖率。实验重复3次,取均值。
1.5 Westernblot法检测蛋白表达情况
1.5.1 提取细胞总蛋白U251细胞转染siRNA48 h后,吸出培养基,用预冷的PBS洗3遍,每孔加入200µl含蛋白酶抑制剂的细胞裂解液,冰上裂解30 min,后将细胞碎片和裂解液移到1.5 ml的离心管中,4℃、12 000 r/min离心25 min,取上清转移至无菌EP管中,检测蛋白浓度后分装到EP管中-80℃保存,取80µg蛋白样品加入蛋白上样液后煮沸5 min,上样。
1.5.2 制胶、电泳和转膜 配制10%分离胶和6%浓缩胶,80µg蛋白样品上样,100 mV、100 min电泳,电泳结束后,将聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis,PAGE)后的凝胶浸泡到预冷的电转液中平衡5 min。聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜在甲醇中浸泡3 min,活化后转移至预冷的电转液中平衡5 min,再置于电泳胶上,用剪刀修剪膜边缘,使其略大于胶的边缘,玻璃棒赶除气泡。将膜与胶夹在上下两层滤纸中间,压紧固定后置于电转槽中,以100 mV恒压转膜100 min。根据Marker转膜情况判断转膜效果。
1.5.3 封闭和抗体孵育 转膜结束后,用3%牛血清白蛋白(bovine serum albumin,BSA)封闭2 h,TBST洗膜3次,每次10 min,吸水纸吸干后,放入相应一抗 GOLPH3(1∶1000)、β-actin(1∶1000)、WNT2(1∶200)、β-catenin(1∶1000)稀释液中,4℃孵育过夜,TBST洗膜3次,每次10 min,吸水纸吸干后,加入对应二抗(1∶3000),室温、摇床孵育2 h。
1.5.4 蛋白检测 于暗室中,将电化学发光(electrochemiluminescence,ECL)试剂(0.125 ml/cm2)混匀后均匀滴于PVDF膜上,去除多余液体,然后移入X线胶片盒中,曝光30 s~5 min后进行显影,定影。Western blot和荧光信号强度经Image J软件采集并处理分析。蛋白相对表达量为每种研究蛋白与内参蛋白(actin)的比值。
1.6 统计学方法
采用SPSS 16.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示,两组间比较采用两独立样本t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 GOLPH 3 siRNA的转染效果及对WNT 2蛋白表达和U251细胞增殖的影响
相对于siNC组,siGOLPH3组细胞中GOLPH3蛋白相对表达量(0.166±0.069)明显降低,差异有统计学意义(t=12.14,P=0.007),表明siRNA转染效果佳。siGOLPH3组细胞中WNT2蛋白相对表达量(0.480±0.052)低于siNC组,差异有统计学意义(t=10.09,P=0.010)。与siNC组相比,siGOLPH3组细胞增殖率(0.177±0.033)%明显降低,差异有统计学意义(t=11.70,P=0.007)。(图1、图2)
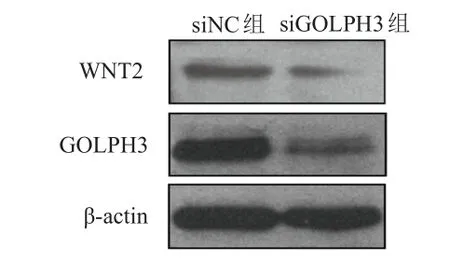
图1 Western blot法检测GOLPH 3及WNT 2蛋白表达情况
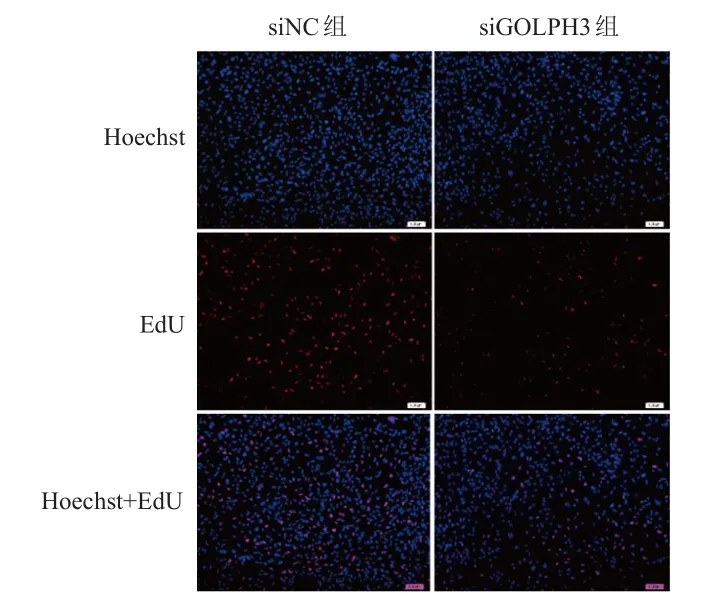
图2 EdU实验检测siNC组及siGOLPH 3组 U251细胞的增殖情况(×100)
2.2 WNT2siRNA的转染效果及对β-catenin、GOLPH3蛋白表达和U251细胞增殖的影响
相对于siNC组,siWNT2组细胞中WNT2蛋白相对表达量(0.336±0.056)明显降低,差异有统计学意义(t=10.79,P=0.007),表明siRNA转染效果佳。siWNT2组细胞中β-catenin蛋白相对表达量(0.596±0.091)低于siNC组,差异有统计学意义(t=4.43,P=0.047),表明WNT2对β-catenin产生影响。siWNT2组细胞中GOLPH3蛋白相对表达量为(1.010±0.052),与siNC组比较,差异无统计学意义(P>0.05),表明WNT2对GOLPH3蛋白表达无影响。与siNC组相比,siWNT2组细胞增殖率(0.676±0.029)%明显降低,差异有统计学意义(t=11.04,P=0.008)。(图3、图4)
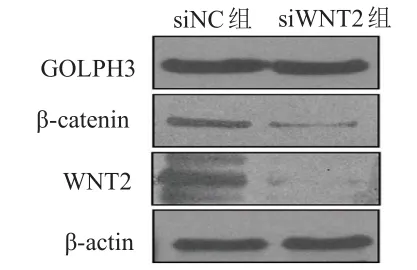
图3 Western blot法检测GOLPH 3、WNT 2及其下游 β-catenin蛋白表达情况
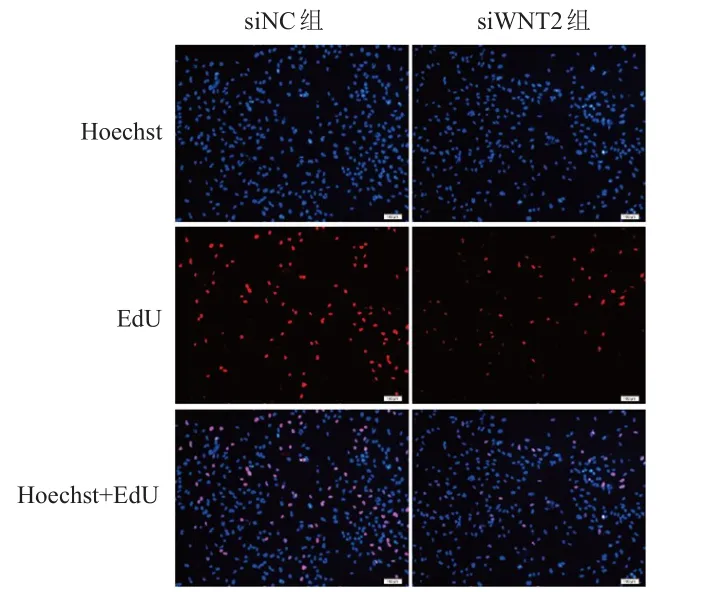
图4 EdU实验检测siNC组及siWNT 2组 U251细胞的增殖情况(×100)
2.3 β-cateninsiRNA的转染效果及对U251细胞增殖的影响
相对于siNC组,siβ-catenin组细胞中β-catenin蛋白相对表达量(0.365±0.034)明显降低,差异有统计学意义(t=18.60,P=0.003),表明siRNA转染效果佳。与siNC组相比,siβ-catenin组细胞增殖率(0.557±0.167)%降低,差异有统计学意义(t=6.90,P=0.020)。(图5、图6)
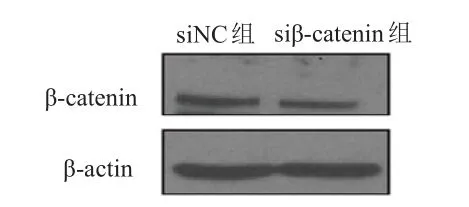
图5 Western blot法检测 β-catenin蛋白表达情况
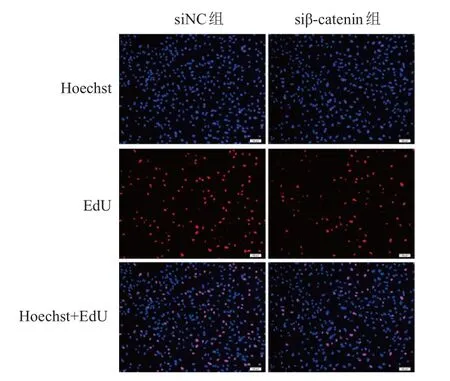
图6 EdU实验检测siNC组及 si β-catenin组 U251细胞的增殖情况(×100)
3 讨论
由于传统的手术切除、化疗和放疗对胶质瘤的治疗效果不佳,故胶质瘤的基因治疗是目前的研究热点之一。GOLPH3是一个高度保守的34 kD大小的蛋白[1-2],主要富集于高尔基体囊泡反面的膜外围,也存在于胞浆池[3]、小管、囊泡、内涵体小室以及质膜中[4-5]。研究表明,GOLPH3的这种分布对维持高尔基体的形态以及囊泡的分泌和转运都起着重要作用[6]。Scott等[1]报道,GOLPH3在肺癌、卵巢癌、乳腺癌、前列腺癌、黑色素瘤等多种人类实体瘤中高表达,而且GOLPH3可以通过调节磷脂酰肌醇3-羟激酶(phosphatidylinositol 3-hydroxy kinase,PI3K)-蛋白激酶 B(protein kinase B,PKB,又称AKT)-雷帕霉素靶蛋白(mammalian target of rapamycinm,MTOR)信号通路影响肿瘤的增殖及对雷帕霉素的敏感性。通过体外和体内实验证实,下调GOLPH3的表达可抑制肿瘤细胞的增殖,过表达GOLPH3则促进肿瘤细胞的增殖及对雷帕霉素的敏感性[1-2,7]。因此提出GOLPH3是一个全新的致癌基因,而且是第一个被发现的高尔基体癌基因蛋白[1-2]。此后,相继有研究报道GOLPH3在横纹肌肉瘤及胶质瘤中也有高表达[8-9],进一步证实了GOLPH3在人类实体瘤中的致癌活性。
遗传技术和生物学技术分析表明,GOLPH3能促进人类肿瘤细胞的增殖。肿瘤细胞都具有较强的增殖能力,在细胞周期中,处于分裂期的细胞增多,而将癌基因敲除后,细胞分裂减少,细胞增殖能力下降[10]。Zhou等[11]此前发现下调GOLPH3可以促进胶质瘤U251细胞的凋亡以及抑制U251细胞的增殖。为进一步研究GOLPH3对胶质瘤细胞增殖及凋亡的作用,该研究选用胶质瘤U87等细胞系作为研究对象,观察GOLPH3对胶质瘤细胞凋亡和增殖的影响,明确了GOLPH3对胶质瘤细胞增殖的影响具有普遍性。研究结果表明,过表达GOLPH3可以促进胶质瘤细胞的增殖,下调GOLPH3可以抑制胶质瘤细胞的增殖,促进其凋亡[11]。
进一步研究表明,GOLPH3在高尔基体分泌泡形成和运输过程中起着重要的作用[12]。GOLPH3与高尔基体反面的基质(trans Golgi network,TGN)动态相连,快速从TGN移动到细胞质,并分布于细胞内分泌泡和细胞质膜[13]。作为TGN蛋白家族的一员,GOLPH3与高尔基体的蛋白质加工、分类、包装与转运功能密切相关。内质网上合成的蛋白质,以囊泡的形式进入高尔基体的顺面,并经加工修饰后,在高尔基体的反面以出芽的方式排出分泌泡,到达质膜后囊泡与质膜融合并排出分泌蛋白。应用基因敲除技术减少细胞内GOLPH3的表达后,从高尔基体顺面转运到细胞质膜的分泌蛋白或脂质明显减少,而同时这种递质在内质网合成并进入高尔基体顺面的量并未改变,由此说明GOLPH3在高尔基体分泌泡形成和运输过程中起着重要的作用[14]。
在对GOLPH3调节高尔基体的分泌和转运功能的研究中发现,VPS35能够与GOLPH3相互作用调控囊泡运输。VPS35是Retromer复合体的组成部分,Retromer复合体由2个亚基组成,负责装载的亚基由VPS26、VPS29、VPS35组成,调控细胞跨膜蛋白从核内体到高尔基体的转运[15-18]。应用基因敲除技术敲除VPS35,发现会抑制一些跨膜蛋白的转运,例如表皮生长因子受体(epidermal growth factor receptor,EGFR)、WNT配体转运蛋白等,并且影响WNT等一些表面受体的功能[19-22]。
WNT是一类分泌型糖蛋白,通过自分泌或旁分泌发挥作用[23]。WNT信号通路能引起细胞内β-catenin积累。β-catenin是一种多功能蛋白质,在细胞连接处与钙黏素相互作用,参与形成黏合带,而游离的β-catenin可进入细胞核,调节基因表达,影响细胞的增殖等[24-25]。WNT/β-catenin信号通路的激活参与胶质瘤的发生和发展,其异常表达、激活及支架蛋白AXIN、腺瘤性结肠息肉病基因或β-catenin的突变都会导致肿瘤的形成[26-29]。WNT信号通路可概括为:WNT→卷曲蛋白→蓬乱蛋白→β-catenin降解复合体解散→β-catenin积累进入细胞核→结合T细胞因子→激活基因转录(如c-myc、cyclin D1)[30]。 通 过 这 些 发 现 可 以 推 断GOLPH3、VPS35可能是蛋白转运中的关键分子,通过影响从核内体到高尔基体的转运调节WNT及其下游信号发挥一系列的作用。
本研究在胶质瘤U251细胞中,用siRNA下调GOLPH3表达后,应用Western blot法检测WNT2的表达。结果显示,下调GOLPH3表达后,WNT2的表达受到抑制。应用EdU法检测发现分别下调WNT2、β-catenin后,U251细胞增殖受到抑制,提示GOLPH3对胶质瘤细胞增殖的影响有可能通过WNT/β-catenin信号通路实现。
文献表明,VPS35能够与GOLPH3相互作用调控囊泡运输[16]。本研究结果推测,GOLPH3通过WNT/β-catenin信号通路参与胶质瘤的发生和发展,可能是通过VPS35介导,调节WNT在核内体和高尔基体之间的转运进而发挥作用。为此,下一步将以此为研究内容进一步深化研究。
本研究期望通过对GOLPH3及其信号通路进行更加深入的研究,进一步揭示GOLPH3调控胶质瘤生长的机制,为胶质瘤的靶向治疗提供理论依据。此外,也为胶质瘤之外的其他肿瘤的分子靶向治疗提供重要的参考与理论支持。



