林建松,廖翏,许淑霞
福建省妇幼保健院病理科,福州 350001
宫颈腺癌是常见的妇科肿瘤,约占宫颈癌的25%,发病率逐年提高且有年轻化趋势[1-3]。2020年世界卫生组织(WHO)接受国际颈管腺癌标准与分类(International Endocervical Adenocarcinoma Criteria and Classification,IECC)[4-7],把宫颈腺癌主要分为非特异性宫颈腺癌、人乳头瘤病毒相关腺癌(human papilloma virus-associated adenocarcinoma,HPVA)、非人乳头瘤病毒相关腺癌(non-human papilloma virus-associated adenocarcinoma,NHPVA)以及罕见的子宫内膜样腺癌。本研究对17 例NHPVA 患者的临床资料进行回顾性分析,探讨其临床病理意义。
1 资料与方法
1.1 一般资料
对2017—2022 年在福建省妇幼保健院诊断并行手术根治的具有完整临床病理资料的17 例NHPVA 患者的病历资料进行回顾性分析。所有患者平均年龄(49.69±9.34)岁;分型[5]:胃型腺癌11例,透明细胞型腺癌2 例,中肾管型腺癌1 例,非特殊类型腺癌3 例。将17 例NHPVA 分为胃型腺癌组(11 例)与非胃型腺癌组(6 例)。本研究经医院伦理委员会批准通过,所有患者均知情同意。
1.2 检测方法
所有标本均经4%中性甲醛固定,常规脱水、石蜡包埋,4 μm 厚切片,苏木精-伊红(hematoxylineosin,HE)染色。免疫组织化学染色采用EnVision二步法,所用主要一抗包括p16(鼠抗人)、p53(鼠抗人)、Ki-67(鼠抗人)、黏蛋白6(mucin 6,MUC6)(鼠抗人)、细胞角蛋白7(cytokeratin 7,CK7)(鼠抗人)、癌胚抗原(carcinoembryonic antigen,CEA)(鼠抗人)、尾型同源盒2(caudal type homeobox 2,CDX2)(兔抗人)、雌激素受体(estrogen receptor,ER)(兔抗人)、孕激素受体(progesterone receptor,PR)(兔抗人)、GATA 结合蛋白3(GATA binding protein 3,GATA3)(兔抗人)、天冬氨酸蛋白酶A(aspartic proteinase napsin,Napsin A)等抗体及En-Vision 试剂盒均购自福州迈新生物技术开发有限公司。免疫组织化学染色步骤按各抗体说明书进行,所有免疫组织化学染色均设阳性和阴性对照。
免疫组织化学染色判定标准[8]:p53 蛋白弥漫细胞核着色(≥80%)和完全阴性定义为突变型表达;p16 弥漫大片染色判定为阳性;MUC6≥5%细胞着色判定为阳性;ER、PR、Ki-67 与GATA3 细胞核染色判定为阳性,CK7、CEA、CDX2 与Napsin A 细胞质染色判定为阳性。
1.3 统计学分析
采用SPSS 24.0 软件进行数据分析,计量资料以均数±标准差(±s)表示,组间比较采用t检验;计数资料以例数表示,组间比较采用Fisher 确切概率法;以P<0.05 为差异有统计学意义。
2 结果
2.1 临床特征
17 例患者临床表现各有差异,主要表现为阴道流血、接触性出血、月经量增多、宫腔积液等。大多数患者因为出现症状体征行妇科检查发现宫颈病变,其中2 例因卵巢转移导致腹胀就诊时行宫颈活检发现,1 例因常规体检宫颈液基薄层细胞学检查(thin-prep cytology test,TCT)报告非典型腺细胞发现。宫颈可见结节状肿大,影像学表现可见宫颈管内浸润性肿块。
2.2 病理特征
17 例NHPVA 中,胃型腺癌11 例,中肾管型腺癌1 例,透明细胞型腺癌2 例,非特殊类型腺癌3例。胃型腺癌镜下肿瘤细胞呈胃型分化,从分化良好的腺体到分化差的腺体均可出现,细胞质丰富、透明或淡染嗜酸性,边界明显,基底细胞核异型性低,核分裂象不明显,可见促纤维间质反应。与卵巢透明细胞癌类似,宫颈透明细胞型腺癌常为实性、乳头状和/或管囊状结构,有细胞质丰富、透明或嗜酸性的多角或钉突状细胞,常可见透明间质,核分裂象少见。中肾管型腺癌镜下表现为导管状、管状浸润性腺体,腺管上皮呈立方或矮柱状,管腔内见嗜酸性分泌物及坏死。非特殊类型腺癌为不能被归类的其他类型,分化较差,主要为实性结构和高度异型性核,而细胞质内黏液通常很少。(图1)
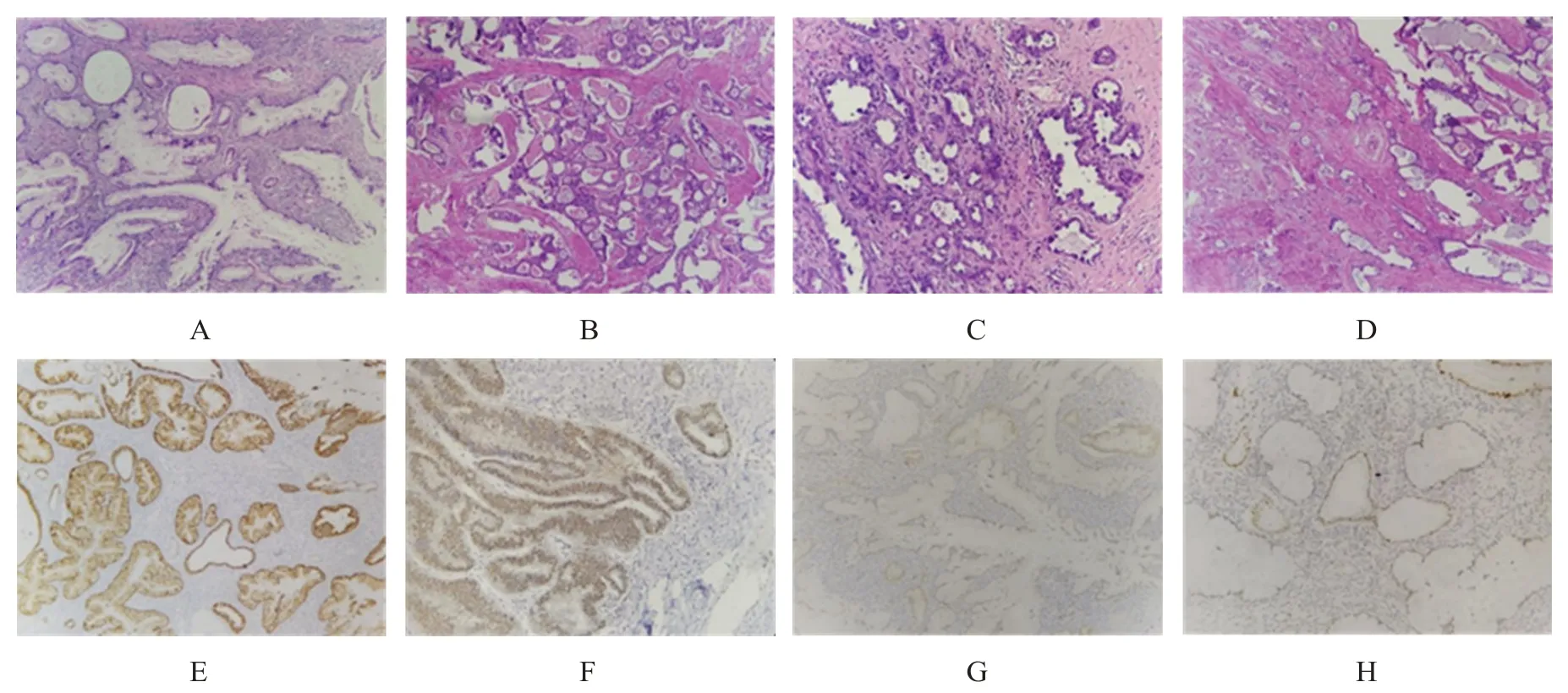
图1 不同病理类型NHPVA的病理图片及典型免疫表型
胃型腺癌与非胃型腺癌患者年龄及淋巴结转移、脉管内瘤栓、p53突变情况比较,差异均无统计学意义(P>0.05)。胃型腺癌国际妇产科联盟(International Federation of Gynecology and Obstetrics,FIGO)分期主要为Ⅲ/Ⅳ期,非胃型腺癌FIGO 分期主要为Ⅰ期,非胃型腺癌均未发生附件转移(P<0.05)。(表1)
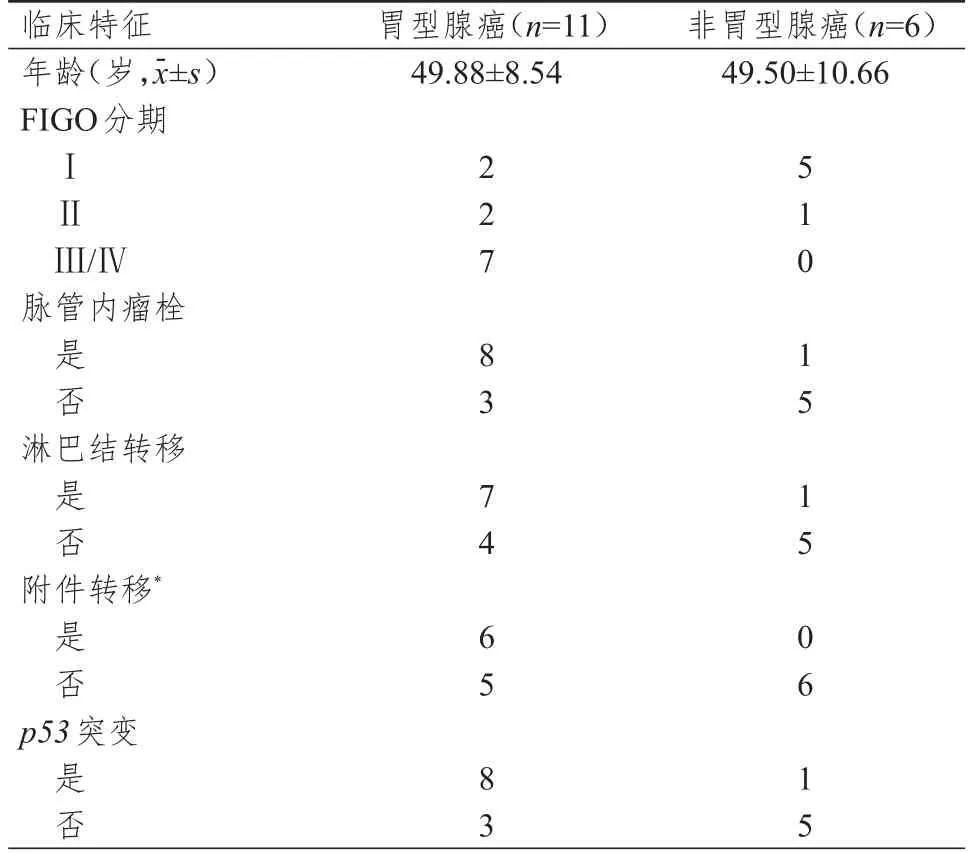
表1 胃型腺癌与非胃型腺癌患者的临床特征
2.3 免疫表型
17 例NHPVA 患者免疫表型p16 均为阴性或者弱阳性,CK7 与CEA 均为阳性,CDX2、ER 及PR 均为阴性,p53有9 例突变。11 例胃型腺癌患者MUC6 均为阳性,中肾管型腺癌患者GATA3 为阳性。(图1)
3 讨论
由于人乳头瘤病毒(human papilloma virus,HPV)疫苗的广泛接种以及HPV 初筛技术的推广,很多HPV 相关性宫颈癌早期病变被发现并处理,导致其病死率逐渐降低。然而约15%的宫颈腺癌的发生与HPV 感染无关(非HPV 相关性)[9-10],NHPVA隐匿性较强,病理类型少见,往往在晚期被发现,这值得临床工作者的重视和研究。
NHPVA相比HPVA更具有危险性,表现为更严重的侵袭性、更高的FIGO分期以及更差的预后[11-12]。胃型宫颈腺癌是相对多见的一种NHPVA[13]。NHPVA疾病进展快,本组17 例患者中有7 例发现时已经是晚期,各组织分型中,胃型腺癌较其他分型更为多见(11/17)。从形态学看,透明细胞型、中肾管型等其他类型的NHPVA 具有典型的肿瘤细胞学特征,不容易漏诊。而胃型腺癌镜下表现具有较强“欺骗性”,从分化良好的腺体到分化差的腺体均可出现,以前常见的微偏腺癌就是形态分化最好的胃型腺癌,腺体常缺乏复杂性结构而由单个呈“爪状”形态的腺体随意分布在间质中,由高柱状上皮组成,细胞质丰富,细胞边界清楚,腺体伴或不伴轻度核异型,局灶性间质促纤维反应。细胞学筛查常常不能明确诊断为恶性肿瘤,或被忽略。总之宫颈胃型腺癌在活检标本中容易漏诊,由于活检组织小而浅表,难以到达异常腺体分布的深度,如果是高分化肿瘤,常常仅有轻度异型腺体,更容易漏诊。平时工作中经常借助免疫组织化学法来帮助诊断,常用的免疫组织化学指标有p16、p53、CK7、CK20、CEA、MUC6、ER、PR、Ki-67等。NHPVA 患者ER、PR、CK20 一般为阴性表达,CK7、MUC6、CEA 多呈阳性表达,Ki-67 高增殖指数。p16 免疫染色通常是阴性或局灶阳性,而非弥漫性。p53突变各有不同,在胃型腺癌中高达41%的患者发生p53突变[14]。本组病例中,胃型腺癌患者p53突变率较高(8/11),比非胃型腺癌患者(1/6)的突变率高。中肾管型腺癌患者GATA3常呈阳性,透明细胞型腺癌患者肝细胞核因子1β(hepatocyte nuclear factor 1β,HNF1β)和Napsin A阳性有助于诊断。需要注意的是,HNF1β和Napsin A 在胃型腺癌与透明细胞型腺癌中均可呈阳性。有文献报道,三叶因子2(trefoil factor 2,TFF2)和HIK1083 双阳性对宫颈胃型腺癌具有高度特异性[15-16]。
目前NHPVA 的发病机制尚不清楚,有研究发现非HPV 相关性宫颈癌发生Kirsten 鼠肉瘤病毒癌基因同源物(Kirsten rat sarcoma viral oncogene homolog,KRAS)、富AT 交互域1A(AT-rich interaction domain 1A,ARID1A)及磷酸酶张力蛋白同源物(phosphatase and tensin homolog,PTEN)基因突变的频率明显增高,而核因子κB(nuclear factor-κB,NF-κB)、促分裂原活化的蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路活性降低[9]。另有研究发现,黑色素瘤特异性抗原(preferentially expressed antigen of melanoma,PRAME)、人高迁移率族AT hook 蛋白2(high mobility group AT-hook 2,HMGA2)、ETS 变异转录因子4(ETS variant transcription factor 4,ETV4)、mex-3 RNA 结合家族成员A(mex- 3 RNA binding family member A,MEX3A)、跨膜7 超家族成员2(transmembrane 7 superfamily member 2,TM7SF2)、溶质载体家族成员19(solute carrier family 19 member,SLC19A)及tweety 家族成员3(tweety family member 3,TTYH3)7 个基因在HPV 阴性宫颈癌细胞系及组织中表达明显增高,而且MEX3A和TTYH3基因表达越高,预后越差[9,17]。从表1 可以看出,胃型腺癌似乎比其他类型NHPVA 更加具有侵袭性,尤其是FIGO分期及附件转移的表现。当然由于病例数量较少,需要长期跟踪研究,从而得出更加准确的数据。胃型腺癌作为新分类的一种,可能表现出与其他类型NHPVA 不同的病理特征与临床特征,这是需要引起足够重视的,同时研究并早期发现其前驱病变,将具有重要意义。
治疗方面,对于NHPVA 目前还没有明确的靶向治疗药物。本组病例治疗均采用根治手术联合紫杉醇+卡铂(TC)方案化疗。Ruiz 等[18]研究发现,在HPV 阴性宫颈癌中,肿瘤蛋白p53(tumor protein p53,TP53)、ARID1A、PTEN、富AT 交互域5B(ATrich interaction domain 5B,ARID5B)、连环蛋白β1(catenin beta 1,CTNNB1)、CCCTC 结合因子(CCCTC-binding factor,CTCF)以及细胞周期蛋白D1(cyclin D1,CCND1)为显着突变基因,作用于细胞周期进程。而且与HPV 阳性宫颈癌患者相比,HPV 阴性患者无瘤生存期及总生存期更短,并提出帕博西尼可能是HPV 阴性宫颈癌的有效免疫治疗策略。
总之,NHPVA 侵袭能力强,常常晚期发现。针对NHPVA,不管是在分子遗传特征、病理诊断,还是临床治疗方面都需要持续重视与研究,特别是具有高度侵袭性的胃型腺癌。了解它们的分子特征对于早期筛查或者诊断、研发新型靶向治疗具有重要意义。胃型腺癌表现出不同于其他类型NHPVA 的高侵袭性与临床分期,需要引起足够重视。部分NHPVA 目前还没有定义明确的癌前病变,认识前驱病变将有助于早期发现、早期处理。



