魏元东,彭伟,王森,宗恒,张艳,汤雷
安徽省第二人民医院1肿瘤内科,2介入放射科,合肥 230041
肺癌是全球肿瘤相关死亡的主要原因,发病率和病死率逐年增加,居恶性肿瘤首位[1]。肺癌主要分为小细胞肺癌和非小细胞肺癌,多数肺癌患者确诊时已进展至中晚期,部分患者甚至已经发生转移,错过了手术治疗的时机[2]。目前,临床晚期肺癌的常见治疗方式是化疗、放疗及免疫治疗,化疗对大部分肺癌患者效果明显,但可导致严重的不良反应,5 年生存率﹤15%[3]。放疗主要分为普通放疗、三维适形放疗和调强放疗三种形式,对大部分肺癌有效,但除肺癌组织外,正常肺组织也会受到放射源的影响[4],即便是调强放疗也可能影响正常肺组织的功能,在晚期肺癌的治疗中有一定的局限性。肿瘤免疫治疗包括免疫检查点抑制剂、嵌合抗原受体T 细胞和双特异性抗体,已显示出了明显的肿瘤治疗潜力[5]。免疫治疗通过调控T细胞的功能,对肿瘤细胞发挥杀伤作用[6-8]。
近年来,粒子植入作为一种新的肿瘤治疗方式,效果显着。125I 粒子由于半衰期短,不良反应小等特点,在临床中的应用效果较好[9-11]。免疫系统在肺癌的治疗中发挥重要作用,但仍有较多的肺癌患者不能从免疫治疗中获益,因此,需要研究新的疗法治疗肺癌。目前关于放射性125I 粒子植入联合卡瑞利珠单抗治疗中晚期肺癌的相关报道较少,且目前已有结果仍存在异议,因此本研究探讨放射性125I 粒子植入联合卡瑞利珠单抗治疗晚期肺癌的疗效,现报道如下。
1 对象与方法
1.1 研究对象
选取2020 年1 月至2022 年1 月安徽省第二人民医院收治的50 例局部晚期肺癌患者。纳入标准:①经细胞学或组织学检查确诊为局部晚期肺癌;②TNM 分期为Ⅲ~Ⅳ期,无法行手术治疗;③经表皮生长因子受体(epidermal growth factor receptor,EGFR)、间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)基因检测证实均为突变阴性;④既往接受过1 次系统化疗后进展;⑤不存在放射性125I 治疗的禁忌证;⑥既往无明显肝肾功能异常及相关药物禁忌证;⑦预计生存期﹥3 个月;⑧至少有1 个可测量的病灶(螺旋CT 扫描长径≥10 mm,经实体瘤疗效评价标准1.1 版评估临床疗效);⑨美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)体力状况(performance status,PS)评分为0~2 分。排除标准:①合并严重的心脑血管疾病;②无法耐受手术及胸腔内放疗;③治疗依从性差;④合并严重的感染性疾病;⑤既往化疗和/或放疗相关的临床治疗相关毒性持续存在;⑥合并不受控制的高血压[药物治疗后收缩压≥140 mmHg(1 mmHg=0.133 kPa)和/或舒张压≥90 mmHg];⑦妊娠期或哺乳期女性;⑧对本研究所用药物过敏;⑨合并其他恶性肿瘤;⑩合并其他可能影响临床研究结果的因素。采用区组随机法将50 例局部晚期肺癌患者分为对照组和研究组,每组25 例,对照组患者给予放射性125I 粒子植入治疗,研究组患者给予卡瑞利珠单抗联合放射性125I粒子植入治疗。对照组中,男10 例,女15 例;年龄24~81 岁,中位年龄61 岁;吸烟史4 例,无吸烟史21例;临床分期:Ⅲ期11 例,Ⅳ期14 例。研究组中,男17 例,女8 例;年龄30~81 岁,中位年龄62 岁;吸烟史4 例,无吸烟史21 例;临床分期:Ⅲ期14 例,Ⅳ期11 例。两组患者性别、年龄、吸烟史、临床分期比较,差异均无统计学意义(P﹥0.05),具有可比性。本研究经医院伦理委员会批准通过,所有患者均知情同意并签署知情同意书。
1.2 治疗方法
对照组患者给予放射性125I 粒子植入治疗:首先通过胸部CT 扫描和三维重建的影像学结果评估肿瘤病灶直径,在TPS 系统导入资料,据此勾画临床靶区,处方剂量为110 Gy,并计算每个穿刺部位需要的125I 粒子植入数目。手术前,采用CT 检查扫描肺癌患者胸部,患者取仰卧或俯卧位,常规消毒后进行局部浸润麻醉,评估患者肺癌病灶与胸膜距离。从标记穿刺点处进针,到达肺癌病灶远端边缘后边退针边植入放射性125I 粒子,粒子释放间隔一般为0.5~1.0 cm,待粒子植入完毕后,再次复查胸部CT 检查患者有无气胸、出血等并发症以及是否发生粒子脱落和移位等情况。
研究组患者给予卡瑞利珠单抗联合放射性125I粒子植入治疗,放射性125I 粒子植入治疗方法同对照组。放射性125I 粒子植入后7 天,静脉滴注卡瑞利珠单抗,推荐剂量为200 mg,每3 周给药1 次,连续给药直至患者疾病进展或出现不可耐受的不良反应。
1.3 观察指标
①主要观察终点:比较两组患者治疗前后的肿瘤直径;并采用电话或医院电子化病历系统对两组患者进行为期1 年的随访,比较两组患者的无进展生存期。②次要观察终点:不良事件、客观缓解率(objective response rate,ORR)、疾病控制率(disease control rate,DCR)。依据实体瘤疗效评价标准1.1 版评估两组患者的临床疗效,分为完全缓解、部分缓解、疾病稳定、疾病进展,ORR=(完全缓解+部分缓解)例数/总例数×100%,DCR=(完全缓解+部分缓解+疾病稳定)例数/总例数×100%。不良事件:乏力、白细胞减少、肝肾功能损害、免疫相关肺炎、中性粒细胞减少、皮疹、免疫性心肌损害。
1.4 统计学方法
采用SPSS 25.0 和Graphpad Prism 8.4.0 软件对所有数据进行统计分析,计数资料以例数和率(%)表示,组间比较采用χ2检验。正态分布的计量资料以均数±标准差(±s)表示,组间比较采用两独立样本t检验;非正态分布的计量资料以中位数(四分位数间距)[M(P25,P75)]表示,组间比较采用Mann-WhitneyU检验。采用Kaplan-Meier 法绘制生存曲线,组间比较采用Log-rank 检验。以P﹤0.05 为差异有统计学意义。
2 结果
2.1 临床疗效的比较
研究组患者的ORR 为80.00%(20/25),与对照组患者的88.00%(22/25)比较,差异无统计学意义(P﹥0.05);研究组患者的DCR 为96%(24/25),与对照组患者的100%(25/25)比较,差异无统计学意义(P﹥0.05)。(表1)
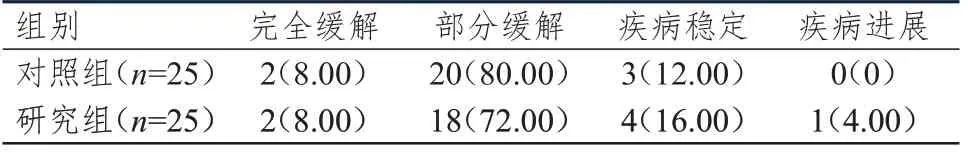
表1 两组患者的临床疗效[n(%)]
2.2 不良事件发生情况的比较
接受125I 粒子植入治疗的25 例对照组患者,均未发生不良事件。接受免疫治疗联合125I 粒子植入治疗的25 例研究组患者中,任意级别免疫相关不良事件(immune-related adverse event,irAE)的发生率为88.00%(22/25),其中1~2 级irAE 发生率为84.00%(21/25),3~5 级irAE 发生率为4.00%(1/25),所有级别最常见irAE 为乏力,发生率为44.00%(11/25)。(表2)

表2 研究组患者任意级别irAE发生情况(n=25)
2.3 无进展生存期的比较
截至随访结束,对照组患者的中位无进展生存期为3.00 个月(95%CI:2.543~3.457),明显短于研究组患者的8.00 个月(95%CI:5.552~10.448),差异有统计学意义(χ2=39.438,P=0.000)。(图1)

图1 研究组(n=25)和对照组(n=25)晚期肺癌患者的无进展生存曲线
2.4 肿瘤直径的比较
治疗前,两组患者的肿瘤直径比较,差异无统计学意义(P﹥0.05);治疗后,研究组患者的肿瘤直径小于本组治疗前和对照组,差异均有统计学意义(P﹤0.05)(表3)。治疗前,两组患者的肿瘤直径分布情况比较,差异无统计学意义(P﹥0.05);治疗后,研究组患者的肿瘤直径分布情况优于对照组,差异有统计学意义(P﹤0.05)(表4)。

表3 治疗前后两组患者肺部肿瘤直径的比较[cm,M(P25,P75)]

表4 治疗前后两组患者的肿瘤直径分布情况[n(%)]
3 讨论
肺癌是一种恶性程度较高的肿瘤,确诊时多已进展至中晚期,患者多已失去了手术治疗的机会,因此,多种治疗方法联合应用逐渐成为晚期肺癌治疗的新思路。放疗是晚期肺癌的主要治疗方法,与其他治疗方法联合应用已经显示出非常好的治疗效果。研究发现,放射性125I 粒子可以与全身化疗联合应用,提高晚期肺癌患者的近远期疗效,改善生活质量,且不会增加不良反应[12]。另一项研究表明,热疗联合放射性125I 粒子植入是晚期肺癌一种有效的姑息性治疗手段,与放射性125I 粒子植入治疗相比,联合治疗的不良反应无明显差异,但治疗效果明显增强,且联合治疗的不良反应更少[13]。此外,化疗联合放射性125I 粒子植入治疗晚期肺癌的效果确切,可显着延缓肺癌患者的疾病进展,晚期肺癌患者给予化疗联合放射性125I 粒子植入治疗不仅不会明显增加不良反应,还会提高化疗效果,安全性较高[14-15]。放射性125I 粒子植入治疗作为内放射治疗,可激活患者的免疫反应,提高免疫功能。
免疫治疗是指通过增强机体的抵抗力、刺激机体免疫反应抑制肿瘤细胞增殖的一种治疗方法[16]。近年来,靶向程序性死亡受体1(programmed cell death 1,PDCD1,也称PD-1)/程序性死亡受体配体1(programmed cell death 1 ligand 1,PDCD1LG1,也称PD-L1)成为晚期肺癌患者的主要治疗方案,可显着延长患者的无进展生存期和总生存期,提高患者的生存率[17-18]。目前派姆单抗和纳武利尤单抗在晚期肺癌治疗中已取得了突破性进展,有研究显示,派姆单抗治疗非小细胞肺癌患者的中位无进展生存期长于铂类化疗药物(10.30 个月vs6.00 个月)[19]。表明免疫治疗可为晚期肺癌患者带来明显的生存获益,可明显延长患者的总生存期,但免疫治疗的临床应用仍存在诸多不足,如总有效率不高、原发性和继发性耐药等问题[20-21]。
本研究评估免疫治疗联合放射性125I 粒子植入治疗晚期肺癌的效果,结果发现,两组患者ORR、DCR 比较,差异均无统计学意义(P﹥0.05);治疗后,对照组患者的中位无进展生存期为3.00 个月(95%CI:2.543~3.457),明显短于研究组患者的8.00 个月(95%CI:5.552~10.448),差异有统计学意义(P﹤0.01);此外,治疗后,研究组患者的肿瘤直径小于本组治疗前和对照组,差异均有统计学意义(P﹤0.05)。表明免疫治疗联合放射性125I 粒子植入治疗晚期肺癌有效,联合治疗可以显着抑制肿瘤细胞增殖,减少肿瘤病灶。
综上所述,卡瑞利珠单抗联合放射性125I 粒子植入治疗,可以延长晚期肺癌患者的中位无进展生存期,减小肿瘤直径。



