张雅男,王晓亮,张梦瑶,董其娟,王敏,张俊杰
[1.河南中医药大学第五临床医学院(郑州人民医院) a.心血管内科;b.内分泌科;c.普通外科,河南 郑州 450000;2.上海市浦东医院/复旦大学附属浦东医院 普通外科,上海 200000]
据《中国心血管健康与疾病报告2021》数据显示,中国心血管疾病患病数高达3.3亿,其中慢性心力衰竭(chronic heart failure,CHF)患者约占26%,预计未来20 a还会增加25%[1]。CHF自然病程内心室负荷不断增加,并且心脏代偿性扩大,导致心室形状结构及功能均发生改变,从而形成心肌重构[2]。心肌重构是CHF不可逆的病理表现,会直接导致心肌收缩能力下降,射血能力不足,影响心脏及全身器官血流灌注[3]。有研究发现,CHF患者心脏处于高负荷状态,通常出现神经-内分泌紊乱现象,从而引起激素分泌异常[4]。甲状旁腺激素(parathyroid hormone,PTH)是由甲状旁腺主细胞分泌的一种激素,其主要作用为调节机体钙磷代谢,是内分泌激素在心血管系统中的重要靶点[5]。另外,PTH与心功能的关系十分明确,不仅扮演心血管疾病的危险因素,并且与患者预后高度相关[6],但与CHF患者心肌重构的关系尚无定论。基于上述背景,本研究希望证实血清PTH与CHF患者心肌重构的关系,探讨心肌重构的预防靶点。
1 对象与方法
1.1 研究对象
入选2021年3月至2023年2月收治入院的120例CHF患者作为研究对象,研究方案由医院医学伦理委员会批准(批件号:KY2021~022号)。纳入标准:(1)CHF符合《慢性心力衰竭基层诊疗指南(2019年)》[7]中诊断标准;(2)年龄60岁以上;(3)纽约心脏病协会(New York Heart Association,NYHA)分级Ⅱ~Ⅳ级;(4)知晓研究内容,签署知情同意书。排除标准:(1)其他器官功能衰竭;(2)接受心脏再同步化治疗,或心脏移植;(3)近6个月内急性发作;(4)正在服用任何影响内分泌功能的药物;(5)原发性心肌病导致的CHF;(6)先天性心脏结构异常;(7)接受过心脏外科手术;(8)影响内分泌的恶性肿瘤;(9)任何影响PTH代谢的原发性肾病。
1.2 调查方法
1.2.1心肌重构
入院当日即为患者进行超声心动图检查,采用迈瑞DC-35Pro彩色多普勒超声,探头频率2.5~45 MHz,患者取左侧卧位,探头放置在胸部心尖位置,以单平面Simpson法测量左室射血分数(left ventricular ejection fraction,LVEF),以胸骨旁左心室长轴M型超声测量左心室舒张末期内径(left ventricular end diastolic dimension,LVEDD)、左心室收缩末期内径(left ventricular end-systolic dimension,LVESD)、室间隔厚度(interventricular septal thickness,IVS)、左心室后壁厚度(left ventricular posterior wall,LVPW)。根据Devervux校正公式计算左心室质量(left ventricular mass,LVM)及左心室质量指数(left ventricular mass index,LVMI)。心肌重构参考《慢性心力衰竭基层诊疗指南(2019年)》[7]中心脏结构异常的判定标准。
1.2.2检查项目
常规采集患者空腹外周血3 mL,采用低速脱帽离心机(南京贝登医疗,L530),以3 000 r·min-1转速离心10 min分离血清和血浆,采用免疫荧光法检测血清PTH,采用酶联免疫吸附试验检测血清心肌肌钙蛋白(cardiac troponin,cTnⅠ),采用双抗体夹心法检测血浆氨基末端脑钠肽前体(N-temrina pro-barin natriuretic peptide,NT-proBNP)。
1.3 资料收集
根据研究目的,收集患者一般临床资料,包括年龄、性别、体重指数(body mass index,BMI)、CHF病程、基础病、NYHA分级、LVEF、LVEDD、LVESD、血清PTH、cTnⅠ、血浆NT-proBNP。
1.4 统计学方法

2 结果
2.1 血清PTH与超声检查结果
本研究共入选CHF患者120例,血清PTH检测结果为27.69~54.21 pmol·L-1,平均(38.25±5.66)pmol·L-1,其中37例患者经计算LVMI评估为心肌重构,心肌重构率为30.83%。
2.2 CHF患者基线资料
CHF合并心肌重构患者NYHA Ⅲ级、Ⅳ级占比高于未重构患者,血清PTH、血浆NT-proBNP高于未重构患者,LVEF低于未重构患者(P<0.05)。见表1。
2.3 血清PTH对CHF患者心肌重构的影响
以CHF患者心肌重构作为因变量,NYHA分级(Ⅱ级=1,Ⅲ级=2,Ⅳ级=3)、LVEF、PTH、NT-proBNP作为自变量,采用logistic回归,NYHA Ⅲ级、Ⅳ级、LVEF降低、血清PTH表达上调可导致CHF患者心肌重构风险增加(P<0.05)。见表2。
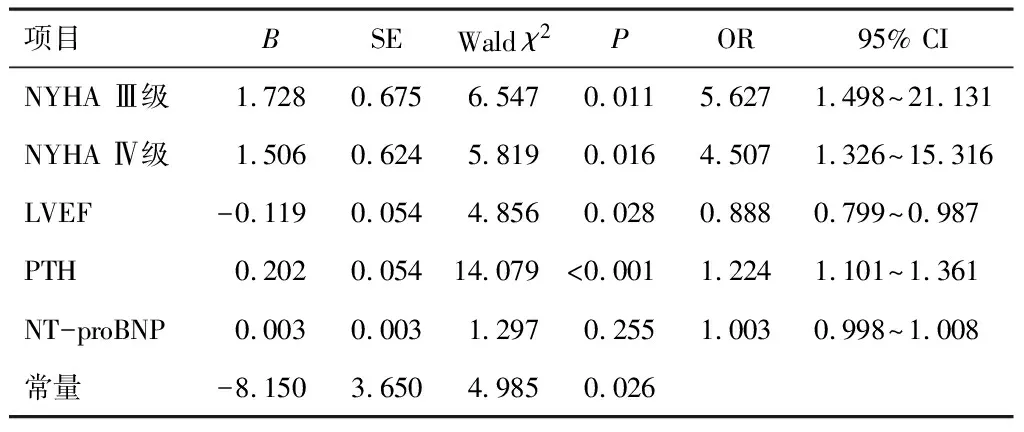
表2 血清PTH对CHF患者心肌重构的影响
2.4 血清PTH评估CHF患者心肌重构的ROC曲线
以CHF患者心肌重构作为状态变量,血清PTH作为检验变量,绘制ROC曲线,血清PTH评估CHF患者心肌重构的曲线下面积为0.797,95% CI:0.705~0.889,P<0.05。当血清PTH表达≥36.875 pmol·L-1时,可以考虑CHF患者发生心肌重构,敏感度和特异度分别为83.8%、60.2%,约登指数为0.440。
3 讨论
心肌重构是心肌细胞对心功能损害的一种适应性反应,最初用于心肌梗死后发生的重塑,目前被广泛用于评估CHF心肌功能异常及结构重新排列的变化[8]。本研究数据显示,120例CHF患者中心肌重构率超过30%,并且这些患者普遍为NYHA Ⅲ级、Ⅳ级,说明随着CHF病情进展,患者心脏结构不断改变,心肌重构风险增加。有研究显示,心肌重构不仅仅是心脏结构的改变,还会导致心脏电生理重构,增加恶性心律失常风险,是CHF患者猝死的主要原因[9]。因此,心肌重构的预防成为CHF患者的重要治疗目标。
文献指出,CHF发病过程中肾素-血管紧张素-醛固酮系统被慢性激活,引起血管收缩、神经内分泌过度激活,从而导致心肌细胞代谢紊乱,心脏结构改变[10]。因此,CHF的治疗从心肾模式转变为以阻断内分泌为主。PTH是机体内重要的内分泌激素,以往常用于评估内分泌疾病、代谢性疾病。近年来越来越多研究发现,PTH是心血管-内分泌系统的桥梁因子,其表达上调与心血管疾病发生有关,对心血管系统的影响受到广泛重视,如PTH能够影响钙磷代谢,导致心血管钙化[11],PTH能够导致心肌细胞代谢紊乱,增加心肌损害风险[12]。本研究中,血清PTH在CHF表达合并心肌重构患者中显着上调,进一步分析提示,血清PTH表达上调导致CHF患者心肌重构风险增加,说明血清PTH表达上调与CHF患者心肌重构有关。
研究指出,PTH与心肌损害的关系是通过调节钙磷代谢实现的,PTH与心肌细胞上的PTH受体结合能够激活磷脂酶C和蛋白激酶C途径,疏通钙通道,大量的钙离子内流导致心肌细胞钙离子超载,从而引起心室负荷加重,心肌结构则代偿性改变[13]。黄楠等[14]研究中,慢性肾衰竭患者血清PTH表达上调导致钙磷代谢紊乱,且患者心脏结构均发生不同程度改变,该研究认为PTH表达上调导致LVEF下降,心脏射血不能满足机体循环需求,从而引起心脏结构代偿性改变。本研究中,CHF合并心肌重构患者LVEF也显着降低,且LVEF降低导致心肌重构风险增加。有理由认为,PTH表达上调导致的心肌损伤使LVEF降低,间接导致心肌重构发生。另有研究指出,PTH导致钙离子超载会增加线粒体对血钙的摄取,线粒体内形成磷酸钙沉积,导致线粒体功能损害,诱发氧化应激反应[15]。众所周知,氧化应激是细胞凋亡的重要病理机制。可以认为,CHF患者血清PTH表达上调能够激活氧化应激导致心肌细胞凋亡,从而导致心肌重构发生。另外,本研究结果显示,CHF患者血清PTH表达≥36.875 pmol·L-1时,即考虑患者发生心肌重构,且研究数据提示,血清PTH能够评估CHF患者心肌重构风险,将来可以作为心肌重构的预防靶点。
4 小结
血清PTH在CHF合并心肌重构患者中表达上调,血清PTH表达上调时导致CHF心肌重构风险增加,当血清PTH表达36.875 pmol·L-1时,即考虑患者发生心肌重构。本研究证实血清PTH在CHF合并心肌重构中的临床意义,对于CHF患者心肌重构的预防提供相关线索。但不同类型CHF的LVEF也存在显着差异,而本研究尚未对CHF患者进行具体分型,所以未能明确血清PTH是否与不同CHF亚型患者心肌重构有关,此为本研究的局限。今后将继续开展前瞻性研究,具体分析血清PTH与不同CHF类型患者心肌重构的关系。



