刘 玉,王超群,曾江正,高炳玉,高方方,王 煜,陈 彬
(1. 海南医学院第一附属医院,海南 海口570102;2. 海南医学院附属海南医院,海南 海口570102;3. 安徽省太和县人民医院,安徽 太和236631)
目前乳腺癌是女性患者中最常见的一种恶性肿瘤,尽管现在五年的总生存率已经达到80%,但死亡率仍然在女性疾病中位居前列。它有不同的分子类型,其中三阴性乳腺癌(triple negative breast cancer,TNBC)具有很高的异质性,对化学治疗敏感,具有易侵袭、转移的特点。其病理机制尚不清楚,因此,探明TNBC 侵袭转移的分子机制,寻找TNBC 的发病、转移和靶向精确治疗方法是目前亟待解决的难题。肿瘤相关巨噬细胞(tumor-associated macrophages,TAMs)属于细胞间质成分,浸润在各种实体肿瘤中。在TNBC 中,TAMs 的浸润程度最高可达其肿瘤成分的50%以上[1,2]。近年来研究发现,TAMs 浸润程度与肿瘤浸润转移呈正相关,是TNBC 的独立预后因素之一[3]。
外泌体在生物学中有严格的定义:直径为30~150 nm,通过多囊泡的内皮途径形成,结构为脂质双分子层,通过转导入其他细胞发挥相应的生物学作用,亦可被释放入循环系统或者进入细胞外环境发挥其生物学功能,包裹非编码RNA、脂类和蛋白质等功能分子,从而改变受体细胞的生理和病理功能[4]。不同种类的细胞如肿瘤细胞、免疫细胞及干细胞等均可释放外泌体,外泌体在肿瘤细胞中含量较高,外泌体的大量分泌易改变肿瘤的微环境,具有促进肿瘤生长及侵袭、转移的功能[5,6]。
近几年来,外泌体对恶性肿瘤的影响和在化学治疗中的作用越来受到人们关注。本研究从TNBC 肿瘤相关巨噬细胞系培养上清液中提取外泌体,并通过透射电镜、粒径分析等科学手段对外泌体进行鉴定,为TNBC 进行分子诊断和靶向精准治疗研究提供理论基础,并为TNBC 发病、侵袭、转移机制和分子靶向精准治疗等临床研究提供了新的切入点。
1 材料与方法
1.1 试剂及设备
THP-1 细 胞、TNBC MDA-MB-231 细 胞 均 由海南医学院中心实验室自行培养提供,外泌体抽提试剂盒购自SBI,PBS、BCA 试剂盒及DMEM 购自上海吉凯基因生物有限公司,胰酶购自胰酶GIBCO,实验中所使用的基础培养基、结晶紫水溶液(0.5%)规格为100 mL 及4%多聚甲醛均购自海南博士德生物技术有限公司,姬姆萨染色液(Giemsa)购自上海榕柏生物技术有限公司,Transwell 试剂盒及PKH26 购自Sigma 公司。
生物安全柜购自力康国际贸易(上海)有限公司,Celigo 多功能细胞成像分析仪(供应商:Nexcelom Bioscience)、荧光显微镜购自奥林巴斯(美国)有限公司、离心机(生产商:Thermo Fisher Scientific)、倒置显微镜(上海玉研科学仪器有限公司)、96 Wounding Replicator(VP scientific)、实验中使用的一次性注射器(江苏正康医疗器械有限公司)、0.22 μm 滤器(Millipore)、CO2培养箱(SANYO)。
1.2 细胞诱导
将THP-1 细胞培育至对数生长期,收集1×107个THP-1 细 胞 铺 入10 cm 培 养 皿 中,75 ng/mL 的pma 加入培养基中,培养24 h。更换新的完全培养基,培养48 h,完全培养基内加入含20 ng/μL IL-13、IL-4,培养72 h,收集培养基。
1.3 提取外泌体
将收集的培养基用0.22 μm 的滤器过滤,用超速离心机100 000 r/min、4 ℃离心75 min。去除培养基,等量预冷的PBS 重悬外泌体加入,100 000 r/min,4 ℃离心75 min。除去PBS,新的预冷的PBS重悬外泌体,放入1.5 mL 离心管中,-80 ℃保存。
1.4 流式鉴定
收集THP-1 与M2 细胞,用血球计数板对细胞进行计数,每个流式样本为1×106个细胞。用200 μL 含3% BSA 的PBS 重悬细胞,封闭30 min,将抗体按1∶300 的比例进行稀释,样本2 000 rpm 离心1 min,去除封闭液,加入一抗,室温孵自1 h。2 000 r/min 离 心1 min,去 除 一 抗,用 含0.1% Tween20 的PBS 洗3 次,1∶800 稀释荧光二抗,室温避光孵自30 min。2 000 r/min 离心1 min,去除二抗,用含0.1%Tween20 的PBS 洗3 次,200 μL PBS 重 悬 细 胞,进行流式检测。
1.5 WB 鉴定外泌体
冰上裂解外泌体20 min,加入5×SDS上样缓冲液、煮沸10 min,-20 ℃的冰箱中存放,SDS-PAGE电泳,120 V、90 min,湿转120 V稳压、100 min湿转膜法将蛋白转移至PVDF 膜,5%脱脂牛奶室温封闭30 min,一抗4 ℃孵育过夜,PBS洗膜3次,每次10 min,加入试剂盒中发光剂,孵育1 min。曝光显色,定影,扫描实验结果。
1.6 外泌体内吞实验
按2 000 个细胞/孔的密度接种MDA-MB-231细胞于96 孔板,细胞贴壁后将收集的细胞上清样品用外泌体试剂盒抽提外泌体(详见外泌体抽提实验方法),离心后得到外泌体沉淀用100 μL PBS 重悬;2 μmol/L 的PKH26 工作液中加入外泌体悬液400 μg/mL,室温孵育5 min,将染色孵育后的外泌体用0.22 μm 滤器滤去多余的染液,按20 μL/well 加入到待观察的细胞中,在0、3、6 h 时进行拍照观察带有红色荧光标记的外泌体进入细胞的过程。
1.7 Transwell 小室实验检测MDA-MB-231 细胞迁移侵袭能力
MDA-MB-231 为目的细胞,对照组为正常培养基培养的细胞,400 μg/mL 外泌体(药物处理后的外泌体)与正常目的细胞共培养,处理48 h 后的细胞组为实验组。将来源于肿瘤巨噬细胞外泌体的小室与MDA-MB-231 细胞置于24 孔板中,上室中加入100 μL 无血清培养基,37 ℃的培养箱中放置1 h。除去培养基加入细胞悬液100 μL。30% FBS 溶液的培养基(规格:600 μL)加入下室内。37 ℃培养箱培养16 h;取出小室、倒扣在吸水纸上,除去小室内非转移细胞,移去培养基,将小室置于4%多聚甲醛固定液中固定30 min。吸水纸吸干小室表面固定液,用1~2 滴的染色液对转移细胞进行染色。浸泡冲洗小室数次,在空气中自然晾干。MDA-MB-231细胞与肿瘤巨噬细胞来源的外泌体共培养后,高倍镜下(×200)观察:每个Transwell 小室,随机选取视野,拍照9 张,完全独立实验重复3 次后统计处理结果。
1.8 划痕愈合实验检测MDA-MB-231细胞迁移能力
胰酶消化处于对数生长期的MDA-MB-231 细胞后,将完全培养基重悬成细胞悬液,将1×105个细胞接种于96 孔板中过夜,第二天采用常规的划痕模式:向上端中心部位轻推对准,划痕仪进行划痕。PBS 溶液漂洗2~3 次,加入含1% FBS 血清培养基,0 h 扫板,37 ℃、5% CO2培养箱培养,根据愈合程度选择划痕后0、8、24 h 用Celigo 扫板,共采集3个时间点,用Celigo 分析迁移面积和佳能EOS 相机拍摄照片。
1.9 统计学处理
2 结果
2.1 外泌体内吞实验
通过染色标记的外泌体孵育肿瘤细胞,检测其潜在的内吞情况。本实验中笔者将MDA-MB-231作为目的细胞,与提取来源于肿瘤巨噬细胞的外泌体进行共孵育后,结果表明:外泌体可以通过被摄入的方式内吞进入细胞内。D、E、F 分别为0、3、6 h时观察外泌体内吞进入细胞内的情况,3 h 外泌体进入胞浆,6 h 富集明显,见图1。
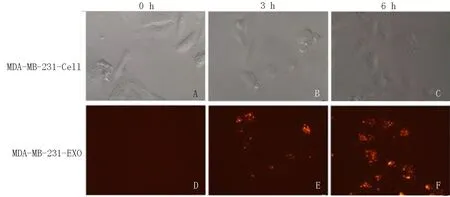
图1 外泌体内吞试验Fig 1 Endocytosis assay of exosomes
2.2 Transwell 小室检测细胞迁移能力
MDA-MB-231 细胞与外泌体共培养后,Transwell 小室试验结果表明,实验组转移细胞数(241.00±3.35)显着多于对照组(144.00±2.33)(P<0.001),差异具有统计学意义。
转移细胞数相比正常细胞数的变化值:实验组(1.67±0.02)与对照组(1.00±0.02)相比,差异具有统计学意义(P<0.001)。见表1。
表1 TAMs外泌体对MDA-MB-231细胞迁移能力的影响(±s)Tab 1 Effects of TAM-derived exosomes on migration of MDA-MB-231 cells(±s)

表1 TAMs外泌体对MDA-MB-231细胞迁移能力的影响(±s)Tab 1 Effects of TAM-derived exosomes on migration of MDA-MB-231 cells(±s)
组别实验组对照组t P转移细胞数241.00±3.35 144.00±2.33 71.3128<0.001转移细胞数变化值1.67±0.02 1.00±0.02 71.0642<0.001
2.3 细胞划痕实验
TAMs 外泌体处理后的MDA-MB-231 细胞比对照组的迁移距离明显增加,实验组A、B、C 于0、8、24 h 时记录划痕的愈合情况,对照组D、E、F 于0、8、24 h 时记录划痕的愈合情况。按%计数细胞迁移率,实验组24 h 划痕迁移率为(39.86±3.47)%;对照组为(24.48±2.97)%,结果表明,随着时间的推移,实验组24 h 划痕迁移率显着增加,差异具有统计学意义(P<0.05)。肿瘤巨噬细胞来源的外泌体对乳腺癌MDA-MB-231 细胞的迁移能力具有促进作用。
3 讨论
TNBC 占所有乳腺癌亚型的10%~20%。易发生内脏转移,尤其是肝、脑和肺等内脏的转移,复发率高,无明确靶点,只能依靠化疗治疗效果差,对传统的内分泌治疗和抗HER2 靶向治疗不敏感,亟需进一步分型施策,寻找其他靶向治疗方法[7]。优化其治疗效果、改善预后、降低术后复发转移是目前临床研究的焦点、难点。
外泌体是一种纳米级(40~160 nm),可进行信息传递的囊泡样小体,于1967 年首先被提出来。临床研究中使用的来源十分广泛,常见的有血清来源外泌体、肿瘤来源外泌体、干细胞来源外泌体。外泌体具有很强的异质性,不同大小、不同来源及不同内容物的外泌体,其发挥的功能千差万别。通过细胞内吞作用进入细胞内,可广泛地参与到病理、生理等一系列的进程,在细胞通讯中起着非常重要的作用。由于其所含代谢物的含量是由其亲代细胞决定的,不同来源的外泌体能够反映原始细胞的生理功能和状态,可选择性地携带特异性蛋白。成纤维细胞是和肿瘤环境非常相关的一类细胞,这类细胞分泌的外泌体被癌细胞吞噬会抑制线粒体的氧化磷酸化。外泌体以类似“大胞引作用”的机制向癌细胞供能,重新编程代谢机制。不同肿瘤具有不同的表达谱,对特异性蛋白miRNA 研究显示,miRNA 可能是乳腺癌非侵入性的生物标志物[8]。将外周血中肿瘤细胞与miR-1246 联合,对外泌体组织代谢物进行检测,对于早期精准发现乳腺癌有一定意义。由于外泌体具有很强的异质性,来源不同的外泌体具有不同的生物学行为。来源于脂肪干细胞的外泌体对TNBC MDA-MB-231 细胞的增殖无明显影响,但可显着促进MDA-MB-231 细胞的迁移,而对降低阿霉素的敏感性的作用并不明显[9]。但来源于脐带间充质干细胞的外泌体则具有抑制TNBC MDA-MB-231 细 胞 的 生 长 的 作 用[10],其 体外实验结果表明:来源于间充质干细胞的外泌体处理乳腺癌MDA-MB-231 细胞后,其增殖受到抑制,处理后细胞存活率明显下降(P<0.01);外泌体处理组STAT3 及 其 下 游 基 因C-MYC、BCL-XL、NANOG、OCT4、SOX2 表达下降。体内实验结果显示间充质干细胞来源的外泌体处理组肿瘤细胞在体内的生长受到抑制。本研究中,TAMs 外泌体内吞进入细胞内,6 h 富集显着;Transwell 小室高倍镜(×200)观察转移细胞数为241.00±3.35,明显高于空白对照组;同时具有促进TNBC MDA-MB-231 细胞的迁移作用,24 h 划痕试验结果显示TNBC MDA-MB-231 细 胞 的 迁 移 率 为(39.86±3.47)%。研究结果表明,乳腺肿瘤细胞分泌产生的的外泌体对肿瘤的发生及进程具有一定的调控作用,能促进肿瘤细胞迁移、侵袭、增殖及生长。这与范维肖等[11]研究结果一致,前列腺癌细胞分泌的外泌体,通过复杂的信号转导作用于基质细胞WPMY-1,使得多种癌相关成纤维细胞相关分子过表达,EGFR 和ERK1/2 的磷酸化水平提高,迁移和侵袭能力增强。
肿瘤细胞分泌的外泌体与其他细胞分泌的外泌体虽然都具备外泌体的一般共性,但由于来源的差异性,肿瘤来源的外泌体还具有独特的生物学特性[12]。这些外泌体通过促进肿瘤细胞生长、增殖、侵袭转移,调节机体免疫及肿瘤相关蛋白和基因的表达、参与肿瘤细胞及其微环境的信号传导,来发挥调控肿瘤作用。研究TAMs 外泌体对TNBC MDA-MB-231 细胞的影响,有助于揭示TNBC 潜在的特殊治疗靶点,开发不同的个体靶向治疗,进行分型施策,进而优化TNBC 的精准靶向治疗。



