陈子奇,孙治琪,黄渤皓,赵凡莹,刘子旺
(1.北京中医药大学第三附属医院,北京 100029;2.北京中医药大学东方医院,北京 100029)
阿尔茨海默病(Alzheimer disease,AD)早期出现记忆力下降,随着病情进展,认知困难逐渐加重,后期可能出现行为障碍、幻觉等严重症状,最终丧失基本生活能力[1]。国内外研究证实β-淀粉样蛋白(Aβ)沉淀是AD 起病及进展的的重要原因[2,3],而Wnt/β- catenin 信号通路的传导受阻与Aβ 的聚集所致的神经毒性 有很大关系[4,5]。Wnt/β-catenin 通路主要由β-连环蛋白(β-catenin)、糖原合成酶激酶3β(GSK-3β)等关键蛋白构成[6]。其中β-catenin 是该信号通路的重要下游因子,负责将信号传递到细胞中,在通路的激活过程中起着关键作用,而GSK-3β则是促进β-catenin 磷酸化、加速其水解的关键蛋白,主要与通路的抑制相关[7]。大量实验证实Wnt/β-catenin 信号通路激活能够降低Aβ 沉积,进而缓解神经元损伤[8,9]。电针作为一种将针身固定在相应穴位上并结合不同频率的电流刺激以达到治疗效果的新型针刺方法,能够延缓神经元衰老,更加安全有效的抑制AD 的发展,提高患者或模型鼠的记忆能力[10,11]。但电针对于海马区Aβ 沉积的影响以及相关的作用机制尚不明确。因此,本实验通过观察电针刺激百会、肾俞穴对小鼠认知功能的作用及其脑组织内GSK-3β、β-catenin 蛋白表达的影响,进而深入探究电针改善AD 的作用机理。
1 材料与方法
1.1 实验动物与分组
由北京维通利华实验动物技术有限公司提供24 只4 月龄,雄性,体重(30±5)g 的APP/PS1 痴呆小鼠和8 只4 月龄,雄性,体重(30±5)g 的C57BL/6 小鼠,动物许可证号:SCXK(京)2015-0001。小鼠在实验前一周统一购入,在温度(22±2)℃、湿度(55±5)%以及光照明暗各12 h 的环境中,用标准饲料和自来水适应性喂养一周。使用随机数字表法将24 只APP/PS1 小鼠分为3 组:模型组、电针组、西药组,另设同龄C57BL/6J 小鼠为空白组(8只)。已通过北京中医药大学实验动物伦理委员会批准(伦理审批号:BUCM-4-2019-092402-3070),符合动物伦理委员会的要求,并在实验过程中严格善待动物。
1.2 主要试剂与仪器
盐酸多奈哌齐片(卫材中国药业有限公司);无水乙醇(天津市科密欧化学试剂有限公司);苏木素染色液(贝索细胞科学技术有限公司);伊红染色液(索莱宝科技有限公司);Anti-GSK-3β antibody(proteintech,中国);Anti-β-catenin antibody(proteintech,中国);Anti-GAPDH antibody(abcam,美国)。
华佗牌无菌针灸针(苏州医疗用品有限公司生产);Morris 水迷宫实验装置,离心机(北京中医药大学中医学院提供);华佗电子针疗仪(苏州医疗用品有限公司);轮转式切片机(Leica Biosystems 公司,德国,型号:RM2255);研究型显微镜(OLYMPUS公司,日本,型号:DP72),酶标仪(Bio-tek,美国)等。
1.3 干预方法
空白组和模型组:只取穴,不予以针刺,同时给予2 mL 生理盐水灌胃,每天1 次,共计21 d。
电针组:据《实验针灸学》定位百会穴及肾俞穴,先后针刺百会穴(平刺2 mm)、双侧肾俞穴(直刺1 mm),连接电针仪,设置频率2 Hz,电流1~2 mA,每次针刺时间为15 min,每日1 次,共计21 d。
西 药 组:选 择 盐 酸 多 奈 哌 齐2 mg·kg-1·d-1)灌胃,每天1 次,共计21 d。
1.4 检测指标
1.4.1 Morris 水迷宫测试记忆力和学习能力 Morris 水迷宫法用来评估小鼠的学习能力和记忆力,其主要由两部分组成:第一部分为定位航行实验,第二部分为空间探索实验。该实验总共历时5 d,首先在第1 象限水下1 cm 处放置平台。连续进行4 d 的定位航行训练,将小鼠随机从其余3 个象限放入水池中,重复此训练并跟踪小鼠的游泳路线,记录它发现平台的时间(即逃避潜伏期)。在定位航行试验完成24 h 后,将水底平台拆除,并将小鼠从原来平台象限的对侧(即第3 象限)面向池壁放到水下,期间观察并记录小鼠60 s 内跨越平台的次数和其在目标象限停留的时间。
1.4.2 HE 染色观察小鼠海马区神经元结构 行为学检测结束后立即将小鼠麻醉,断头取脑,在冰盘上取出脑组织,对样本进行预冷、固定、洗涤、脱水、埋蜡等处理,制作厚度为5 μm 的样本切片。随后对切片脱蜡处理,再用无水乙醇充分水化,清洗,用苏木素染色,5 min 后冲洗再浸入伊红染色液,再次清洗后封片在×200 倍镜下对小鼠脑组织的形态结构变化进行观察。
1.4.3 Western Blot 法检测小鼠脑组织内GSK-3β、β-catenin 蛋白含量 取出剩余的50 mg 海马组织,加入RIPA 裂解液进行匀浆、裂解、离心处理,按照BCA 法测定样品蛋白的含量,电泳后转膜,封闭1 h。加入一抗(GSK-3β 1∶1 000、β-catenin 1∶1 000),4 ℃摇动作用过夜;TBST 溶液中摇动漂洗,加入二抗(羊抗兔IgG 抗体 1∶1 000),室温孵育1.5 h 后漂洗,进行显色、成像处理,并分析各组蛋白条带的灰度值。
1.5 统计学处理
采用SPSS 20.0 软件进行统计学分析,结果采用均数±标准误(±s)表示,组间比较采用单因素ANOVA 检验。若P<0.05,则提示差异具有统计学意义。
2 结果
2.1 电针对小鼠空间学习及记忆能力的影响
在前4 d 的定位航行实验中,第1 天是小鼠的适应性培养。与空白组比,模型组小鼠在训练期间的逃避潜伏期时间显着增加,提示APP/PS1 转基因小鼠存在明显的认知能力下降;从第2 天起,电针组和西药组逃避潜伏期的时间均低于模型组(P<0.05),且随着训练天数增加均呈现出逐渐下降的趋势。从游泳轨迹图来看,与模型组相比,各治疗组小鼠轨迹总路程均变短、目的性增强。见表1及图1)。

图1 干预后小鼠定位航行实验游泳轨迹图Fig 1 The swimming track map of mice was located in navigation experiment after the intervention
表1 干预后小鼠逃避潜伏期的变化(n=8,s,±s)Tab 1 Mice escaped the change of incubation period after intervention(n=8,s,±s)

表1 干预后小鼠逃避潜伏期的变化(n=8,s,±s)Tab 1 Mice escaped the change of incubation period after intervention(n=8,s,±s)
注:与空白组相比,*P<0.05;与模型组相比,#P<0.05。
组别空白组模型组电针组西药组4 d 24.75±4.87 52.94±5.48*30.03±15.78*#31.59±47.15*#35.726<0.001FP2 d 39.35±5.58 56.44±14.19*43.25±7.42*#47.51±46.40*#12.009<0.001 3 d 31.88±4.82 51.03±16.33*39.22±6.11*#41.09±46.42*#14.064<0.001
在第5 天的空间探索试验中,与空白组比,模型组小鼠的目标象限停留时间显着缩短、穿越平台次数显着减少,提示APP/PS1 转基因小鼠存在记忆障碍;与模型组比较,电针组和西药组的目标象限停留时间明显延长、穿越平台次数增多(P<0.05)。从游泳轨迹图来看,与模型组相比,各治疗组小鼠多在原平台位置及附近处游动,目的性较大,目标象限内轨迹较为密集。见表2 及图2)。

图2 干预后小鼠空间探索实验游泳轨迹图Fig 2 Swimming trajectories of mice in space exploration experiment after intervention
表2 小鼠干预后目标象限停留时间、穿越平台次数的变化(±s)Tab 2 Changes of residence time in the target quadrant and times of crossing the platform in mice after intervention(±s)
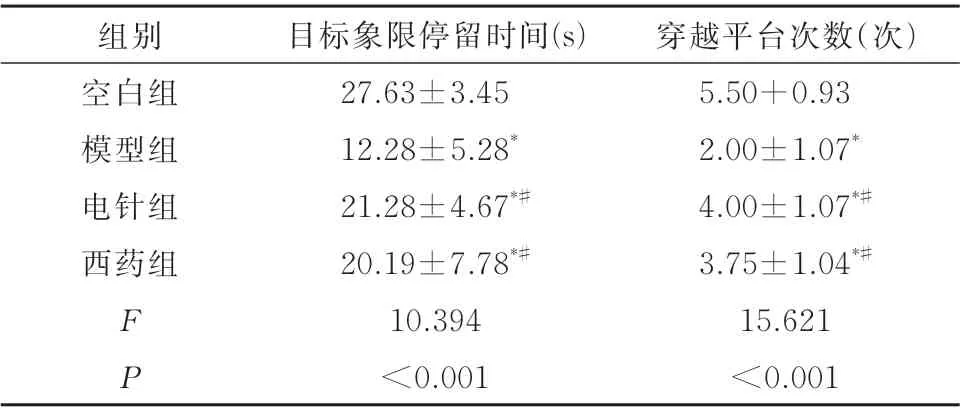
表2 小鼠干预后目标象限停留时间、穿越平台次数的变化(±s)Tab 2 Changes of residence time in the target quadrant and times of crossing the platform in mice after intervention(±s)
注:与空白组相比,*P<0.05;与模型组相比,#P<0.05。
穿越平台次数(次)5.50+0.93 2.00±1.07*4.00±1.07*#3.75±1.04*#15.621<0.001组别空白组模型组电针组西药组FP目标象限停留时间(s)27.63±3.45 12.28±5.28*21.28±4.67*#20.19±7.78*#10.394<0.001
2.2 电针对小鼠海马区神经元结构的影响
小鼠海马HE 染色结果显示,空白组小鼠的神经元分布均匀整齐,细胞结构完整清晰。模型组小鼠神经细胞分布紊乱不均匀,细胞核明显缩小,细胞间隙明显存在;与模型组相比,电针组和西药组可见小鼠神经元形态基本接近正常,结构较清晰。见图3。

图3 各组小鼠干预后海马组织病理形态(HE 染色)Fig 3 Hippocampal histological morphology of mice in each group after intervention(HE staining)
2.3 电 针 对 小 鼠 脑 组 织 内GSK-3β、β-catenin 的影响
与空白组相比,模型组小鼠中的β-catenin 蛋白水平减少(P<0.01),GSK-3β 蛋白水平升高(P<0.01);与模型组相比,电针组、西药组中的β-catenin蛋白表达显着上升(P<0.01),GSK-3β 蛋白表达显着下降(P<0.01)。见图4。

图4 小鼠海马β-catenin、GSK-3β 蛋白表达比较Fig 4 Comparison of β-catenin and GSK-3β protein expression in mouse hippocampus
3 讨论
Aβ 沉积是AD 的重要病因,其沉积所产生的老年斑也是AD 的主要病理变化。Aβ 是由于淀粉样前体蛋白在β 分泌酶和γ 分泌酶作用下水解而形成的一种蛋白,其难以溶解,易在突触间隙内大量聚集而导致老年斑的形成,老年斑一旦形成则会募集大量小胶质细胞而产生神经毒性[12]。正常情况下Aβ 始终保持一种动态的平衡,当Wnt/β-catenin 通路阻断则会导致Aβ 失衡而大量沉积,沉积的Aβ 会通过促进炎症反应、诱导细胞凋亡而产生神经毒性,导致神经元损害进而加速AD 的发展[13,14]。
中医认为AD 与“痴呆”、“呆病”属于同一范畴,其病机复杂,既有心血亏虚、脾气虚衰、肾精不足等虚邪内耗,也有痰浊瘀血等实邪蒙窍,其中肾精不足,髓海亏虚为根本病机。肾为封藏之本,内藏肾精,脑髓的生成源于肾精,随着年龄的增长,肾精逐渐亏损,脑海失充而影响脑的记忆功能,出现记忆力下降、呆傻愚钝的表现,临床治疗上亦多从补肾益智出发。《灵枢·海论》中记载:“督脉贯脊……入属于脑”,可见督脉直接沟通了脑络,并与肾相连,百会穴作为督脉的要穴,位于巅顶,具有益智醒神之效;膀胱经与脑相连,入腰中络肾,可使气血通畅,阴阳调和,肾俞位于膀胱经,是肾精聚集之处,针刺肾俞能使肾生髓。因此本实验选取百会、肾俞两穴位相配充分体现了补肾填精,醒神益智的中医整体观念。
传统毫针针刺的刺激量决定机体是否得气,且与疗效密切相关,电针将针刺的刺激量量化及标准化,具有较好的治疗效果[15]。盐酸多奈哌齐[16]已被证实能够缓解AD 的发展,但其长期口服存在一定副作用,且成本较高,而电针与其相比具有价格低廉,安全性较高的优势,且有研究发现[17,18]电针能够通过影响突触可塑性、降低脑部炎性反应而改善小鼠认知障碍,在临床上有着良好的应用前景。但对于电针降低Aβ 沉积的研究较少,因此本实验拟从缓解Aβ 沉积造成的神经元损伤角度出发,探讨电针治疗AD 的机制。
Wnt/β-catenin 信号途径在中枢神经系统中起着重要作用。Wnt 蛋白作为始动因子与其它蛋白(如 Frizzled)等充分结合,从而降低GSK-3β 蛋白的活性,使β-catenin 蛋白快速累积,从而调节下游目标基因的转录,最终启动该信号途径的传导[19]。Wnt/β-catenin 信号通路受到抑制已被确认与加速Aβ 沉积相关,其对神经系统的损害表现在加重神经毒性从而导致严重的神经元损害[20]。β-catenin 蛋白是Wnt 信号传导通路主要的正向调节因子,其过度磷酸化则不能激活下游基因的表达,进而抑制该通路,从而使Aβ 在脑内积聚而形成老年斑,产生神经毒性[21]。GSK-3β 作为决定降解β-Catenin 的重要负向调节激酶,其活性增强直接导致β-Catenin 磷酸化速度加快,使其被大量降解,从而阻断Wnt/β-catenin 信号通路;此外GSK-3β 也会直接参与到β淀粉样前体蛋白的酶解过程,其活性增强也会加速Aβ 的生成和沉积,反之沉积的Aβ 会造成GSK-3β过表达,从而过度降解β-catenin,进一步阻断信号通路,加重神经元的损伤,促进AD 的进展[5,22]。由此可见,下调GSK-3β 表达,不仅可以直接加速Aβ 的清除,还可以减少β-catenin 蛋白的过度降解,促进其向细胞核内转移进而启动Wnt/β-catenin 信号途径,降低Aβ 沉淀,减轻神经细胞的损伤。
本实验结果显示,电针、西药处理均能改善小鼠学习记忆功能。且电针干预后的HE 染色结果也表明小鼠海马区神经元排列基本接近正常,表明电针能够明显改善AD 的认知障碍。AD 的病理改变与脑中Aβ 的聚集有关,同时发现电针干预能够降低与Aβ 沉积相关的GSK-3β 蛋白,并增加β-catenin蛋白的表达,提示电针对AD 小鼠学习和记忆功能的改善作用可能与 Aβ 聚集的减少有关。
综上,电针干预可下调AD 小鼠海马的GSK-3β表达,并上调β-catenin 表达,激活Wnt 信号通路,降低Aβ 的沉积,从而减少神经元损伤。这为降低患者长期口服药物存在的副作用以及经济压力提供了新的辅助治疗思路,也为深入研究不同频率的电针改善小鼠认知障碍的具体机制提供了基础实验依据。
作者贡献度说明:
陈子奇:实验设计与实施、数据处理与分析、撰写论文;孙治琪:参与实验设计与实施;黄渤皓:实验动物饲养、实验标本采集;赵凡莹:数据分析技术指导;刘子旺:实验设计、实验内容统筹与规划、技术指导。
所有作者声明不存在利益冲突关系。



