李帮涛,庞启明,肖美芳,黄 燕,李虹艾,王 翠,张素丽,张华玲,向 伟,2
(1.海南省妇女儿童医学中心,海南 海口 570206;2.海南医学院国家卫健委热带病防治重点实验室,海南 海口 570206)
热性惊厥是幼儿最常见的惊厥性疾病[1]。热性惊厥的发病率在不同国家、不同地区有所不同,在美国和欧洲7 岁以下的儿童热性惊厥发病率为2%~5%,在日本为6%~9%[2],而我国不同地区报道的发病率差异较大,波动范围1%~13%[1]。维生素D 参与调控神经细胞生长、调节神经细胞免疫功能。IL‐6 作为一种常见的重要细胞因子,可能通过参与机体的免疫反应进而影响热性惊厥的发生[3]。海南省地处热带季风气候,紫外线光线相对较强,日照时间相对较长,区域特殊。本研究旨在研究海南省儿童血清25‐(OH)D3、IL‐6 水平与儿童热性惊厥发生的关系。
1 资料和方法
1.1 一般资料
选取2017 年01 月~2022 年10 月就诊于海南省妇女儿童医学中心、确诊为热性惊厥的患儿241 例为热性惊厥组。纳入标准:(1)确诊为热性惊厥,参考《热性惊厥诊断治疗与管理专家共识(2017 实用版)》[4];(2)患儿监护人签署知情同意书。排除标准:(1)存在其他颅内占位性疾病或严重颅内感染等;(2)合并癫痫;(3)合并电解质紊乱、遗传代谢性疾病等;(4)低出生体重儿或早产儿;(5)临床资料不完整者。其中男性158 例(65.56%),女性83 例(34.44%),男∶女为1.9∶1;年龄4 月10 天~9 岁2月,平均年龄(2.59±1.63)岁。根据临床特征可分为单纯性热性惊厥和复杂性热性惊厥。
选取就诊于海南省妇女儿童医学中心儿童保健科门诊进行健康体检、无不适症状的100 名健康儿童作为对照组。其中男性65 例(65%),女性35例(35%),男∶女为1.8∶1;年龄4 月22 天~6 岁11月,平均年龄(2.68±1.34)岁。
本研究经医院伦理委员会批准并签署家属知情同意书。
1.2 研究方法
1.2.1 资料收集 所有入组儿童进行血清25‐(OH)D3水平、IL‐6 水平测定,并录入年龄、性别、季节等临床信息。
1.2.2 血清25‐(OH)D3测定 采用直接化学发光技术的竞争免疫测试法检测受试者血清25‐(OH)D3水平,25‐(OH)D3试剂盒及配套质控品、标准品均由深圳市亚辉龙生物科技股份有限公司提供。
1.2.3 血清IL‐6 测定 采用双抗夹心法原理,应用抗原抗体和荧光量子点免疫层析技术,检测人血中IL‐6 的含量。使用深圳市金准生物医学工程有限公司生产的IL‐6 指控品进行质量控制,确保测试结果的有效性和准确性。
1.2.4 分 组 及 分 析 儿 童 血 清25‐(OH)D3≤ 12.5 nmol/L 为维生素D 严重缺乏,12.5 nmol/L<25‐(OH)D3≤ 37.5 nmol/L 为维生素D 缺乏,37.5 nmol/L<25‐(OH)D3≤ 50 nmol/L 为 维 生 素D 不足,50 nmol/L<25‐(OH)D3≤ 250 nmol/L 为适宜维 生 素D 水 平,250 nmol/L<25‐(OH)D3≤ 375 nmol/L 为维生素D 过量,25‐(OH)D3>375 nmol/L为维生素D 中毒[5]。本研究无维生素D 过量和维生素D 中毒的病例。对热性惊厥儿童血清25‐(OH)D3与IL‐6 水平进行多角度分析。
1.3 统计学处理
应用SPSS 26.0 统计学软件进行数据分析,对计量资料进行正态性检验,符合正态分布的计量资料以均数±标准差(±s)表示,两组间比较采用两样本t检验,多组间比较采用方差分析。非正态分布计量资料以M(Q1,Q3)表示,组间比较采用Kruskal‐Wallis 秩和检验。计数资料以例数(%)表示,组间比较采用χ2检验,以P<0.05 为差异有统计学意义。
2 结 果
2.1 一般情况
共纳入341 例研究对象,其中热性惊厥组患儿241 例,其中 男性158 例、女性83 例,年龄(2.59±1.63)岁;健康对照组儿童100 名,其中男性65 名、女性35 名,年龄(2.68±1.34)岁;两组性别、年龄的差异均无统计学意义(均P>0.05),见表1。
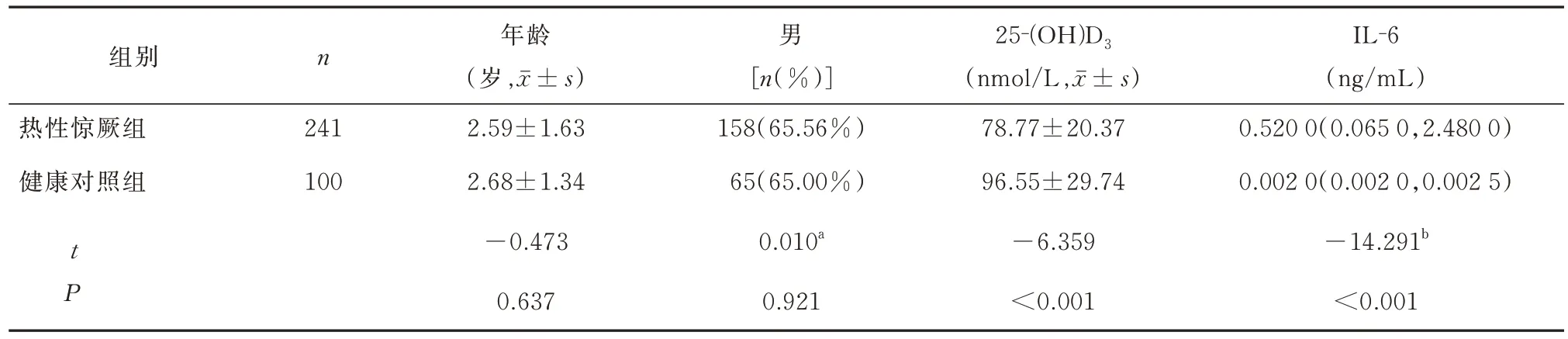
表1 热性惊厥组与健康对照组一般资料及血清25-(OH)D3、IL-6 水平比较Tab 1 General information and comparison of serum 25- (OH)D3 and IL-6 levels between the febrile convulsion group and the healthy control group
2.2 热性惊厥组和健康对照组血清25‐(OH)D3、IL‐6 水平比较
热性惊厥组和健康对照组的血清25‐(OH)D3值呈正态分布,热性惊厥组和健康对照组的血清25‐(OH)D3均值分别为(78.77±20.37)nmol/L 与(96.55±29.74)nmol/L,热性惊厥组血清25‐(OH)D3水平明显低于健康对照组,两组的差异具有统计学意义(t=−6.359,P<0.001)。而血清IL‐6 水平均呈偏态分布,热性惊厥组与健康对照组的血清IL‐6 水 平 描 述 为0.520 0(0.065 0,2.480)ng/mL 与0.002 0(0.002 0,0.002 5)ng/mL,热性惊厥组血清IL‐6 水平明显高于健康对照组,两组的差异具有统计学意义(Z=−14.291,P<0.001),见表1。
进一步比较热性惊厥组儿童血清25‐(OH)D3水平、IL‐6 水平在不同性别间的差异无统计学意义(t=0.320,P>0.05;Z=−0.558,P>0.05);健康对照组儿童血清25‐(OH)D3水平、IL‐6 水平在不同性别间的差异无统计学意义(t=0.258,P>0.05;Z=−0.472,P>0.05),见表2。
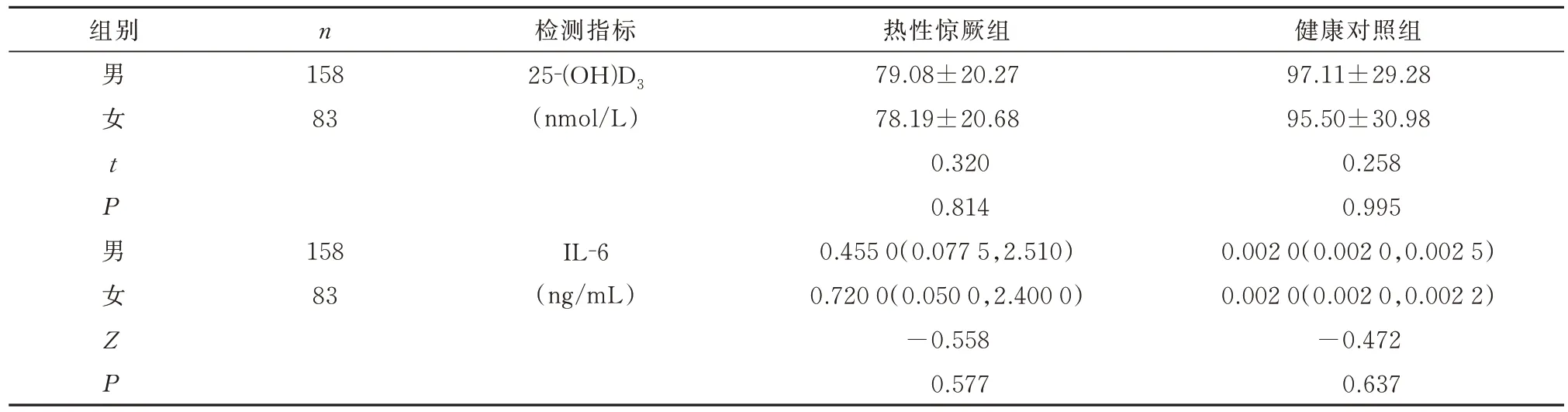
表2 不同性别热性惊厥儿童与健康对照组血清25-(OH)D3、IL-6 水平情况比较Tab 2 Comparison of serum 25-(OH)D3 and IL-6 levels between children with febrile convulsion and healthy control groups in differ-ent gender
2.3 不同程度的热性惊厥儿童与血清25‐(OH)D3、IL‐6 水平比较
热性惊厥儿童分为单纯性热性惊厥176 例和复杂性热性惊厥65 例。复杂性热性惊厥儿童血清25‐(OH)D3水平明显低于单纯性热性惊厥儿童,两组的差异具有统计学意义(t=6.612,P<0.05)。复杂性热性惊厥儿童IL‐6 水平明显高于单纯性热性惊厥儿童,两组的差异具有统计学意义(Z=−10.151,P<0.001),见表3。相关性分析显示,血清25‐(OH)D3水 平 与 热 性 惊 厥 呈 负 相 关(γ=−0.393,P<0.05);而血清IL‐6 水与其呈正相关(γs=0.328,P<0.05)。

表3 不同严重程度的热性惊厥组儿童血清25-(OH)D3、IL-6 水平情况比较Tab 3 Comparison of serum 25- (OH)D3 and IL-6 levels in children with febrile convulsion of different severity levels
进一步比较复杂性热性惊厥和单纯性热性惊厥两个亚组的25‐(OH)D3水平和IL‐6 水平在不同性别间的差异无统计学意义,见表4。
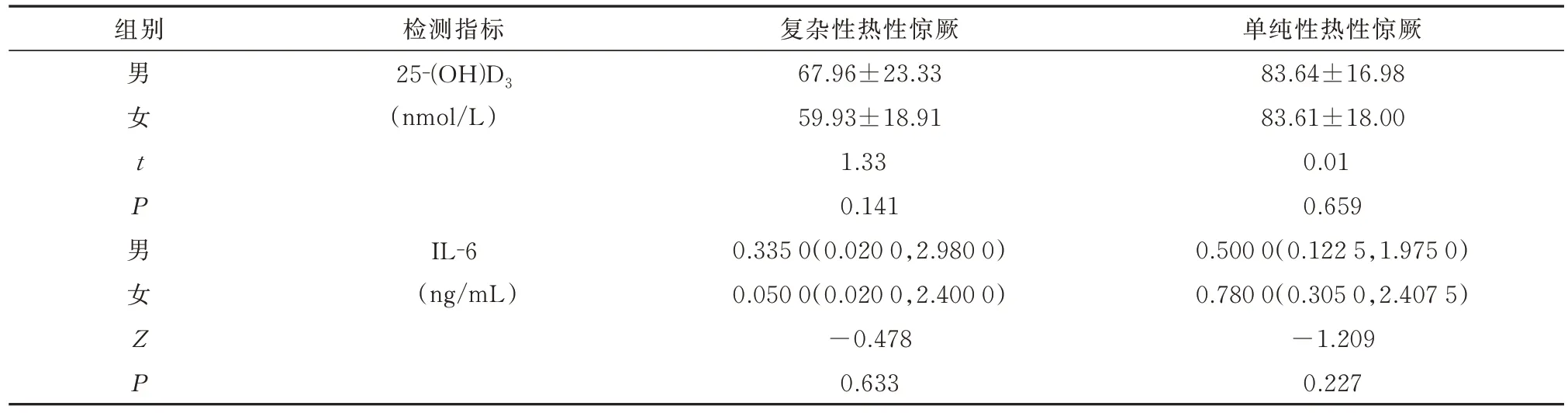
表4 不同性别的热性惊厥儿童血清25-(OH)D3和IL-6 水平情况比较Tab 4 Comparison of serum 25- (OH)D3 and IL-6 levels in children with febrile convulsion of different gender

表5 不同血清25-(OH)D3水平与热性惊厥严重程度的比较Tab 5 Comparison of different serum 25-(OH)D3 levels and severity of febrile convulsion
2.4 不同水平的血清25‐(OH)D3 与热性惊厥严重程度的比较
根据血清25‐(OH)D3水平,将热性惊厥儿童分为维生素D 非缺乏组、维生素D 缺乏组和维生素D不足组。维生素D 非缺乏组有209 例,其中单纯性热性惊厥儿童165 例,复杂性热性惊厥44 例,25‐(OH)D3水平的均值为(84.37±15.42)nmol/L;维生素D 缺乏组有25 例,其中单纯性热性惊厥儿童10 例,复杂性热性惊厥15 例,25‐(OH)D3水平的均值为(44.39±3.69)nmol/L;维生素D 不足组有7例,其中单纯性热性惊厥儿童1 例,复杂性热性惊厥6 例,25‐(OH)D3水平的均值为(34.50±3.66)nmol/L。3 组患儿血清25‐(OH)D3水平差异有统计学意义(F=118.96,P<0.001);热性惊厥的严重程度在血清25‐(OH)D3水平上的差异有统计学意义(χ2=29.83,P<0.001),见表3。
2.5 不同季节血清25‐(OH)D3与热性惊厥的比较
根据热性惊厥儿童就诊的时间分为春季、夏季、秋季及冬季4 个组,25‐(OH)D3水平在春季和冬季相对较低,夏季和秋季相对较高,但4 组血清25‐(OH)D3水平的差异无统计学意义(F=0.547,P>0.05),见表6。
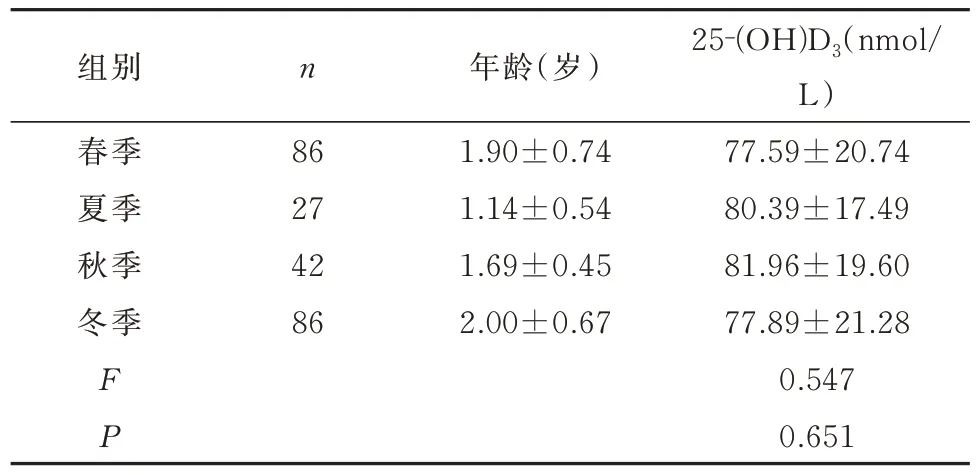
表6 241 例热性惊厥儿童不同季节血清25-(OH)D3水平的比较分析Tab 6 Comparative analysis of serum 25-(OH)D3 levels in 241 children with febrile convulsion during different seasons
3 讨 论
热性惊厥发病机制复杂且仍不明确,主要系患儿脑发育未完全成熟、髓鞘形成不完善、遗传易感性及发热等多方面因素相互作用所致[6]。目前越来越多的证据支持免疫和炎症过程参与惊厥发作的发病机制[3]。
维生素D 是一种脂溶性维生素,人体所需的维生素D 主要通过紫外线照射皮肤内的7‐脱氢胆固醇而合成,极少数能从食物中获得。儿童由于生长速度快、阳光暴露不足等原因成为维生素D 缺乏和不足的高危人群。李娈娈等对我国1 531 例7 岁以下的儿童进行维生素D 营养现状分析,发现儿童维生素D 缺乏和不足问题普遍,年龄、阳光暴露程度、维生素D 补充和婴幼儿配方摄入等因素均可影响维生素D 营养状况[7]。刘捷等[8]对天津市3 030 例婴幼儿进行维生素D 营养状况分析,发现天津3 岁以下 婴 幼 儿25‐(OH)D3缺 乏 率 为36.6%(1 109/3 030)。Yang 等[9]开展中国多地区横断面研究,共有18 个省份的825 家医院的460 537 名儿童参与这项研究,数据显示维生素D 缺乏、不足和充足的患病率分别为6.69%、15.92%和77.39%。而Li 等[10]开展海南省儿童血清25‐(OH)D3水平的多中心研究,发现14%(1 435/10 262)存在维生素D 缺乏。最初报道维生素D 具有抗惊厥性质是在1974 年[11]。神经元和神经胶质细胞中都表达维生素D 代谢酶1α‐羟化酶和维生素D 受体,进一步说明维生素D 在神经系统中有重要生物学作用[12]。在本研究中,热性惊厥组血清25‐(OH)D3水平较健康对照组明显降低,说明25‐(OH)D3与儿童热性惊厥具有关联性,这与既往的研究结果是相符的。Bhat 等[13]发现维生素D 缺乏与单纯性热性惊厥显着相关,且与复发呈负相关。丁可军等[14]发现安徽省郎溪县小儿热性惊厥的发生和维生素D 缺乏存在关联性。贺锦华等[15]对167 例热性惊厥患儿血清25‐羟基维生素D 进行多维度分析,发现四川省泸州地区儿童热性惊厥的发生与维生素D 缺乏密切相关,并建议儿童在各年龄阶段补充维生素D,可能有助于预防热性惊厥的发生。另外,进一步分析显示复杂性热性惊厥儿童血清25‐(OH)D3水平明显低于单纯性热性惊厥儿童,两组的差异具有统计学意义。说明热性惊厥的严重程度在血清25‐(OH)D3水平上的差异有统计学意义。血清25‐(OH)D3水平可因季节差异而不同,Li 等[10]报道海南省10 262 名健康儿童的血清25‐(OH)D3水平达(94.64±49.99)nmol/L。其中,春季组2 086 名儿童的血清25‐(OH)D3水平达(96.56±45.76)nmol/L,夏季组2 877 名儿童的血清25‐(OH)D3水平达(96.85±52.23)nmol/L,秋季组2 917 名儿童的血清25‐(OH)D3水平达(94.53±50.40)nmol/L,冬 季 组2 382 名 儿 童 的 血 清25‐(OH)D3水平达(90.14±50.03)nmol/L。海南省儿童冬季的血清25‐(OH)D3水平明显低于其他三个季节,海南地处热带季风气候,每年3 月、7 月和10 月紫外线光线最强,而冬季维生素D 低与日照时间较短、皮肤阳光暴露不足、紫外线辐射减弱、儿童的户外活动少、厚重衣服多等有关。本研究中热性惊厥儿童的血清25(OH)D3水平在春季和冬季相对较低,夏季和秋季相对较高,但并无统计学差异。
IL‐6 是一种重要的细胞因子,具有双重神经保护和神经元兴奋毒性作用,既可作为促炎因子引起热性惊厥患者脑损伤,增加惊厥敏感性,又可抗凋亡,起修复神经元的作用[3,16]。本研究发现热性惊厥组血清IL‐6 水平明显高于健康对照组,两组的差异具有统计学意义。同样地,复杂性热性惊厥儿童IL‐6 水平高于单纯性热性惊厥儿童,两组的差异具有统计学意义。叶晓敏等[17]探讨血清IL‐4、IL‐6、IL‐10、TNF‐α 表达水平与热性惊厥发病的关系,发现IL‐4、IL‐6、IL‐10 及TNF‐α 在热性惊厥患儿表达明显升高,且IL‐6 是复杂性热性惊厥发生的危险因素。
总之,热性惊厥患儿血清25‐(OH)D3是显着下降的,而IL‐6 水平是显着升高的,并且与热性惊厥的严重程度有一定关系,从某种意义上说明25‐(OH)D3和IL‐6 可能参与热性惊厥的发生过程。而二肽基肽酶4(DPP4)可能参与调节IL‐6 等细胞因子的水平,诱导热性惊厥的发生、发展,是热性惊厥中神经炎症的重要调节因子。DPP4 及IL‐6 基因和蛋白在动物及临床水平具有高表达模式,与热性惊 厥 密 切 联 系[18]。DPP4 特 异 性 酶 抑 制 剂(DPP4‐Is)西格列汀可明显减轻热性惊厥大鼠惊厥发作的严重程度,抑制DPP4 后,热诱导的星形细胞受到抑制;西格列汀显着降低炎性细胞因子IL‐1β、TNF‐α 和IL‐6 的 水 平[19]。低 维 生 素D 水 平 和 高DPP4 活性之间存在关联,维生素D 水平与DPP4‐Is治疗的持续时间呈正相关[20]。因此,DPP4 是否通过调节维生素D 和IL‐6 共同参与热性惊厥的发病机制,DPP4‐Is 是否可能成为热性惊厥治疗的一个可行选择,值得深入研究。
本研究综合探讨了25‐(OH)D3、IL‐6 与儿童热性惊厥的关系,丰富了热性惊厥发病机制的研究内容。研究中儿童群体均来自海南省,海南省具有独特的地理位置和气候条件,存在一定的区域特殊性,对开展全国热性惊厥与维生素D 的多中心研究具有重要的参考价值。但本研究也存在不足之处,本研究为单中心研究,复杂性热性惊厥与健康对照组的样本量不够大,研究结果可能有一定的偏倚,后期需要大样本进一步证实其关系。
综上所述,热性惊厥的发生与血清25‐(OH)D3与IL‐6 的水平存在关联性,25‐(OH)D3与IL‐6 可能参与热性惊厥的发病机制。因此,对有癫痫发作家族史、有热性惊厥病史的儿童需定期监测血清25‐(OH)D3水平、合理补充维生素D。



