李 莉,陈保锦,刘志武,张 艺,陈 明
(兰州大学第一医院:1.检验科;2.呼吸科;3.核医学科,兰州 730000)
骨骼是中晚期肺癌患者转移最常见的部位,骨转移后并发症较多,表现为疼痛、高钙血症、运动障碍、病理性骨折等,给患者带来极大的痛苦,减少生存期。现在多项肿瘤标志物的联合检测,显着提高肺癌的早期临床诊断,但对肺癌骨转移的早期诊断缺乏相关性研究。本研究对肺癌骨转移患者进行破骨细胞分化因子(ODF)、破骨细胞生成抑制因子(OCIF)、血清钙(Ca)水平的检测,同时监测患者在唑来膦酸治疗后2、4、6个月ODF、OCIF、CA的水平变化,分析其与肺癌骨转移临床预后的相关性,为其诊断、监测治疗疗效提供一定依据。
1 资料与方法
1.1一般资料 收集该院诊断为肺癌的114例患者,均经细胞学和病理学确诊。非骨转移组51例,男35例,女16例,年龄32~78岁;小细胞癌18例,鳞癌10例,腺癌20例,腺鳞癌3例。骨转移组63例,男41例,女22例,年龄39~75岁;小细胞癌22例,鳞癌15例,腺癌23例,腺鳞癌3例。
1.2仪器与试剂 采用Olympus AU2700全自动生化分析仪及北京九强生物技术有限公司试剂检测Ca,ODF和OCIF采用美国Uscnlife公司试剂在全自动酶标仪上进行定量分析。
1.3方法 2组患者清晨抽取空腹静脉血5 mL,离心后血清Ca当日检测,剩余标本分装于―80 ℃冰箱保存待测ODF和OCIF水平。血清ODF 和OCIF采用酶联免疫吸附试验(ELISA)法,血清Ca采用偶氮砷Ⅲ法。骨转移组患者使用唑来膦酸钠注射液4 mg,加入生理盐水100 mL,快速静脉滴注15 min,每4周为1个疗程,持续6个月。采集治疗前、治疗后2、4、6个月的血清标本。
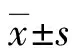
2 结 果
2.12组患者各指标结果比较 2组患者ODF和OCIF水平比较,差异有统计学意义(P<0.01),2组Ca水平比较,差异也有统计学意义(P<0.05)。见表1。
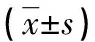
表1 2组患者各指标结果比较
注:与非骨转移组比较,abcP<0.01
2.2骨转移组患者治疗时各指标变化比较 骨转移组患者唑来膦酸治疗2个月时 ODF、OCIF、Ca水平与0个月比较,差异有统计学意义(P<0.05);治疗4个月时与0个月比较,各指标差异有统计学意义(P<0.05);治疗6个月时与0个月比较,各指标差异有统计学意义(P<0.01);治疗4个月时与2个月比较,各指标差异有统计学意义(P<0.05);治疗6个月时与4个月比较,各指标差异有统计学意义(P<0.05)。见表2。
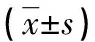
表2 骨转移组患者唑来膦酸治疗各时点各指标水平变化比较
3 讨 论
肺癌是最常见的恶性肿瘤,发病率呈明显的增加趋势,中晚期肺癌骨转移发生率约为30%~40%,骨转移患者生活质量下降甚至威胁生命[1-2]。目前对骨转移的诊断一般通过X光线、电子计算机断层扫描(CT)、发射型计算机断层仪(ECT)、磁共振成像(MRI) 等进行确诊,但均对早期诊断骨转移的敏感性较差,正电子发射型计算机断层(PET) 检测价格昂贵,不适合病情监测。近年来,骨骼生成和破坏的特异性标志物在骨转移癌的早期诊断和预测的价值受到广泛关注。骨组织是由成骨细胞、骨细胞、破骨细胞、骨原细胞等和大量钙化的细胞间质组成。骨形成和骨吸收之间的平衡是由成骨细胞和破骨细胞的活动及其相互作用而决定。癌细胞原发灶的转移是造成肿瘤转移的重要环节,ODF和OCIF是恶性肿瘤骨转移过程中释放的一对重要因子[3-4]。当ODF受单核细胞集落因子刺激,与相应细胞受体结合,从而刺激破骨细胞系前体转变为成熟的破骨细胞,使骨质溶解破坏,在高水平时就会增加细胞活性,减少成熟破骨细胞的细胞凋亡[5]。ODF还可促进破骨细胞生成,并激活破骨细胞活性。OCIF是肿瘤坏死因子受体家族的成员,在体外OCIF抑制破骨细胞的形成,在体内OCIF抑制骨吸收[6-7]。
本研究结果显示,2组患者ODF和OCIF水平比较,差异有统计学意义(P<0.01)。赵雪志等[8]研究发现OCIF在骨转移组水平升高;谭云昌[9]也研究报道,前列腺癌骨转移患者血清ODF和OCIF水平显着增高。说明ODF和OCIF都参与了骨转移,ODF和OCIF水平均增高,ODF可促进骨质破坏的作用,OCIF具有抑制作用,但ODF的破坏活力强于OCIF的抑制活力,造成骨转移部位的溶骨性破坏。提示ODF和OCIF对诊断肺癌骨转移具有一定的临床价值,可作为重要的参考指标。骨转移的病理基础主要是肿瘤细胞与破骨细胞、成骨细胞间的相互作用,当骨质破坏以溶骨性为主时大量骨基质被破坏,释放出的Ca超过肾和肠清除Ca的能力,导致患者Ca水平明显升高。本研究结果显示,骨转移组患者血清Ca高于非骨转移组(P<0.05)。有研究报道,高水平Ca(>2.65 mmol/L)是影响前列腺癌骨转移患者生存的独立危险因素[10]。有关研究表明,血清Ca水平升高与肺癌骨转移相关,但与骨转移类型无关,提示Ca水平对评价骨病灶的进展具有重要的意义[11]。
唑来膦酸作为第3代双磷酸盐,是目前临床应用最广泛的恶性肿瘤骨转移的治疗药物,能抑制破骨细胞的活性,诱导破骨细胞凋亡[12-13]。通过与骨表面的羟磷灰石结合而阻止骨和软骨矿物质的再吸收,同时唑来膦酸还可抑制肿瘤细胞释放细胞因子引起的破骨细胞活性增加和骨钙释放,可减轻骨转移疼痛、降低Ca水平[14-15]。本研究结果表明,骨转移组患者接受唑来膦酸治疗后,ODF水平在用药后2、4、6个月逐渐降低,说明破骨细胞的活性下降,溶骨能力减弱。OCIF水平在用药后2、4、6个月逐渐升高,提示OCIF抑制了破骨细胞的分化形成及功能,促进破骨细胞凋亡,增加成骨细胞合成的能力。通过监测肺癌骨转移患者接受唑来膦酸治疗后血清Ca水平变化,发现Ca水平在用药后2、4、6个月逐渐降低,说明唑来膦酸促进破骨细胞凋亡,抑制骨基质分解和骨盐溶解,从而降低Ca水平[16]。赵晓亮[17]研究显示,唑来膦酸能改善肺癌骨转移引起的疼痛和高钙血症。提示血清Ca在骨转移治疗过程中具有很好的相关性,对肺癌骨转移患者治疗及疗效的观察有广泛的应用前景。
综上所述,肺癌骨转移是一个复杂的生物学过程,研究过程中对病例选择、检测方法、统计学方法的不同可能可导致不同的结论。本研究结果显示,联合检测血清ODF、OCIF、Ca水平可作为肺癌骨转移患者的预测指标,对其治疗及疗效具有临床价值。
参考文献
[1]韩雪,乔鹏,谢梦,等.2002-2010年上海市杨浦区居民肺癌发病与死亡分析[J].中华肿瘤杂志,2012,34(6):717.
[2]刘宇,张幸平,吴红宇,等.258例肺癌骨转移患者的临床及治疗相关因素分析[J].中国肿瘤临床,2012,39(13):914-918.
[3]RAFIEI S,KOMAROVA S V.Molecular signaling pathwavs mediating osteoclastogenesis Induced by prostate cancer cells[J].BMC Cancer,2013,26(13):605-607.
[4]KUSHLINSKIY N E,TIMOFEEVIU S,GERSHTEYN E S,et al.Clinical perspectives of the Study of RANK/RANKL/OPG system components in primary and metastatic bone tumor[J].Vopr Onkol,2014,60(4):413-421.
[5]HOFBAUEROF L C,KHOSLA S,DUNSTAN C R,et al.The rols of osteoprotegerin and osteoprotegerin ligand in the paracrine regulation of bone resorption[J].J Bone Miner Res,2000,15(1):2-12.
[6]WALSH M C,CHOI Y.Bioiogy of the TRANCE axis[J].Cytokine Growth Factor Rew,2003,14(3/4):251-263.
[7]KOIDE M,MURASE Y,YAMATO K,et al.Bone morphogenetie protein-2 enhances osteoclast formation mediated by interleukin-1alpha through upregulation of osteoclast differentiation factor and cyclooxygenase-2[J].Biochem Biophys Res Commun,1999,259(1):97-102.
[8]赵雪志,李纲,王振杰,等.前列腺癌患者血清骨保护素测定的临床价值[J].中国综合临床,2010,26(12):1242-1243.
[9]谭云昌.血清破骨细胞分化因子及生成抑制因子测定在前列腺癌骨转移诊断中的价值[J].中国现代医学杂志,2014,23(1):37-40.
[10]GUPTA D,TRUKOVA K,POPIEL B,et al.The association between pre-treatment serum 25-hydroxyvitamin D and survival in newly diagnosed stage Ⅳ prostate cancer[J].PLoS One,2015,10(3):e0119690.
[11]SOYFOO M S,BRENNER K,Paesmans M,et al.Non-malignant causes of hypercalcemia in cancer patients:a frequent and neglected occurrence[J].Support Care Cancer,2013,21(5):1415-1419.
[12]SKERJANEC A,BERENSON J,HSU C,et al.The pharmacokinetics and pharmacodynamics of zoledronic acid in cancer patients with varying degrees of renal function[J].J Clin Pharmacol,2003,43(2):154-162.
[13]BODY J J,LORTHOLARY A,ROMIEU G,et al.A dose-finding study of zoledronate inhypercalcemic cancer patients[J].J Bone Miner Res,2009,14(9):1557-1561.
[14]COLEMAN R,GNANT M.New results from the use of bisphosphonates in cancer patients[J].Curr Opin Support Palliat Care,2009,3(3):213-218.
[15]COSTA L,MAJOR P P.Effect of bisphosphonates on pain and quality of life in patients with bone metastases[J].Nat Clin Pract Oncol,2009,6(3):163-17
[16]KELLER J,CATALA-LEHNEN P,HUEBNER A K,et al.Calcitonin controls bone formation by inhibiting the release of sphingosine 1-phosphate fromosteoclasts[J].Nat Commun,2014,59(4):12-15.
[17]赵晓亮.唑来膦酸与帕米膦酸二钠治疗肺癌骨转移疼痛的疗效与安全性对比分析[J].现代预防医学,2011,38(6):1179-1180.



