马子豪,沈元元,陶千山,董 毅
安徽医科大学第二附属医院血液科,安徽合肥 230601
髓细胞肉瘤(MS)是一种少见的髓外实体瘤,是由白血病细胞和髓系前体细胞组成的局部肿瘤。MS的确切发病率尚不清楚,尽管它发生在约3%的白血病患者中。MS最常见的受累部位是骨、骨膜、软组织、淋巴结和皮肤,中枢神经系统中MS的实质内受累是罕见的[1-3]。在此,本文报告1例患者在急性髓系白血病(AML)治疗缓解后出现小脑实质MS侵犯,但没有颅骨、脑膜或骨髓侵犯。
1 临床资料
患者,男,25岁,2020年11月5日因全身多发肿块伴破溃就诊于安徽医科大学第二附属医院血液科,完善骨髓穿刺等检查诊断为AML(M4),予以IA化疗方案:第1~3天伊达比星(海正辉瑞制药有限公司,生产批号:H20050144)10 mg/m2,第1~7天阿糖胞苷(海正辉瑞制药有限公司,生产批号:H20054694)100 mg/m2首次诱导治疗,复查骨髓穿刺,评估发现原发病部分缓解;2021年1月1日予以HA化疗方案:第1~7天高三尖杉酯碱(哈药集团三精制药有限公司,生产批号:H23021690)2 mg/m2,第1~7天阿糖胞苷100 mg/m2再诱导治疗后达到完全缓解,CBF-MYH11转阴,后予以含中剂量阿糖胞苷(第1~3天高三尖杉酯碱4 mg、阿糖胞苷2 800 mg,其中阿糖胞苷每12小时1次)方案3次巩固治疗,期间行1次鞘内注射预防中枢神经系统白血病,脑脊液没有发现白血病细胞浸润。2021年10月16日患者因头痛伴呕吐4 d来院就诊,期间伴有走路不稳,随后行头颅CT提示右侧小脑半球混杂稍高密度影(图1),进一步行头颅增强MRI显示右侧小脑半球异常信号,考虑颅内浸润可能(图2),完善骨髓穿刺等检查仍处于骨髓缓解状态。2021年10月25日行超声辅助下右枕开颅幕下深部病变切除术,术后病理结果提示小蓝细胞单克隆性增生,弥漫分布,免疫组织化学染色显示MPO(+)、CD3(-)、CD5(-)、CD20(-)、CD79α(-)、CyclinD1(-)、BcL-2(+)、Ki-67(90%,+)、CD117(+)、CD34(+),结合患者病史,符合髓系白血病改变,考虑为小脑MS。2021年11月27日再次入住血液科治疗,骨髓穿刺等检查显示骨髓原始细胞85%(图3),骨髓免疫分析:原始细胞+幼稚细胞81%,CBF-MYH11定量为94.485%,染色体47,XY,inv(16)(p13q22),+22.[10],考虑AML骨髓复发。予以CLAG化疗方案化疗:第1~5天克拉屈滨(浙江海正药业股份有限公司,生产批号:H20052252)6 mg/m2、阿糖胞苷2 000 mg/m2,第0~5天粒细胞集落刺激因子(齐鲁制药有限公司,生产批号:S19990049)300 μg,并加用鞘内注射,后复查骨髓穿刺提示骨髓原始细胞2%,骨髓流式异常细胞1.1%,骨髓染色体46,XY[10],CBF-MYH11阴性,脑脊液未发现白血病细胞,小脑异常信号较前期明显缩小(图4)。考虑患者预后较差,目前已行单倍体异基因造血干细胞移植,患者在随访中。
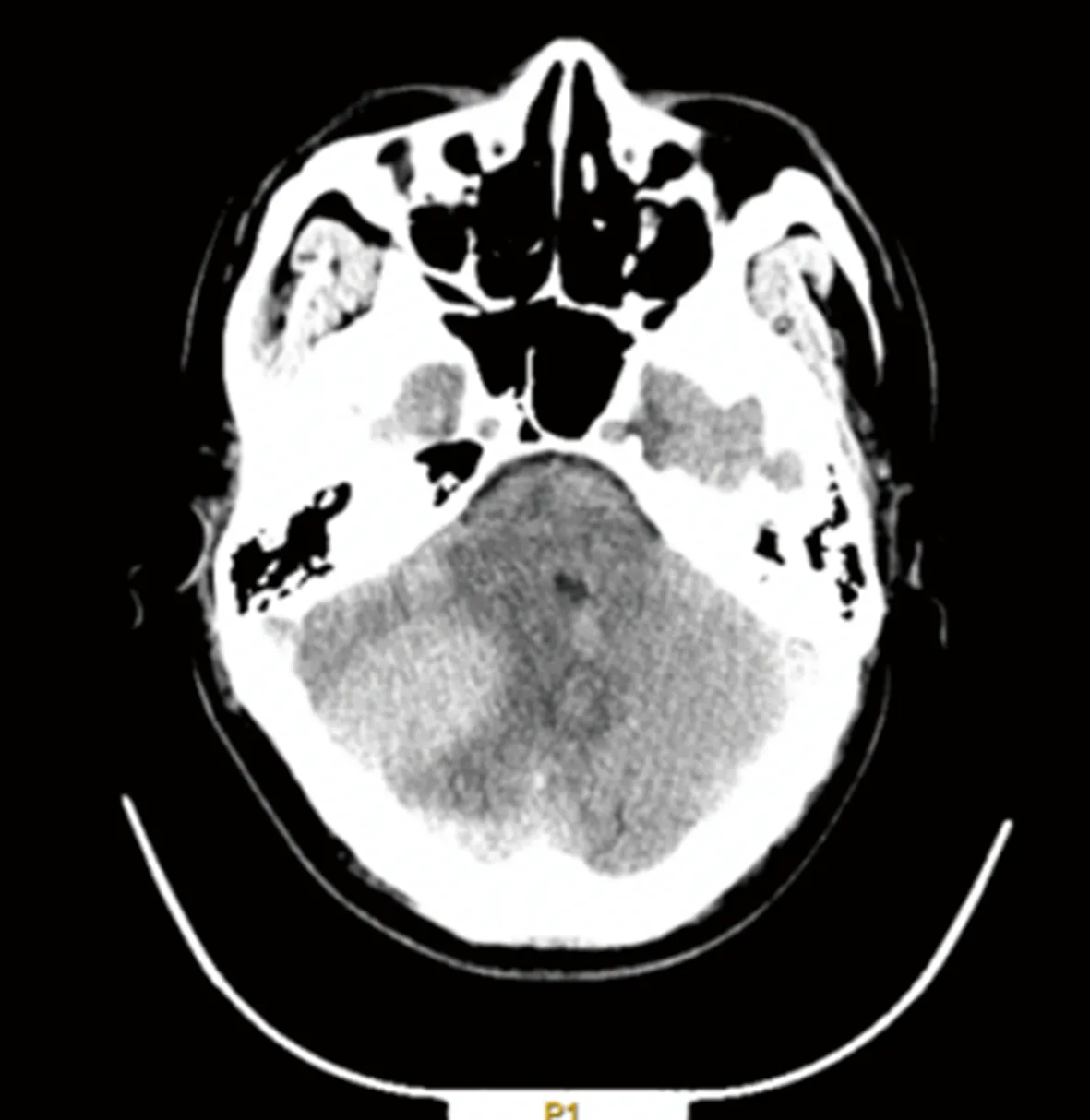
图1 头颅CT检查
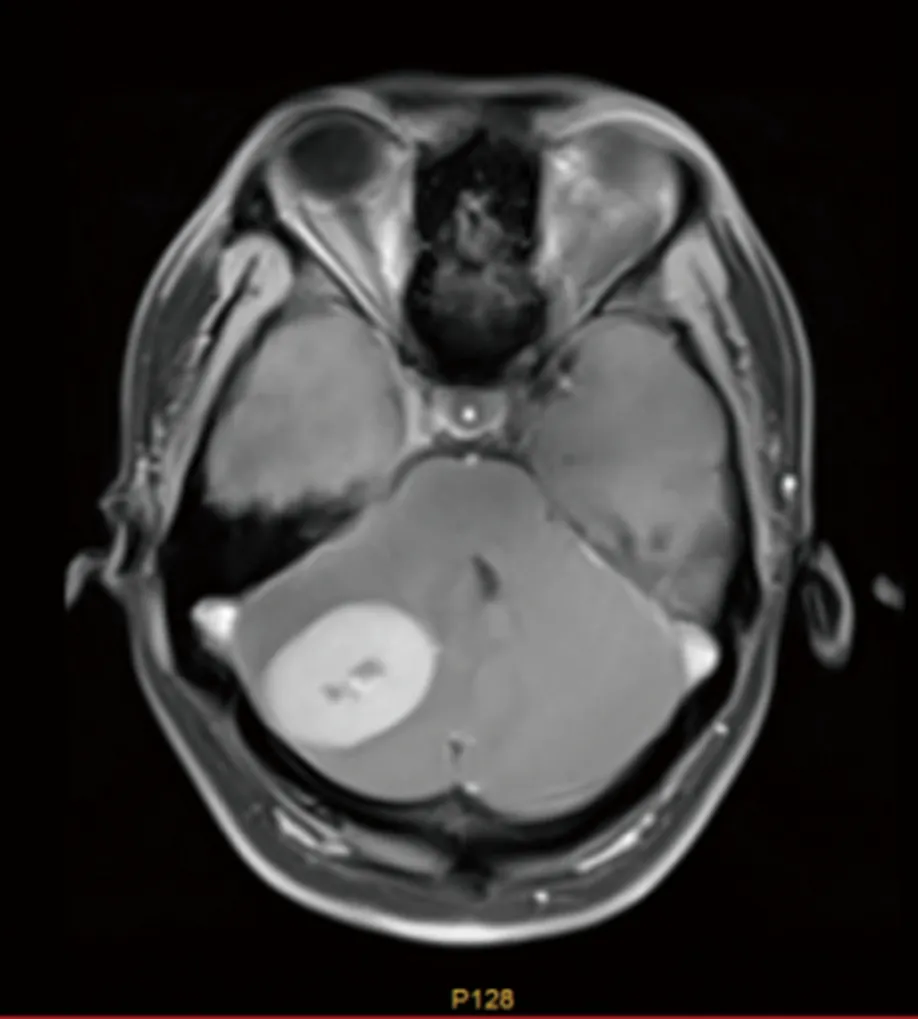
图2 头颅增强MRI检查
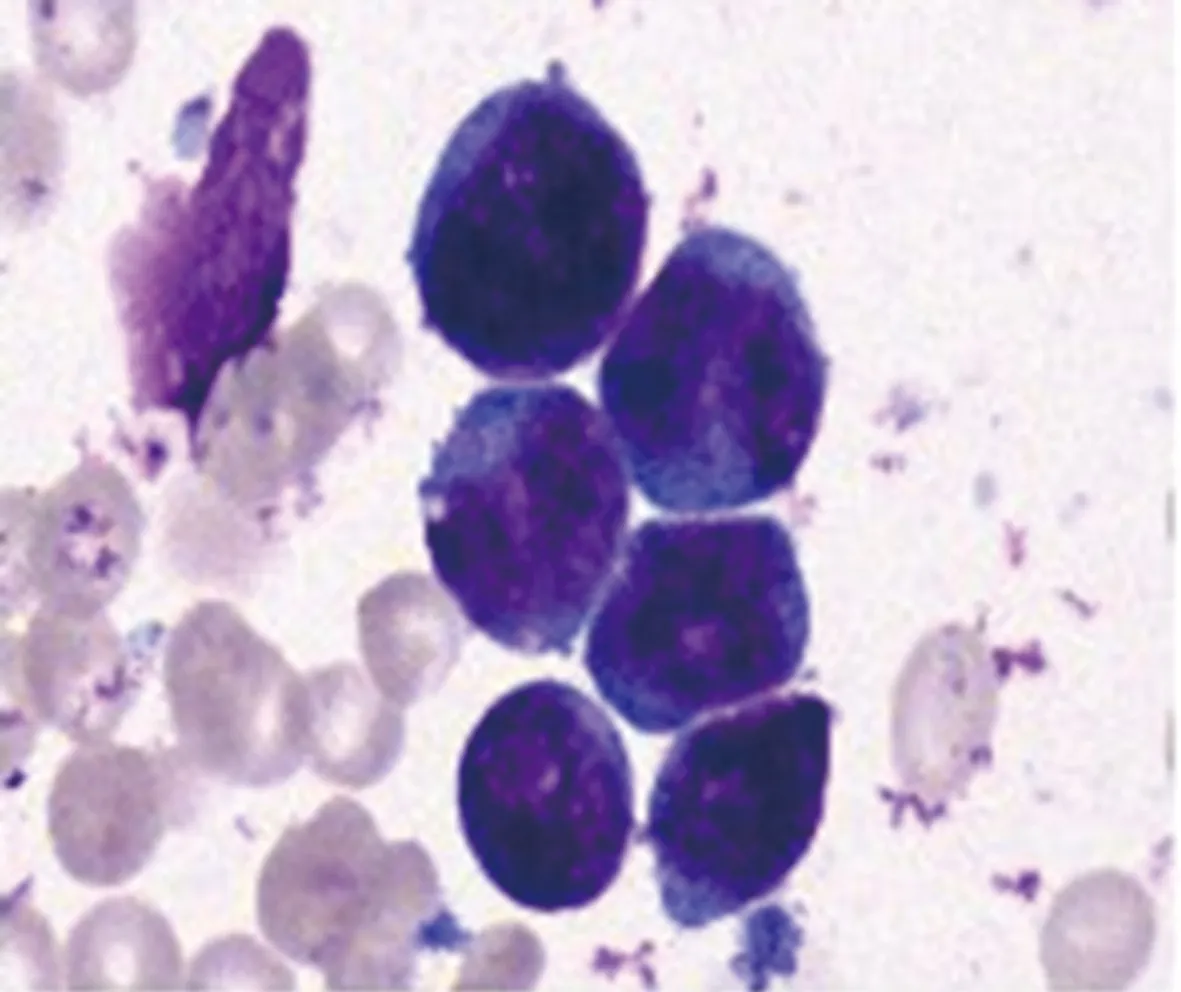
图3 骨髓细胞学检查(×100)
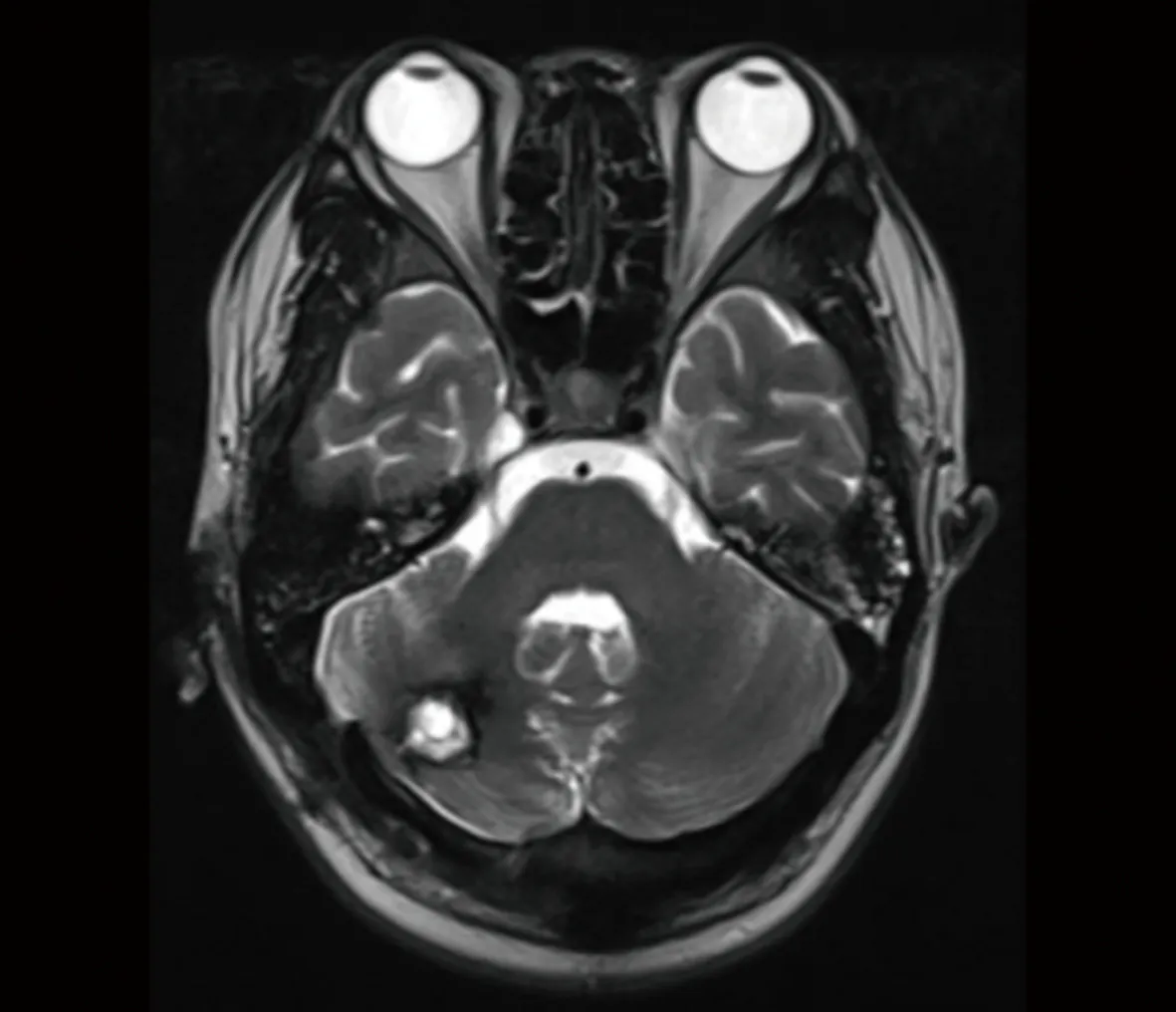
图4 治疗后头颅MRI检查
2 讨 论
MS是一种罕见的未成熟髓系细胞的髓外肿瘤,可出现在多种骨髓外组织中。AML髓外累及相对罕见,但具有临床意义,往往造成治疗困难,并且一旦发生预示着预后不佳。MS可以在最初诊断时出现,但也可以在自然病程中的任何时候发生,甚至在多年完全缓解后在孤立性中枢神经系统复发。随着化疗方案的不断改进和造血干细胞移植的广泛开展,AML患者缓解期和无病生存期不断延长,使得其有机会发生髓外复发,可能是近年来髓外肿瘤逐渐增多的主要原因。
关于MS的发病机制近年来也有许多的探讨,目前认为白血病细胞产生的黏附分子、表皮生长因子、CD56在中枢神经系统白血病的发生中扮演着重要角色[4-6]。血管内皮生长因子水平升高被发现常见于AML并发中枢神经系统白血病的患者,其除了促进血管生成,还可以通过直接作用于内皮细胞来增加通透性,包括破坏血脑屏障从而使白血病细胞更容易侵犯中枢神经系统[4]。CD56又被称为神经细胞黏附分子,被认为是中枢神经系统白血病发展的重要因素,AML患者如出现CD56阳性往往提示较高的髓外受累发生率[5]。白血病产生的大量的黏附分子被认为具有更强的黏附内皮细胞表面的能力,从而让白血病细胞沿着血管通道的管壁移动,通过内皮迁移或内皮破坏穿过血管内皮细胞从而渗透到血管周围空间和脑实质而侵犯中枢神经系统[6]。而M4、M5髓外复发相对常见的原因被认为与这2种分型的白血病会分泌高水平的整合蛋白有关,也有研究表明这些出现中枢神经系统侵犯的患者初诊时往往有高乳酸脱氢酶血症[7]。
MS的临床表现不同,体征和症状取决于其特定的位置和大小。最常见的部位包括软组织、骨、骨膜和淋巴结,许多部位已经被描述[8-9]。MS中枢累及极为罕见,是一种与脑膜白血病不同的实体。有研究描述其发病中位年龄为34.8岁,表现为头痛、视力不佳、运动障碍等,小脑占10.1%[10]。MS的临床特征分为4种:(1)原发性MS;(2)AML发病时并发的MS;(3)作为AML的孤立复发;(4)MS伴AML的骨髓复发。本例患者发展为小脑MS,无脑脊液或骨髓受累,是AML的孤立复发,约35%的颅内MS患者没有脑脊液受累。由于AML并发MS发病率相对较低,未常规行CT或MRI检查而导致早期诊断不足,而对于有头痛等中枢神经系统症状的患者应先行影像学检查,排除神经系统出血或感染,诊断往往需要手术病理检查[9-10]。本例患者骨髓完全缓解期间曾行一次腰椎穿刺加鞘内注射但后来仍在完全缓解的情况下出现髓外复发。
关于治疗MS的资料很少,其最佳治疗方法尚不清楚。应根据患者特征、MS位置和细胞遗传学特征进行个体化管理。MS的处理包括手术肿块切除、化疗和放疗。接受手术的患者可以有一定程度的改善,手术切除的范围与病死率无关[11]。局限于一个或几个部位的MS通常采用局部治疗,如放疗,尽管MS对放疗非常敏感,但大多数患者在3个月内死亡,75%~90%的孤立性患者会发展为髓内AML,潜伏期为4~12个月。因此,孤立性MS患者也可接受系统性抗白血病治疗,即使骨髓没有显示任何白血病浸润,也可以显着减少原发性MS转化为急性髓细胞白血病,延长总生存期[12-13]。本研究中该例患者为AML的小脑部位孤立复发,接受含大剂量阿糖胞苷的方案进行全身治疗,可能是较好的选择,缓解后应尽早行异基因造血干细胞移植[14]。MS患者中都观察到BCL-2的高表达,这些结果可以支持对MS患者使用BCL-2抑制剂[15]。
MS是罕见疾病,表现形式多种多样,有可疑症状、体征应及早行相关检查,组织病理检查是诊断的主要依据,需注意与淋巴瘤等相鉴别,目前的机制及预后指标尚不清楚[16-17],没有统一的治疗方案,含大剂量阿糖胞苷的方案进行全身治疗是目前较好的选择,并应及早进行异基因造血干细胞移植[18-19]。



