姜志明 ,鲁召欣 ,张 明 ,孙楠楠 ,张众慧 ,杨 君 ,徐拥庆 ,李 涛 ,解 建
1.山东省千佛山医院重症医学科,山东济南 250014;2.青岛市海慈医疗集团急诊科,山东青岛 266033
重症急性胰腺炎(severe acute pancreatitis,SAP)是外科最为凶险的急腹症之一,其起病急、发展迅速、并发症多、病死率高[1]。近年来的研究显示,SAP早期出现严重的全身性炎症反应 综合征 (systemic inflammatory response syndrome,SIRS),随着SIRS的发展势必导致胰外多器官损伤,甚至多器官功能障碍(multiple organ dysfunction symdrome,MODS)的发生[2]。重症急性胰腺炎引起肠黏膜屏障功能损害,发生肠道细菌移位,致使肠源性感染增加。胰腺坏死组织合并感染是SAP死亡的主要原因。据文献报道,SAP的死亡80%是胰腺及胰周组织的继发感染;而继发感染的90%以上是肠道细菌移位所致[3]。而肠道细菌移位的主要原因在于SAP后继发的SIRS引起的肠道黏膜屏障功能的破坏,因此如何对肠道黏膜屏障功能进行保护,预防肠道黏膜屏障损伤,减少肠道细菌移位是预防SAP进展为急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)及 MODS 的重要措施。 乌司他丁(ulinastatin,UTI) 是治疗SAP的常用药物,UTI治疗SAP的报道较多,其机制大多从对炎症反应的抑制方面阐述,对SAP患者肠道黏膜屏障功能的保护作用的研究尚缺,笔者对乌司他丁对重症急性胰腺炎患者肠道黏膜屏障功能的保护作用进行研究。
1 资料与方法
1.1 一般资料
选取2006年2月~2010年12月山东省千佛山医院ICU的57例重症急性胰腺炎症患者,将其随机分为治疗组(29例)和对照组(28例)。治疗组中,男16例,女13例;年龄35~75(58±12)岁,急性生理学和慢性健康状况评分(APACHEⅡ)(20±3)分;对照组中,男 16 例,女 12 例;年龄 35~75(60±13)岁,急性生理学和慢性健康状况评分(APACHEⅡ)(18±4)分。两组患者治疗前性别比例、年龄、APACHEⅡ评分差异无统计学意义(P>0.05),具有可比性。
1.2 诊断标准
重症胰腺炎诊断参照指定的标准[4],ARDS的诊断参照2006年中华医学会重症医学分会制订的诊断标准[5]。MODS的诊断参照2008年北京市科委重大项目 “MODS中西医结合诊治/降低病死率研究”课题组制订的标准[6]。
1.3 治疗方法
两组患者均常规给予禁食、禁水、胃肠减压、大量补充液体、纠正电解质紊乱、抗生素控制感染、抑制胰液分泌、解痉、止痛等治疗。治疗组在此基础上加用UTI 20万U溶于5%葡萄糖注射液50 ml静脉泵入,每日3次,2 h泵完,7 d后改为10万U,每日3次,总疗程为14 d。
1.4 检测方法
1.4.1 血浆D-乳酸测定 开始治疗前及治疗后第7、14天分别抽取静脉血2 ml,经去蛋白后,采用酶联紫外分光光度法检测D-乳酸测定[7]。
1.4.2 尿乳果糖/甘露醇(L/M)值测定 开始治疗前及治疗后第7天、14天早晨口服10 ml乳果糖/甘露醇溶液(乳果糖2 g、甘露醇1 g),收集6 h内全部尿液,取其中20 ml,加入0.2 mg硫柳贡防腐处理后在-20℃保存。采用高效液相色谱法分别检测尿果糖和甘露醇浓度[8]。
1.5 统计学方法
2 结果
2.1 两组治疗前后D-乳酸与尿L/M水平比较
治疗组治疗7 d及14 d后,较对照组D-乳酸水平差异均有高度统计学意义(P<0.01);治疗14 d后,治疗组较对照组尿L/M值水平差异有统计学意义(P<0.05),见表1。
表1 两组患者治疗前后D-乳酸与尿L/M值水平比较(±s)
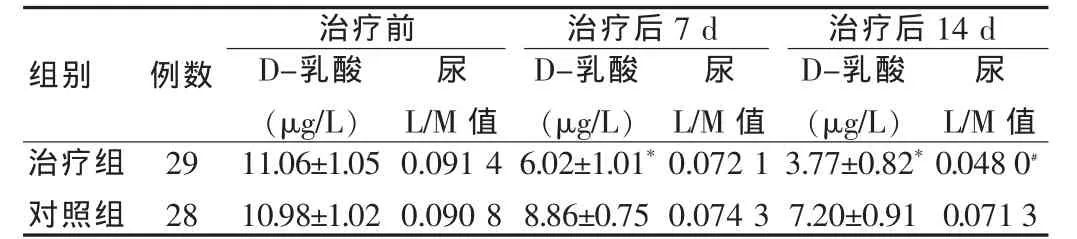
表1 两组患者治疗前后D-乳酸与尿L/M值水平比较(±s)
注:与对照组比较,*P<0.01,﹟P<0.05
治疗前D-乳酸(μg/L)尿尿治疗后7 d D-乳酸(μg/L)组别 例数29 28尿L/M值L/M值治疗后14 d D-乳酸(μg/L)L/M值治疗组对照组11.06±1.05 10.98±1.02 0.091 4 0.090 8 6.02±1.01*8.86±0.75 0.072 1 0.074 3 3.77±0.82*7.20±0.91 0.048 0﹟0.071 3
2.2 两组治疗前后ARDS/MODS发生率
治疗14 d后,治疗组ARDS发生率及MODS发生率较对照组均有所降低,两组比较差异有统计学意义(P<0.01或P<0.05)。 见表2。

表2 两组治疗前后ARDS/MODS发生率比较[n(%)]
2.3 两组病死率比较
治疗后28 d,治疗组28 d病死率为10.3%(3/29),较对照组32.1%(9/28)有明显降低,两组比较差异有统计学意义(P<0.05)。
3 讨论
在SAP发生发展中经常伴发着感染与SIRS即脓毒症(sepsis),脓毒症和脓毒症导致的脓毒性休克(septic shock)、ARDS、MODS是SAP致死的主要原因。而SIRS导致肠道屏障功能破坏,进一步导致肠道细菌/内毒素移位,是导致ARDS/MODS发生的主要病理机制。肠道屏障主要包括肠黏膜机械屏障、化学屏障、生物屏障和免疫屏障。严重损伤后的应激反应可造成肠黏膜屏障破坏、肠道菌群生态失调及机体免疫机能下降,从而发生肠道细菌移位/内毒素血症,触发机体过度的炎症反应与器官损害。因此,肠道是SIRS导致ARDS/MODS的发动机,肠道因素在脓毒症发生、发展中的作用不容忽视[9]。
D-乳酸只有在D-乳酸脱氢酶的催化下才能被代谢,哺乳动物体内只有L-乳酸脱氢酶,除肠道外机体各组织均不产生D-乳酸,所以血液中的D-乳酸几乎全都来源于肠道。当肠道黏膜受损时,由于肠道黏膜屏障功能被破坏,大量D-乳酸就会通过受损的肠黏膜进入血液中,因此,血液中D-乳酸水平的变化可以显示肠道黏膜屏障功能[7]。
采用尿L/M已经成为评价肠道黏膜屏障功能的重要指标。在正常情况下,尿中乳果糖和甘露醇含量极少,且不能被机体代谢,主要以原形从尿液排出。因此肠道黏膜的吸收量可以用来反映肠道黏膜的屏障功能。机械屏障是肠道黏膜屏障的结构基础[10],紧密连接是机械屏障的主要构成结构。乳果糖与甘露醇在肠道的吸收途径不一样:乳果糖是双糖,分子量大(342),主要通过小肠黏膜细胞间的紧密连接透过肠劲膜,这也是细菌及其毒素通过肠劲膜的途径,所以乳果糖的通透性可以反映肠黏膜的屏障功能;而甘露醇是单糖,分子量较小(182),主要通过肠黏膜细胞膜上的水溶性微孔透过肠黏膜[11]。在SIRS状况下肠黏膜萎缩,吸收面积减少,甘露醇通过的量会减少。同时,因肠黏膜细胞间的紧密连接受到破坏,乳果糖的通过量却会增加,这样就会导致尿中乳果糖与甘露醇排出量比值(L/M)的增加[12]。因此,尿中乳果糖/甘露醇比值在目前监测肠道黏膜屏障功能中最为常用[13-14]。
本研究发现,经UTI治疗后,患者肠道黏膜屏障功能改善,且肠道细菌/内毒素移位减轻,治疗后ARDS/MODS发生率、28 d病死率降低。UTI又名尿抑制素,是从健康成年男性新鲜尿液中提取分离的精制糖蛋白,由143个氨基酸组成,对胰蛋白酶、α-糜蛋白酶、透明质酸酶等有抑制作用,同时具有稳定溶酶体膜,抑制溶酶体酶的释放,清除氧自由基、抑制炎症介质的释放等作用[15]。SAP患者病情加重进展为ARDS/MODS,其主要病理机制为SIRS的发生,而SAP导致SIRS主要由于胰酶、溶酶体酶对周围组织的侵蚀导致激活机体过度的炎症反应。SIRS导致肠道黏膜受损,尤其是肠道黏膜屏障功能受损,肠道细菌/内毒素移位后导致的肠源性脓毒症的发生,进一步发展为ARDS甚至MODS。UTI抑制胰蛋白酶,稳定溶酶体膜,抑制了溶酶体酶的释放,清除氧自由基,抑制炎症介质的释放。降低了胰周组织的侵蚀,抑制了过度的炎症反应,降低了对肠道黏膜屏障的损害,从而降低了ARDS、MODS的发生率,降低了28 d病死率。Meakins和Marshall在1986年提出的肠道是机体最大的细菌/毒素库,肠道是MODS发生发展的动力器官[16],本研究也证明了两者提出的“肠道动力学说”。
[1]张太平,赵玉沛,王莉.第七届全国胰腺外科学术会议纪要[J].中华普通外科杂志,1999,14(2):139.
[2]曹镇洋.重症急性胰腺炎发病机理的现代进展[J].吉林医学,2005,26(2):206-208.
[3]Buggy BP,Nastrant TT.Lethal pancreatitis[J].Am J Gastroenterol,1983,78:810-4.
[4]中华医学会消化病学分会胰腺疾病学组.中国急性胰腺炎诊治指南(草案)[J].中华消化杂志,2004,24(3):190-192.
[5]马晓春,王辰,方强,等.急性肺损伤/急性呼吸窘迫综合征诊断和治疗指南(2006)[J].中国危重病急救医学,2006,18(12):706-710.
[6]北京市科委重大项目“MODS中西医结合诊治/降低病死率研究”课题组.多器官功能障碍综合征诊断标准、病情严重度评分及预后评估系统和中西医结合证型诊断[J].中国危重病急救医学,2008,20(1):1-3.
[7]Smith SM,Eng RHK,Buccini F.Use of D-lactic acid measurement in the diagnosis bacterial infections[J].J Infect Dis,1986,154(4):658-664.
[8]Miki K,Butler R,Moore D,et al.Rapid and simultaneous quantification of rhamnose,mannitol,and lactulose in urine by HPLC for estimating intestinal permeability in pediatric practice[J].Clin Chem,1996,42(1):71-75.
[9]姚咏明,盛志勇.脓毒症防治学[M].北京:科学献出版社,2008:4.
[10]Unno N,Fink MP.Intestinal epithelial hyperpermeability,Mechanisms and relevance to disease[J].Gastroenterol Clin North Am,1998,27(2):289-307.
[11]Jiang ZM,Cao JD,Zhu XG,et al.The impact of alanyk-gluyamine on clinical safety,nitrogen balance,intestinal permeability,and clinical outcome in postoperative patients:a randomized,double blind,controlled study of 120 patients[J].JPEN,1999,23(5):S62-65.
[12]蒋朱明,于康.肠黏膜屏障损害与肠外和肠内营养[J].外科理论与实践,2000,5(1):54-58.
[13]Bjarnason I,MacPherson A,Hollander D.Intestinal permeability:an overview[J].Gastroenterology,1995,108(5):1566-1581.
[14]Juvonen PO,Alkava EM,Jakala JA.Gut permeability in patients with acute pancreatitis[J].Scand J Gastroenterol,2000,12:1314-1318.
[15]Koizumi R,Kanai H,Maezawa A,et al.Therapeutic effects of ulinastatin on experimental crescentic glomerlonephritis in rats[J].Nephron,2000,84(4):347.
[16]Carrico CJ,Meakins JL,Marshall JC,et al.Multiple-organ-failure syndrome[J].Arch Surg,1986,121(2):196-208.



