张 萌,费洪新,丁晨羲,韩婷婷
齐齐哈尔医学院组织学与胚胎学教研室,黑龙江齐齐哈尔 161000
紫杉醇(paclitaxel,PA)是重要的抗肿瘤药物,对晚期乳腺癌、鼻咽癌、肺癌、淋巴瘤等均有一定疗效,为周期特异性的药物,被认为是一种广谱抗癌药物。PA是最好的天然抗癌药物之一,其药理作用独特。PA是四环二萜类生物碱,分子式为C47H51O14N,具有高度亲脂性,不溶于水,但能溶于甲醇、乙醇、乙醚等有机溶剂,血浆蛋白结合率为95%等特性[1-2]。在体外建立多药耐药细胞系是研究肿瘤产生多药耐药性的重要方法。目前国内外尚缺乏人胃癌MGC803/PA的理想的细胞模型,实验采用逐渐增加药物PA浓度,建成人胃癌MGC803/PA耐药细胞系,研究耐药过程中细胞株的变化,建立理想的耐药细胞模型。
1 材料与方法
1.1 药品和试剂
MTT上海华舜生物工程有限公司;紫杉醇(PA)Gibcoq/BRL公司(USA)提供;长春新碱(VCR)上海华联药业有限公司生产;5-氟尿嘧啶(5-FU)上海旭东海普药业有限公司;丝裂霉素(MMC);阿霉素(ADM )澳大利亚F.H.Faulding公司生产;RPMI-1640由F.H.Faulding公司提供。
1.2 细胞培养
人MGC803为人胃癌细胞系,哈尔滨医科大学黄小义博士提供。购买人胃癌MGC803细胞,细胞培养在经过0.22 μm滤膜过滤的RPMI-1640培养液中,在无菌温箱进行培养,用PBS配制的0.15%的胰蛋白酶消化细胞传代,每周传代2次,收集生长旺盛的肿瘤MGC803细胞用于实验研究。
1.3 耐药细胞系的建立
选取生长旺盛的细胞MGC803细胞培养在培养液中,从0.05 μg/ml作用浓度开始,2 d后弃去培养液,加入新鲜的培养液,继续培养MGC803细胞,MGC803细胞恢复正常生长在消化传代MGC803细胞后继续用0.05 μg/ml的药物浓度处理MGC803细胞2 d,继续反复换液处理、传代逐步提高PA浓度诱导MGC803细胞,最后获得一株能耐受0.5 μg/ml的MGC803细胞株,拟命名为MGC803/PA,并且将MGC803培养在含有0.1 μg/ml的完全培养液中进行培养,还要经常冻存细胞,观察细胞冻存后的复苏状况。
1.4 MGC803细胞的生长抑制结果
选取对数生长期的MGC803细胞,接种于培养板中,每孔200 μl,一种细胞设3个复孔,培养箱内培养。每天取一块培养板,弃培养液,加入无血清培养液180 μl,每孔加入MTT(5 g/L)20 μl,继续培养 4 h,终止培养,弃培养液,加入 DMSO液体150 μl,振荡,用全自动酶标仪测定570 nm光吸收值,以空白Control孔调零,以时间为横坐标,细胞抑制率为纵坐标,分别测定不同浓度的PA对MGC803细胞分别在不同时间的生长抑制率,绘制细胞生长抑制曲线。
1.5 MTT法测定药物的毒副作用
选用培养板内加入MGC803细胞混合液,每孔加入200 μl,加入倍比稀释成5种浓度的各种抗癌药物20 μl,对照组加入等体积的生理盐水,设立空白对照组,放置于孵箱中培养68 h后弃液,每孔中加入不完全培养液180 μl及其5 g/L的MTT 25 μl,继续培养 4 h 后小心弃液,每孔 DMSO 150 μl,置于微量振荡器上振荡5 min,用全自动酶标仪测定570 nm光吸收值,以空白Contro1孔调零。计算细胞生长抑制率和耐药指数。
1.6 细胞形态学观察
1.6.1 光学显微镜观察 将MGC803细胞混合液接种于培养板,置于孵箱内培养3 d后用PBS洗涤3次,HE及其瑞氏染液染色15 min,再用PBS洗涤2次,常温干燥,镜下观察。1.6.2电子显微镜观察 选用MGC803细胞消化后的混合液,收集细胞,用戊二醛固定,四氧化锇固定,脱水、包埋、切片和染色,按常规处理,透射电镜镜下观察。
2 结果
2.1 MTT法检测MGC803细胞
MGC803/PA细胞对PA的2、3、4个月耐药指数分别是5.12、11.46、15.98,并且对另外几种抗癌药物也有一定程度的耐药现象(表1~4)。观察半数抑制浓度(IC50)的改变,细胞耐药指数(RI)的改变。
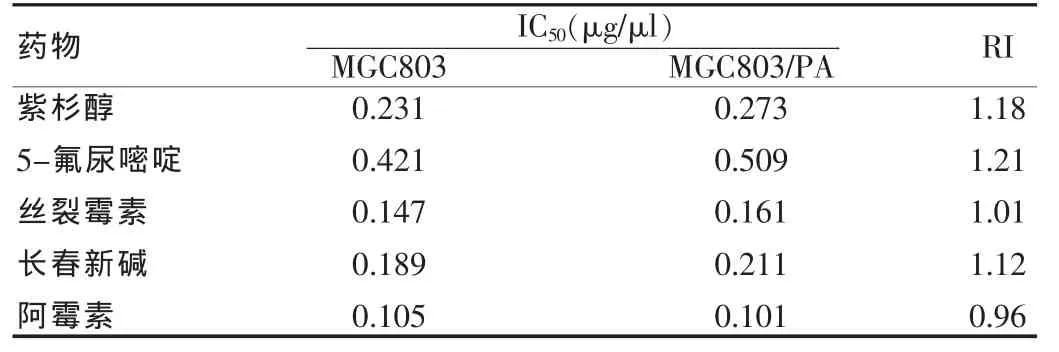
表1 对照组MGC803药物敏感性的观察
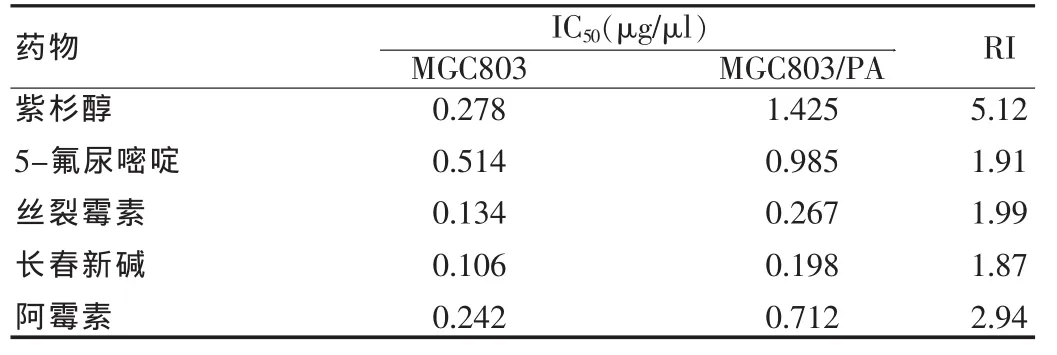
表2 MGC803细胞药物处理2个月药物敏感性的观察
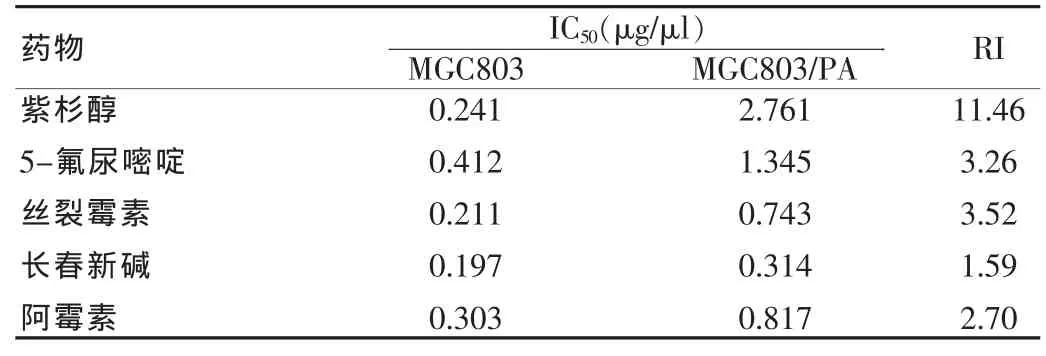
表3 MGC803细胞药物处理3个月药物敏感性的观察
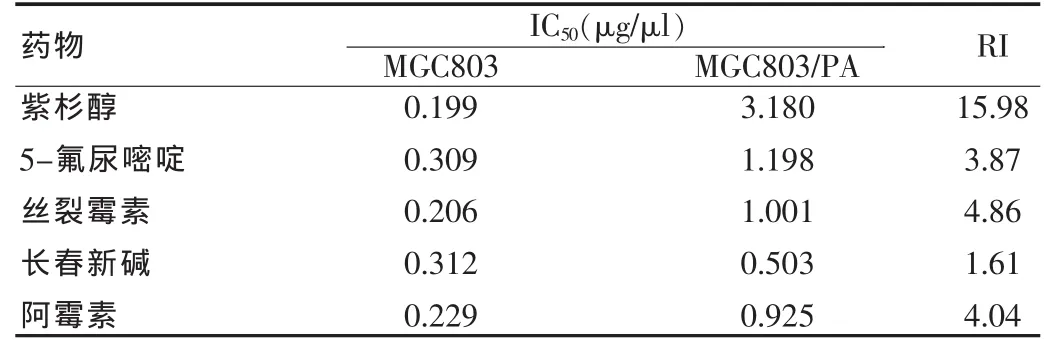
表4 MGC803细胞药物处理4个月药物敏感性的观察
2.2 细胞光镜及电镜下观察
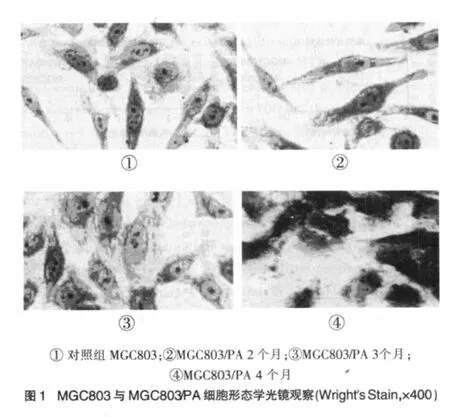
2.2.1 细胞光镜下观察 MGC803细胞与MGC803/PA细胞均呈均匀排列,细胞形态不规则,多边形;MGC803细胞边界清楚,细胞核较大,核仁明显,细胞核有凹陷。MGC803/PA细胞随着PA药物剂量的增加,药物作用时间的延长,处理4个月时出现MGC803/PA细胞的细胞边界不清楚,细胞体积略微增大,细胞核不规则,有时出现较大的凹陷或者巨细胞,见图1。
2.2.2 细胞电子显微镜观察 紫杉醇加入药物2个月后MGC803与MGC803/PA线粒体数目没有差别,紫杉醇加入3个月后MGC803与MGC803/PA糖原减少,紫杉醇加入药物4个月后MGC803与MGC803/PA线粒体数目减少,可见到假性包涵体(图2)。
2.3 细胞生长和群体倍增时间
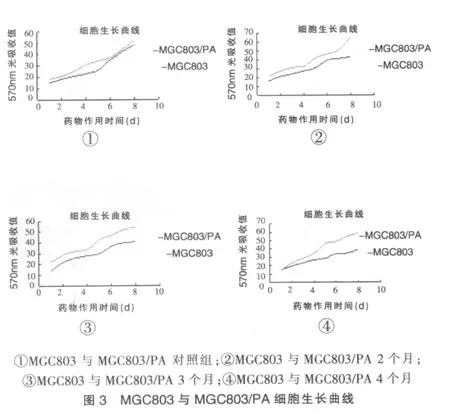
人肿瘤胃癌MGC803细胞株与MGC803/PA细胞株的生长周期不同,群体倍增时间分别为2个月为34.70、41.31 h;3个月为 26.42、51.23 h;4 个月为 27.34、55.92 h;耐药细胞较亲代细胞在相同的时间条件下分别延长了6.61、24.81、28.58 h,可以发现细胞的群体倍增时间是逐渐延长的(图3)。

3 讨论
目前国内外建立肿瘤耐药细胞系的方法通常是药物浓度递增持续法和大剂量间歇诱导法。肿瘤多药耐药产生是与肿瘤细胞表面过剩表达一种P-糖蛋白有关,分子量为1.7×105。P-糖蛋白具有将抗肿瘤的药物泵出细胞,细胞内的药物浓度降低,从而减少药物对细胞内细胞器的损伤,同时研究表明多药耐药基因相关蛋白与肿瘤多药耐药也密切相关[3-5]。引起耐药机制可能是P-糖蛋白和药耐药基因相关蛋白的作用底物不同所造成。
应用逐渐增加抗肿瘤药物PA的浓度,诱导MGC803细胞耐药,经过4个月建成人胃癌MGC803耐药细胞系,并且命名为MGC803/PA。光镜下观察MGC803/PA细胞与其MGC803细胞存在较大形态差异,MGC803/PA细胞边界不清楚,细胞体积略微增大,细胞核不规则,有时出现较大的凹陷或者巨细胞。MGC803/PA巨细胞的出现提示细胞受到损伤、细胞分裂减少。在电子显微镜下观察下,可以见到MGC803/PA细胞核大、细胞核畸形、细胞质内有假性包涵体、微绒毛较多,可见细胞核分裂的现象,这些均表明MGC803/PA细胞生长代谢缓慢、分裂活动减弱等。人胃癌MGC803/PA细胞通过研究细胞生长曲线测定群体倍增时间发现2、3、4个月MGC803/PA细胞较MGC803细胞延长的时间分别为6.61、24.81、28.58 h,提示人胃癌MGC803/PA细胞对化疗的敏感性就下降,疗效相对较差,治疗上就必须加大药物的剂量。
体外建立的耐药细胞对PA的相对耐受度较亲代细胞2、3、4 个月分别提高的指数是 5.12、11.46、15.98。 表明MGC803 细胞耐药是逐渐形成的,一般是PA持续作用MGC803细胞3个月就可以把MGC803细胞耐药了,同时使细胞总是处于一个较大的剂量的药物环境中,同时还要经常复苏细胞,耐药性能方可以稳定下来。MGC803/PA细胞表现出较为稳定的耐药性,MGC803/PA细胞冻存后复苏后状态良好。MGC803/PA细胞系不仅对PA产生耐药,而且对从未接触的ADM等多种抗癌药物也产生不同程度的耐药性,说明MGC803/PA细胞系耐药性能相对稳定,是筛选逆转剂建立理想的耐药细胞模型。
综上所述,MGC803/PA细胞具有耐药表型,且耐药性能稳定,MGC803/PA的增殖能力逐渐下降,MTT法及其电镜可以较早地提示MGC803/PA的耐药特征。实验中细胞生长曲线、MTT、电子显微镜等检测方法是逐渐改变MGC803细胞,MTT法和电子显微镜与其他的检测相比较好,但成本较高。因此,建立MGC803耐药细胞系的过程中,MTT法是首选的检测方法,后续的工作中尚需要进行流式细胞仪及其蛋白质印记进行检测此耐药细胞株的稳定性。
[1]Takeyoshi I,Makita F,Tanahashi Y,et al.A phaseⅡstudy of weekly Paclitaxel and Doxifluridine combination chemotherapy for advanced/recurrent gastric cancer[J].Anticancer Res,2011,31(1):287-291.
[2]Yagi Y,Fushida S,Harada S,et al.Effects of valproic acid on the cell cycle and apoptosis through acetylation of histone and tubulin in a scirrhous gastric cancer cell line[J].J Exp Clin Cancer Res,2010,29:149-150.
[3]Han J,Tan BB,Geng W,et al.Correlation of expression of P-glycoprotein and inhibitor of apoptosis proteins to chemosensitivity in gastrointestinal carcinoma tissues[J].Ai Zheng,2008,27(11):1166-1171.
[4]Kruijtzer CM,Boot H,Beijnen JH,et al.Weekly oral paclitaxel as firstline treatment in patients with advanced gastric cancer[J].Ann Oncol,2003,14(2):197-204.
[5] Yim H,Na K.Polycationic nanodrug covered with hyaluronic acid for treatmentof P-glycoprotein overexpressing cancercells[J].Biomacromolec ules,2010,11(9):2387-2393.



