陈淑圻,李悦山
广州医学院药理教研室,广东广州 510182
他汀类药自20世纪70年代问世以来,在降脂治疗中起了重大的作用。至今市场已出现8种他汀类药物,分别是洛伐他汀、辛伐他汀、普伐他汀、氟伐他汀、阿托伐他汀、罗苏伐他汀、匹伐他汀和2001年退市的西立伐他汀[1]。洛伐他汀因能显着降低胆固醇和低密度脂蛋白胆固醇水平,具有良好的降血脂作用而较广泛地被用于临床。
有相关报道[2-4]显示,目前洛伐他汀在临床应用的主要剂型有:普通片剂、胶囊剂、颗粒剂,缓释片、分散片和滴丸。由于洛伐他汀难溶于水,其普通片剂服药次数多,服用不方便,血药浓度起伏大,生物利用度低,不利于临床用药的安全性[5]。为了提高药物的生物利用度,减少不良反应的发生率,并解决普通缓释片不易分割的问题,研制洛伐他汀微丸型片剂具有重要的意义。本文进行了洛伐他汀缓释微丸型片剂新剂型的处方前研究,为进一步研究工作打下基础。
1 仪器与材料
1.1 仪器
KQ-400型超声波清洗器 (昆山市超声仪器有限公司),高效液相色谱仪(Agilent 1200),电子天平(BA110S,Sartorius),Hp-8452A型紫外-可见分光光度计(HEWLETT PACKARD),PHS-25型pH计(上海精密科学仪器有限公司雷磁仪器厂),电热恒温水浴锅(上海医疗器械五厂),THZ-82水浴恒温振荡器 (江苏省金坛市宏华仪器厂),SZ-93自动双重纯水蒸馏器(上海亚荣生化仪器厂)。
1.2 材料
洛伐他汀(陕西森弗生物技术有限公司),磷酸二氢钾、十二烷基硫酸钠、盐酸、磷酸二氢钙、正辛醇、磷酸、乙醇(分析纯,广州化学试剂厂),甲醇、乙腈(色谱纯,依能色谱有限公司),微晶纤维素 PH101、HPMC E5(湖州展望药业有限公司),羧甲基淀粉钠(法国罗盖特),Eudragit NE 30D(德国罗姆公司),滑石粉Talc(1 000目)(中美合资广西龙胜华美滑石开发有限公司),磷酸二氢钙(分析纯,广州化学试剂厂),硬脂酸(上海倍特化工有限公司),硬脂酸镁、乳糖(上海运宏化工制剂辅料技术有限公司)。
2 方法与结果
2.1 洛伐他汀溶解度的测定
2.1.1 吸收波长的选择
洛伐他汀为水难溶性药物,根据文献报道[6],其在甲醇、十二烷基硫酸钠(SDS)等溶液中有一定的溶解度。分别测定洛伐他汀在0.1 mol/L HCl、水、甲醇、乙醇、0.5%SDS和pH=6.8磷酸盐缓冲液(内含0.5%SDS,下同)溶液中的溶解度。以相应溶剂作为空白对照,在200~400 nm波长范围内进行紫外扫描,测定最大吸收波长。由扫描结果可知,洛伐他汀在上述介质中的最大吸收波长均为238 nm。
2.1.2 测定洛伐他汀在不同介质中的溶解度
称取六份适量的洛伐他汀,分别置于25 ml具塞锥形瓶中,分别加入 0.1 mol/L HCl、水、甲醇、乙醇、0.5%SDS和 pH=6.8磷酸盐缓冲液各20 ml,将锥形瓶置于恒温振荡器中振荡,温度为(37±1)℃,100 r/min 振荡 24 h 后取样,用 0.45 μm的微孔滤膜过滤,弃去初滤液,取续滤液经适当稀释后,按紫外分光光度法分别在238 nm处测定吸收度,计算药物在各种介质中的溶解度,见表1。

表1 洛伐他汀在不同介质中的溶解度[(37±1)℃]
2.2 油水分配系数的测定
用不同pH的缓冲液配制适宜浓度的洛伐他汀溶液,取该溶液10 ml与正辛醇10 ml混合,置于锥形瓶中。(25±1)℃,100 r/min恒温振荡24 h,离心分离两相,取水相经适当稀释后,按紫外分光光度法分别在238 nm处测定吸收度,计算平衡前后水相中的药物浓度,计算表观油水分配系数。绘制洛伐他汀表观油水分配系数与溶出介质pH的关系图。见图1。
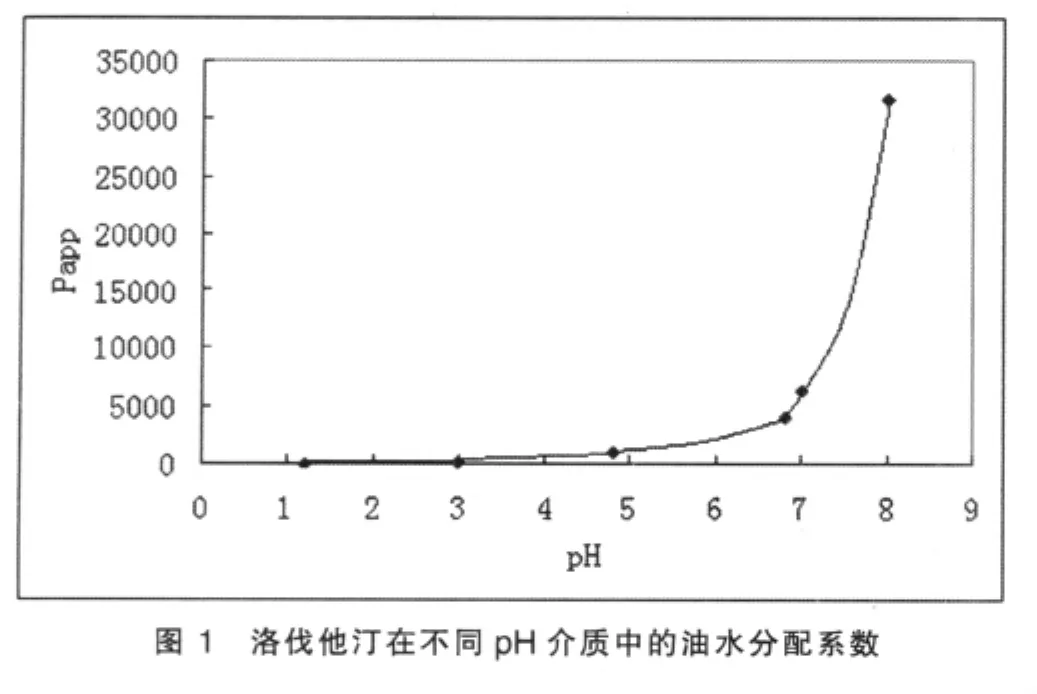
由结果可知,当pH在1.0~6.8之间时,洛伐他汀的Papp值较小;当pH>7.0时,Papp值随着pH增大而急剧上升,表明药物随着pH的增大水溶性逐步降低,在碱性环境下,亲脂性大大增强。
2.3 体外分析方法的建立
2.3.1 含量测定方法
2.3.1.1 色谱条件 参考《美国药典》(30版)中洛伐他汀片含量测定的方法,具体色谱条件为:①缓冲液:取3.45 g磷酸二氢钠溶于900ml水中,加磷酸调pH值至4.0,加水稀释至1000ml。②流动相:乙腈∶缓冲液∶甲醇=5∶3∶1。③柱温:45℃。④色谱柱:C18柱[7],柱型号为 Dionexacclaim120C18(4.6mm×150mm,5 μm)。⑤测定波长:238 nm。 ⑥流速:1 ml/min。 ⑦进样量:10 μl。 制备每1 ml中约含洛伐他汀10 μg的溶液,作为对照品溶液;取样品按通用方法制备供试品溶液;取辅料按同样方法制备空白辅料溶液。将上述样品分别进样,结果表明洛伐他汀甲醇溶液在波长为238 nm时,出峰时间为10 min左右,且所用辅料在保留时间处无干扰。
2.3.1.2 标准曲线 精密称取洛伐他汀对照品20 mg置于100 ml容量瓶中,加入适量甲醇,超声溶解,加甲醇定容至刻度。精密移取对照品母液 0.1、0.4、0.8、1.6、3.2 ml置于 10 ml容量瓶中,加甲醇定容至刻度,摇匀即得。分别按“2.3.1.1”色谱条件操作,记录色谱图。以浓度(C)为横坐标,以峰面积(A)为纵坐标,进行线性回归,得到线性方程为:A=29 567C+9 095.7(r=0.999 9)。 结果,洛伐他汀在 1.98~63.52 μg/ml范围内线性关系良好。
2.3.1.3 回收率 精密称取洛伐他汀及模拟缓释微丸片处方比例的适量辅料,加入甲醇配制成10、30、60 μg/ml的样品溶液各3份。高效液相色谱法测定其峰面积,根据标准曲线计算含量,以测得量与加入量比较,计算回收率。由表2的数据可以看出,各浓度回收率均接近100%,平均RSD均小于2%,说明该方法准确度良好。
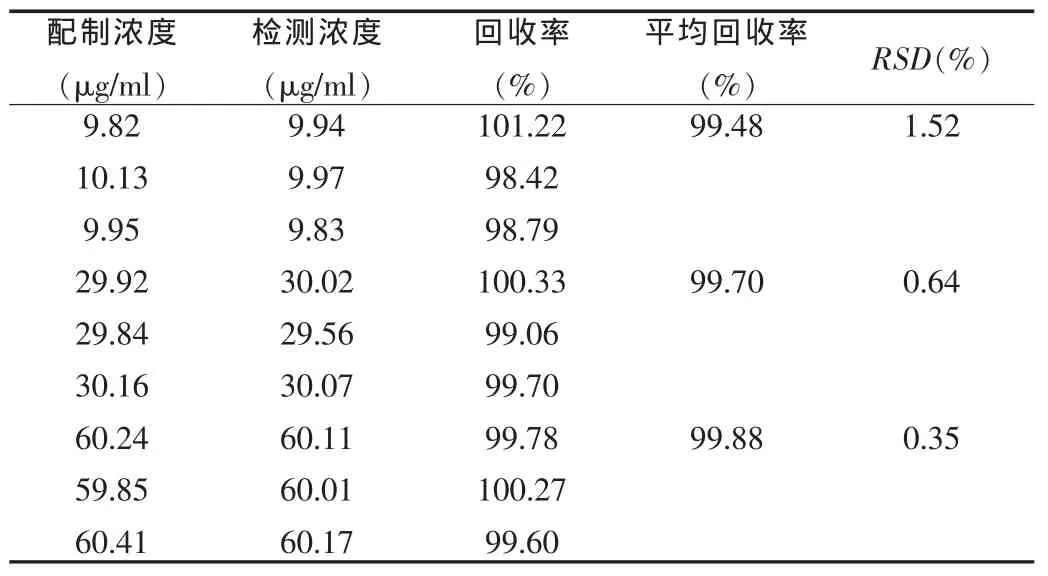
表2 洛伐他汀含量回收率
2.3.1.4 样品溶液稳定性试验 将上述绘制标准曲线的第3号溶液(15.88 μg/ml),避光放置 12 h,分别于 0、3、6、9、12 h 测定峰面积,本品在12 h内稳定。RSD为0.04%。
2.3.1.5 精密度测定 称取洛伐他汀适量,分别配制浓度为10、30、60 μg/ml的样品甲醇溶液,按高效液相测定法测定,每个样品平行测3次,记录色谱图,测定结果见表3。
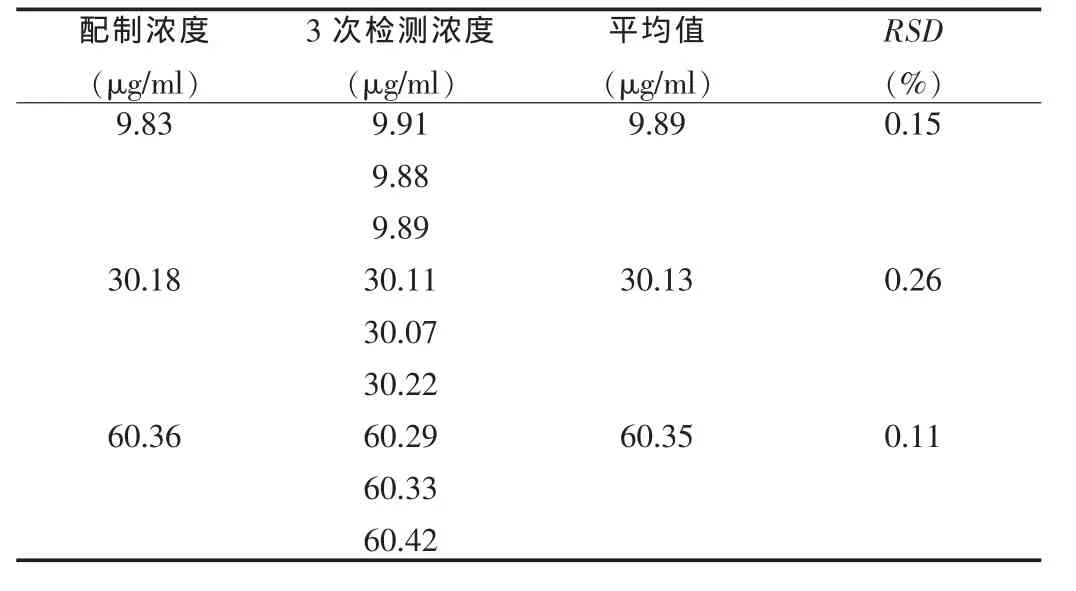
表3 洛伐他汀含量精密度
2.3.1.6含量测定方法 取缓释微丸片10片,精密称定,研细。精密称取细粉适量(约相当于洛伐他汀40 mg),置于50 ml容量瓶中,加适量甲醇,超声15 min,放冷后加甲醇稀释至刻度。摇匀,滤过,弃去初滤液,精密量取续滤液1 ml至10 ml容量瓶中,加甲醇稀释至刻度,0.45 μm微孔滤膜滤过,作为供试品溶液。用上述的高效液相方法测定溶液在238 nm波长的峰面积,与对照品的峰面积对照,按外标一点法计算样品含量。
2.3.2 释放度测定方法
根据洛伐他汀的溶解特性,本缓释片制成12 h缓释释药较合适,按照《中国药典》(2005年版)缓控释制剂指导原则,累计百分释放度应满足:2 h约30%、6 h约50%、12 h>80%。
2.3.2.1 释放介质的选择 按照《中国药典》(2005年版)附录XIX D缓控释制剂指导原则,释放介质以去空气的新鲜纯水为最佳,或根据药物的溶解特性、处方要求、吸收部位,使用稀盐酸(0.001~0.1 mol/L)或 pH 为 3~8的磷酸盐缓冲液,对难溶性药物不宜采用有机溶剂,可加少量表面活性剂(如十二烷基硫酸钠等)。由“2.1.2”项下测定结果可知,洛伐他汀在水中溶解度极小,只有0.7 μg/ml左右,以水为释放介质达不到漏槽条件,而用人工胃液(0.1 mol/L HCl)和人工肠液(pH=6.8磷酸盐缓冲液)作释放介质可达到漏槽条件。
2.3.2.2 释放度测定方法 参照《中国药典》(2005年版)二部附录溶出度测定第一法转篮法装置,释放前2 h以0.1 mol/L HCl模拟人工胃液为释放介质900 ml,2 h之后以pH=6.8磷酸盐缓冲液900 ml为释放介质,转速100 r/min,温度(37.0±0.5)℃,依法操作,定时取样5 ml(同时补加等量同温释放介质),过0.45 μm微孔滤膜,取续滤液进高效液相,测定溶液峰面积,计算药物不同时间点的累积释放率。
2.3.2.3 释放度数据分析方法 体外释放度试验是筛选缓控释制剂处方和控制其质量的重要手段。国外学者在比较两种制剂的释放度曲线时,常带入适宜的数学模型加以评价。f2方程[8-9]为美国FDA推荐,用以比较两条释放曲线等价性的方法[10],该方法的优点在于可直接对释药数据进行统计分析,无需拟合各种释药速率。其公式为:
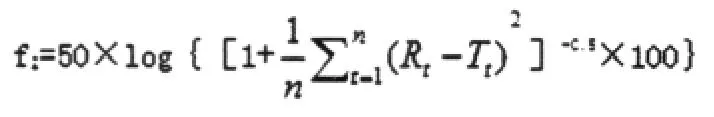
Rt为参比样品t时释放度;Tt为试验样品t时释放度。完全相同的两条释放曲线,其f2=100;释放差异增大,f2值减小;f2>50,均认为有相同的释放行为。
3 讨论
3.1 药物的溶解度
药物的溶解度直接影响药物的吸收与药物在体内的生物利用度,是制备药物制剂首先应掌握的信息。通过测定药物溶解度,表明洛伐他汀在水中不溶,在甲醇、乙醇中有较好的溶解性,加入表面活性剂十二烷基硫酸钠可增加药物的水溶性,药物在0.1 mol/L HCl溶液和pH=6.8的磷酸缓冲液中有一定的溶解性,用作释放介质均能达到漏槽条件。
3.2 药物的油水分配系数
药物要进入体内,必须要穿过细胞的生物膜。由于细胞膜具有脂质和蛋白质,因此药物的亲脂性程度与药物的油/水分配系数有关。油水分配系数试验表明洛伐他汀在pH为1.0~6.8的介质中表观油水分配系数较小,但当pH>7时表观油水分配系数急剧增大,表观油水分配系数过大将使药物蓄积于生物膜,难以进入体循环,所以将洛伐他汀制备成12 h释药较宜。
3.3 含量测定方法
本文采用高效液相色谱法测定样品含量,流动相参考《美国药典》(30 版)使用乙腈∶磷酸缓冲液∶甲醇=5∶3∶1,柱温45℃,经试验药物于10 min左右出峰。经方法学验证,线性范围良好,回收率好,日内精密度平均RSD<2%,方法准确可靠。
3.4 释放度测定方法
由于释放介质不宜用有机溶剂,从溶解度试验可知,药物在0.1 mol/L HCl溶液和pH=6.8的磷酸缓冲液中有一定的溶解度,作为释放介质可达到漏槽条件,且药物在介质中稳定。释放度数据分析方法采用美国FDA推荐的f2方程进行评价。
[1]叶红梅,熊学文.他汀类药物临床研究进展[J].中国药师,2009,12(2):176-179.
[2]陆裕德,苏博,白菊民.洛伐他汀缓释片的制备及体内外评价[J].中国医药工业杂志.2006,37(5):329-331.
[3]王伟,陈文展.洛伐他汀分散片及其制备方法[P].中国专利:101444493,2009-06-03.
[4]李永强,郑永锋.一种含洛伐他汀的滴丸及其制备方法[P].中国专利:101194893,2008-06-11.
[5]Langtry HD,Spencer CM.Lovasattin coat-Core a review of pharmacodynamic and pharmacokinetic properties and clinical efficacy[J].Drugs,1997,53(5):867-884.
[6]丙耀诚.现代药物学[M].北京:人民军医出版社,1999:165.
[7]高燕霞,姜建国,张西如.HPLC法测定洛伐他汀胶囊的溶出度[J].中国抗生素杂志,2009,34(11):678-681.
[8]Moore JW,Flanner HH.Mathematical comparison of dissolution profiles[J].Pharm Tech,1996,6:64-74.
[9]Peh KK,Wong CF.Application of similarity factor in development of controlled-release diltiazem tablet[J].Drug Dev and Ind Pharm,2000,26(7):723-730.
[10]宗莉,王柏,张宁.双氯酚酸钾缓释片的研制及释药特性的探讨[J].中国药科大学学报,2001,32(3):206-209.



