王 嘉 覃尚珠 曾常茜 李 坤 丁 宁▲
1.大连医科大学附属第一医院普外科,辽宁大连 116011;2.大连大学医学院生物化学教研室,辽宁大连 116600
癫痫是常见的脑部慢性疾病,以大脑神经元突发 性异常放电导致的短暂大脑功能障碍为特征。在我国有20%~25%的癫痫患者常规药物治疗得不到有效控制,成为社会家庭的沉重负担。 雷公藤内酯是近来神经退行性疾病临床治疗研究的热点药物之一,对老年性痴呆(Alzheimer's disease,AD)、帕金森病(Parkinson diease,PD) 和多发性硬化症 (multiple sclerosis,MS)等具有神经保护作用[1]。雷公藤内酯对于癫痫的治疗研究也取得了一定的进展[2-3]。目前在哺乳动物体内已发现13 种水通道蛋白(AQPs),其中水通道蛋白4(AQP4)在中枢神经系统内广泛分布,与癫痫发病的电生理学机制、癫痫持续状态及难治性癫痫脑损伤等机制密切相关[4]。 本实验观察了雷公藤内酯对海人酸致痫大鼠脑海马AQP4 蛋白表达的影响,为雷公藤内酯应用于临床治疗提供实验依据。
1 材料与方法
1.1 材料
10 周龄SD 雄性大鼠30 只,体重(230±10)g,由大连医科大学实验动物中心提供。免抗AQP4 多克隆抗体购自Santa Cruz Technology 公司;HRP 标记的山羊抗兔IgG 抗体购自北京中杉金桥公司;RIPA 蛋白裂解液购自南京凯基生物科技发展有限公司;BCA 蛋白定量及ECL 发光试剂盒购自碧云天生物公司;Trizol及RT-PCR 试剂盒购自大连宝生物公司;雷公藤内酯购自北京优尼康公司;海人酸购自Sigma 公司。
1.2 方法
1.2.1 动物分组及药物注射 SD 大鼠分成三组:对照组、海人酸组、雷公藤内酯干预组,各10 只。称取记录大鼠重量后,海人酸组颈内皮下注射海人酸,剂量为10 mg/kg;雷公藤内酯干预组在海人酸注射前连续7 d腹腔内注射雷公藤内酯,剂量为30 μg/kg;对照组注射等量的生理盐水。 造模后观察动物的行为变化。
1.2.2 海马组织取材及保存 致痫后第1 天取脑海马组织,10%水合氯醛(350 mg/kg)皮下深麻醉后,在冰冷磷酸盐缓冲液(PBS)中取出全脑,由矢状线切开,去除小脑及间脑,沿穹隆分离侧脑室,去除外侧壁的脑组织,将海马从剩余脑组织上剥离,包于干净锡纸中,标记后快速投入液氮中浸透,各组标本收集齐后从液氮转到-70℃低温冰箱冻存。
1.2.3 Western blot 法检测AQP4 蛋白表达 取材方法同“1.2.2”项下,准备好冰盒将海马组织从液氮中取出剪碎后放于预冷匀浆器中,匀浆的同时加入RIPA 蛋白裂解液(含PMSF100 μmol/L),然后12 000 r/min 离心15 min 除沉淀,BCA 蛋白定量后分装冻存。各泳道取60 μg 样品上样后进行SDS-PAGE 电泳,转膜。5%BSA 中4℃过夜封闭后用一抗(免抗AQP4 多克隆抗体1∶400,兔抗GAPDH 单抗1∶400)孵育2.5 h。 而后TBST 清洗3 次,每次10 min。继之以HRP 标记的二抗(山羊抗兔IgG 抗体1∶1000 稀释)37℃孵育1 h 后TBST 清洗5 次,每次10 min。 最后于暗室ECL 发光经显影、定影后检测目的条带。胶片扫描后用Quantity One 软件分析灰度值。
1.2.4 RT-PCR 法检测AQP4 基因表达 取材方法同“1.2.2”项下,将海马组织从液氮中取出剪碎后放于预冷匀浆器中,加入1 mL Trizol 匀浆至肉眼看不见组织颗粒,转移至1.5 mL EP 管中,加200 μL 氯仿/异戊醇(24∶1)剧烈振荡,混匀30 s,4℃12 000 r/min 离心5 min,取上清300~400 μL 加等体积异丙醇,冰上放置5 min 后4℃12 000 r/min 离心10 min,弃上清。 沉淀加75%乙醇1 mL,12 000 r/min 离心5 min, 弃上清,沉淀干燥。加20 μL DEPC 水溶解。紫外分光光度计测A260和A280并计算浓度。 将1 μg 总RNA 用反转录试剂盒反转成cDNA,反应条件为42℃30 min,99℃5 min,5℃5 min;1 个循环后用AQP4 上游引物5′-GTCCTCATCTCCCTTTGCTTT-3′,下游引物5′-GACTCCCAATCCTCCAACCAC-3′。管家基因GAPDH上游引物5′-TCCCACTCTTCCACCTTC-3′,下游引物5′-CTGTAGCCGTATTCATTGTC-3′分别进行特异性扩增,反应条件优化为94℃2 min,1 个循环;94 ℃30 s,54℃30 s,72℃30 s,30 个循环;72℃10 min,1 个循环。反应结束后取10 μL 产物琼脂糖电泳检测表达量的变化。 凝胶成像仪照相并用Quantity One 软件分析测定灰度值。
1.3 统计学方法
采用SSPS 11.5 统计学软件进行数据分析,计量资料数据用均数±标准差(±s)表示,多组间比较采用单因素方差分析, 组间两两比较采用LSD-t 检验,以P < 0.05 为差异有统计学意义。
2 结果
2.1 各组动物海马区AQP4 蛋白表达水平变化
Western blot 结果显示,海人酸组与对照组AQP4条带与GAPDH 条带的灰度值比分别为0.872±0.141和0.453±0.078,海人酸组AQP4 表达显着增多(P <0.05);雷公藤内酯干预组中海马AQP4 蛋白相对灰度值比为0.647±0.185,较对照组增多(P < 0.05),较海人酸组AQP4 表达显着减少(P < 0.05)。 见图1。
2.2 各组动物海马区AQP4 mRNA 表达水平变化
RT-PCR 结果显示,海人酸组与对照组AQP4 条带与GAPDH 条带的灰度值比分别为1.212±0.115 和0.843±0.091,海人酸组AQP4 mRNA 表达与对照组比较显着增加(P<0.05);雷公藤内酯干预组AQP4 mRNA相对灰度值比为1.105±0.192,与对照组相比,表达显着增加(P < 0.05),与海人酸组相比,AQP4 mRNA 表达水平显着减少(P < 0.05)。 见图2。
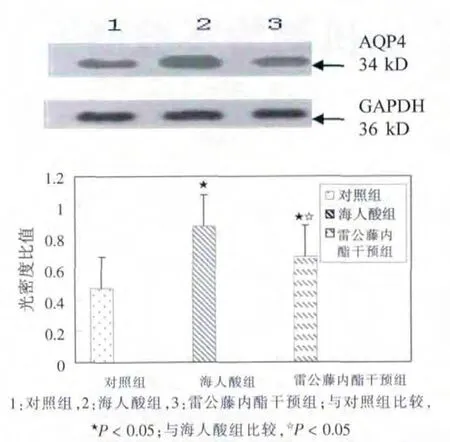
图1 雷公藤内酯对大鼠海马区水通道蛋白4 表达的影响
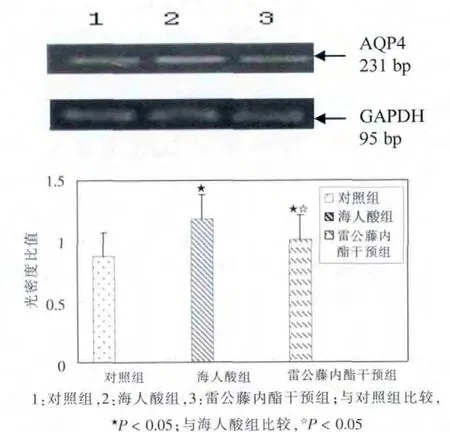
图2 雷公藤内酯对大鼠海马区水通道蛋白4 mRNA 水平的影响
3 讨论
癫痫是常见的神经系统多发病之一,全世界癫痫患者总数达3000 万人,且我国每年有45 万新增患者,总数约650 万[5],其中约有1/4 的患者治疗后不能有效控制发作,转为难治性癫痫;而约有2/3 的难治性癫痫为颞叶癫痫。颞叶癫痫的临床特征是反复出现的自发性癫痫发作,最明显的病理改变是海马组织硬化,病情进展迅速,预后极差。 因此积极寻求高效、安全、毒副作用小的抗痫新药及治疗新靶点已成为临床及基础研究的重中之重。
雷公藤内酯是从雷公藤中分离出来的单体,毒性较小。 它可以透过血脑屏障,在神经系统疾病治疗中发挥抗炎及免疫调节作用。 大量研究显示,雷公藤内酯可以抑制胶质细胞的活化,减少炎症因子及促炎症细胞因子的释放,对神经元具有明确的保护作用[5-6],但其对水通道蛋白家族作用的分子机制方面研究报道较少。
AQP4 是大脑内的主要水通道蛋白,在软脑膜、室管膜、脉络丛及海马、视上核、下丘脑等均有显着的表达[7]。 AQP4 在神经系统主要有控制脑内水分的流动,易化星形胶质细胞的迁移,改变神经系统的兴奋性等作用,参与了脑缺血、颅内感染、脑肿瘤以及神经退行性疾病等多种神经系统疾病的病理学过程。 AQP4 在癫痫治疗中的作用一直是研究热点,Binder 等[8]发现AQP4 敲除可提高癫痫发作的阈值,提示神经胶质的AQP4 可能参与了脑兴奋性活动的调节。 在对海马硬化的中央颞叶癫痫患者的研究中发现,硬化海马中水含量增多。 通过采用定量RT-PCR 分析、免疫组织化学和高通量免疫金标记的方法检测发现,硬化的海马中AQP4 表达明显上调[9]。腹腔注射锂-匹罗卡品建立SD 大鼠癫痫持续状态模型,在6、12、24、48、72、96、120、168 h 分别用免疫组化和RT-PCR 方法检测AQP4 的表达,结果显示癫痫持续状态24 h 后脑组织AQP4 的蛋白和mRNA 表达水平明显增高,48 h 达到高峰,持续72 h 后下降,并且AQP4 的动态表达变化和脑水肿形成过程呈正相关[10]。 以上研究说明AQP4与癫痫疾病的发生发展关系密切,AQP4 很可能成为癫痫治疗研究的新靶点。
本实验采用大鼠皮下注射海人酸方法建立了大鼠癫痫模型,它是研究难治性癫痫发病机制及药物治疗的良好模型。RT-PCR 和Western blot 结果均表明,海人酸组中海马AQP4 蛋白和mRNA 表达水平比对照组显着增多(P <0.05),与Alvestad 等[11]报道一致。进一步用雷公藤内酯干预发现,海马区AQP4 蛋白和mRNA 表达水平比海人酸组显着减少(P <0.05)。 结果提示,雷公藤内酯可下调AQP4 蛋白和mRNA 的表达,可以作为临床治疗难治性癫痫的候选药物之一。但是雷公藤内酯对其下调的具体机制尚不清楚,有待进一步研究。
[1] 关逊.癫痫和发作性疾病[M].北京:人民军医出版社,2001:221-223.
[2] 赵薇,曹岩,赵彩红,等.雷公藤内酯对海人酸致痫大鼠海马神经元的保护作用及相关PUMA 蛋白表达的影响[J].中风与神经疾病杂志,2012,29(5):443-445.
[3] 杨宜承,赵薇,曾常茜,等.雷公藤内酯对海人酸致痫大鼠神经元caspase3 和caspase9 蛋白表达的影响[J].辽宁中医药大学学报,2013,15(2):48-50.
[4] 张勇.水通道蛋白4 及其在癫痫研究中的进展[J].中国神经精神疾病杂志,2009,35(5):318-320.
[5] 周海燕.癫痫持续状态对幼年大鼠海马早期影响及雷公藤甲素保护作用的研究[D].济南:山东大学,2012.
[6] Zhou HF,Liu XY,Niu DB,et al.Triptolide protects dopaminergic neurons from inflammation -mediated damage in duced by lipopolysaccharide intranigral injection [J]. Neurobiol Dis,2005,18(3): 441-449.
[7] Yool AJ. Aquaporins: multiple roles in the central nervous system [J]. Neuroscientist,2007,13(5):470-485.
[8] Binder DK,Oshio K,Ma T,et al. Increased seizure threshold in mice lacking aquaporin-4 water channels [J]. Neuroreport,2004,15:259-262.
[9] Lee TS,Eid T,Mane S,et al. Aquaporin-4 is increased in the sclerotic hippocampus in human temporal lobe epilepsy [J]. Acta Neuropathoi,2004,108(6):493-502.
[10] 蒙兰青,韦世革,黄瑞雅,等.大鼠癫痫持续状态后水通道蛋白4 的表达[J].中华医学杂志,2007,6(2):144-147.
[11] Alvestad S,Hammer J,Hoddevik EH,et al. Mislocalization of AQP4 precedes chronic seizures in the kainate model of temporal lobe epilepsy [J]. Epilepsy Res,2013,105(1):30-41.



