蒋秋明 张熙洋 雷 蕾航天中心医院内分泌科,北京100049
亚临床甲状腺功能减退对糖尿病患者血糖、血脂、尿酸代谢的影响
蒋秋明张熙洋雷蕾
航天中心医院内分泌科,北京100049
目的观察亚临床甲状腺功能减退对糖尿病血糖、血脂、尿酸和尿蛋白的影响。方法入选2014年1~12月航天中心医院内分泌科糖尿病患者共532例为研究对象,根据血清促甲状腺素水平(TSH)分为TSH≤4.5μU/m L组(466例)和TSH>4.5μU/mL(66例)。比较两组患者的糖化血红蛋白、体重指数、三酰甘油、总胆固醇、低密度脂蛋白胆固醇和高密度脂蛋白胆固醇、尿酸和尿微量白蛋白水平。结果两组患者糖化血红蛋白和尿酸水平比较,差异均有高度统计学意义(P<0.01);而体重指数、血脂、尿微量白蛋白水平比较,差异无统计学意义(P>0.05)。多元逐步回归分析显示,低密度脂蛋白胆固醇和高密度脂蛋白胆固醇以及尿酸是TSH升高的独立相关因素(P<0.05或P<0.01)。结论糖尿病患者血清TSH的升高与血糖、血脂和尿酸水平相关。
亚临床甲状腺功能减退;促甲状腺激素;糖化血红蛋白;血脂;尿酸
近年来我国糖尿病患病呈明显的上升趋势,相应地与其相关的血管并发症也成为威胁越来越多糖尿病患者的主要因素。而在糖尿病动态发展过程中,血管病变的形成也是多因素的。降低危险的构成组分,才能减少血管病变。而除胰岛素外,某些激素可能也作为病因参与糖尿病并发症的发病过程。糖尿病和甲状腺疾病有着共同的免疫学基础,研究表明,甲状腺功能即使轻度降低,也可增加代谢综合征的患病危险[1]。亚临床甲状腺功能减退(subclinical hypothyroidism,SCH)简称亚甲减,可加重血管内皮的炎性反应,从而促进动脉粥样硬化[2-3]。亚甲减患者血中甲状腺激素尚未显着降低,仅表现为促甲状腺素(Thyroid stimulating hormone,TSH)不同程度升高,而外源补充是否可以改善甚至纠正这种改变,也是近年内分泌学科的关注点之一。为进一步了解亚甲减对糖尿病患者血糖、血脂、尿酸代谢的影响,本研究选取532例糖尿病患者,根据TSH水平将其进行分组,对其血糖、血脂、尿酸和尿微量白蛋白等指标进行了对比研究。
1 资料与方法
1.1一般资料
选择2014年1~12月航天中心医院(以下简称“我院”)内分泌科糖尿病患者532例为研究对象,均符合2013中国糖尿病防治指南确定标准[4],其中男363例,女169例;年龄14~67岁,病程1~30年。排除标准:甲状腺炎、甲亢及甲减、亚临床甲亢(FT3、FT4正常但TSH低于正常值)及其他甲状腺疾病的患者;既往有明确的甲状腺疾病史的患者;糖尿病急性和严重慢性并发症、肝肾疾病、自身免疫性疾病、肿瘤的患者;服用影响甲状腺功能药物和不能配合研究的患者。
1.2方法
1.2.1所有患者入院后均进行了基础检查,包括血压、血糖、糖化血红蛋白(glycosylated hemoglobin,HbAlc)、血脂、肝肾功、尿酸、尿微量白蛋白等。均进行血清甲状腺功能检测。对TSH>4.5μU/mL的标本进行复测,测定仍>4.5μU/mL且FT3、FT4正常,诊断为亚甲减。所有检测由我院检验科完成,质控符合国家标准。
1.2.2根据血清TSH的检测水平将患者分为TSH正常组(TSH≤4.5μU/mL组)和TSH升高组(TSH>4.5μU/mL)。比较两组糖化血红蛋白(Glycosylated hemoglobin,HbA1c)、体重指数(Bodymass index,BMI)、三酰甘油(TG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)和高密度脂蛋白胆固醇(HDL-C)、尿酸和尿微量白蛋白水平。
1.3统计学方法
采用SPSS 19.0统计学软件进行数据分析,计量资料数据用均数±标准差(x±s)表示,两组间比较采用t检验;计数资料用率表示,组间比较采用χ2检验,以P<0.05为差异有统计学意义。
表1 两组患者一般资料比较(±s)

表1 两组患者一般资料比较(±s)
注:HbAlc:糖化血红蛋白;TG:三酰甘油;TC:总胆固醇;LDL-C:低密度脂蛋白胆固醇;HDL-C:高密度脂蛋白胆固醇,TSH:促甲状腺激素
组别例数年龄(岁)体重指数(kg/m2)HbAlc(%)TG(mmol/L)TC(mmol/L)LDL-C(mmol/L)LDL-C(mmol/L)尿酸(μmol/L)尿微量白蛋白(mg/L)TSH≤4.5μU/m L组TSH>4.5μU/mL组P值466 66 45.01±12.58 41.39±14.59 0.059 24.73±4.06 24.91±3.87 0.739 7.94±1.90 8.76±2.33 0.007 1.82±1.74 1.87±1.32 0.858 4.86±1.15 4.77±1.18 0.530 2.85±0.85 2.71±0.93 0.221 0.96±0.28 1.98±8.76 0.345 321.04±87.12 287.83±100.50 0.005 33.31±92.55 44.74±76.62 0.339
2 结果
2.1两组患者一般资料比较
纳入观察的532例中,66例TSH>4.5μU/mL,466例TSH≤4.5μU/mL,阳性率12.41%。TSH>4.5μU/mL组和TSH≤4.5μU/mL组HbAlc和尿酸比较差异均有高度统计学意义(P<0.01);而两组年龄、体重指数、TG、TC、LDL-C、HDL-C和尿微量白蛋白比较差异无统计学意义(P>0.05)。见表1。
2.2TSH影响因素分析
多元逐步回归分析以TSH为因变量,以HbAlc、体重指数、TG、TC、LDL-C、HDL-C、尿酸和尿微量白蛋白作为自变量,进行多元逐步回归分析。结果显示,LDL-C,HDL-C和尿酸是TSH>4.5μU/m L的影响因素(P<0.05或P<0.01)。见表2。
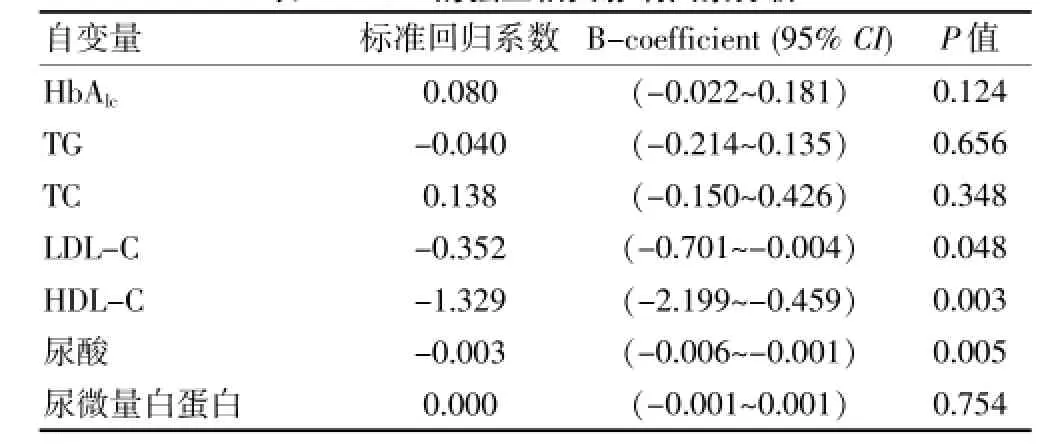
表2 TSH的独立相关影响因素分析
3 讨论
代谢综合征以肥胖、高血糖、高血压、血脂异常、高尿酸等代谢上相互联系危险因子组合发病为特征。降低其各个构成组分,进行多个危险因素的控制,是控制心血管事件的重要措施。代谢因素的危险性贯穿了整个病程,改善糖尿病预后的关键在于纠正所有的危险因素。糖脂代谢异常,以及胰岛素抵抗等的存在,均可影响到大血管并发症的进展。但其他内分泌激素在其中的作用,也受到越来越多的重视。而亚甲减正是近年来受到关注。
甲状腺功能减退是由多种因素引发的甲状腺激素合成、分泌或生物效应不足所导致的一种内分泌疾病,最常累及心血管系统,如心绞痛、冠状动脉粥样硬化、心肌梗死等。因此,甲状腺激素在血管并发症和代谢综合征中的作用,近年受到越来越多的关注。
亚临床疾病的共同特征是临床表现不显着,缺乏特异性易于漏诊,而又有相当比例在发展至临床疾病之前就对人体造成危害。亚甲减就是其一。糖尿病人群中甲状腺疾病患病率显着高于非糖尿病人群,是非糖尿病患者的2~3倍[6]。其中又以亚甲减最为常见[7]。亚甲减虽然临床症状隐匿,但是,伴随亚甲减出现甚至早于其出现的高脂血症、高血压、炎性反应和高凝状态等代谢紊乱,亦可直接促进动脉粥样硬化性心血管疾病的发生。
糖尿病与甲状腺疾病除有共同的免疫学基础外,甲状腺也易受高糖毒性的影响。糖尿病患者血清AGEs堆积,使得甲状腺糖基化终末产物受体蛋白表达增高,导致甲状腺也成为了高糖攻击的靶器官之一[8]。糖尿病患者的大血管与微血管并发症,本身就是威胁糖尿病健康的最主要因素。而当糖尿病合并亚甲减之后,随着TSH水平的增高,空腹胰岛素及血脂水平也随之升高[9],这两种疾病的叠加出现,促进了糖尿病动脉粥样硬化和血管并发症的发生和发展。
国内有基于2型糖尿病的研究[10],显示亚甲减组血糖和HbA1c明显低于甲功正常组,踝/臂指数(Ankle Brachial Index,ABI)在重度亚甲减组明显降低。同时还发现,高血压患病率在亚甲减组明显升高,左心室射血分数与TSH显着负相关。甲状腺功能减退时人体的基础代谢率下降,可导致有效循环血量的下降和外周血管代偿性的收缩,可致患者血压升高。加之易合并高脂血症,更易促进动脉粥样硬化。
本研究中,两组的HbA1c存在着差异,TSH>4.5μU/m L组的HbA1c水平要显着高于TSH≤4.5μU/m L组。与国内关于葡萄糖毒性对甲状腺生理功能存在显着影响研究结果相符[8]。
近年的研究提示亚甲减引起血脂代谢紊乱,本研究中,TSH>4.5μU/mL组和TSH≤4.5μU/mL组在TG、TC、LDL-C、HDL-C和尿微量白蛋白上虽然未见显着差异,但是多因素逐步回归分析显示LDL-C、HDL-C仍是TSH>4.5μU/mL的独立相关因素。正常的甲状腺功能,对人体是维持机体血脂代谢所必需的。亚甲减导致的血脂紊乱,考虑与甲状腺激素的生理作用有关。甲状腺激素对血脂代谢的影响时双向的,既可促进胆固醇在肝脏的合成,还可促使胆固醇及其代谢产物从胆汁中排泄。而这两方面作用之中,后者在机体的作用较前者更强。当甲状腺激素不足时,虽然胆固醇的合成降低,但是胆固醇及其代谢产物排泄降低更多,导致体内的胆固醇水平上升。此外,当甲状腺功能出现下降时,无论是体内脂蛋白酯酶的活性下降还是脂蛋白依赖的LDL-C功能的清除能力下降,都可导致血清TG和LDL-C浓度升高[11]。
促甲状腺激素受体(Thyroid stimulating hormone receptor,TSHR)存在于甲状腺滤泡细胞表面,而且广泛分布在下丘脑、垂体、肝脏、脂肪组织和肾脏等多种甲状腺外的细胞和组织中。另一方面,肝脏和脂肪组织又是机体脂肪代谢的主要器官,因此,TSH通过分布在肝脏和脂肪细胞的TSHR做介导,对脂质代谢发挥了重要的生理作用[12]。同时,甲状腺激素是促进机体代谢的激素。其水平下降致各种营养物质消耗减低,考虑也是血脂代谢紊乱不容忽视的因素之一。黄融等[13]对血清TSH和BMI的关系进行了研究,发现TSH与BMI相关,随着TSH的升高,BMI逐渐增大。而国外的相关研究显示,即使TSH处于正常范围,肥胖人群的BMI也和与TSH呈正相关,考虑原因可能与神经内分泌失调以及下丘脑-垂体调节轴改变相关[14]。
国外的临床观察认为亚甲减可导致血脂的代谢紊乱[15],增加冠心病的危险,这与其引起LDL-C升高和HDL-C下降有关[16]。国内文献对亚甲减血脂代谢的研究与国外结果相似[17],认为亚甲减人群的TC、TG和LDL-C水平均高于对照人群。杨曙辉等[12]对老年2型糖尿病中伴亚甲减的和甲功正常的患者进行了对比研究,结果显示亚甲减患者的血脂紊乱和代谢综合征的发生率都显着增高。
高尿酸血症作为心血管疾病的危险因素和代谢综合征的组分,发病率正逐年上升。国外研究发现甲减人群中高尿酸血症的发病率高于正常人群[18]。本次观察中发现,亚甲减组的尿酸明显增高,而且是TSH升高的独立危险因素。其机制考虑主要与甲减时尿酸的排泄减少有关[19]。同时,高尿酸血症对肾脏造成的肾间质纤维变性等炎症改变,加重了肾功能的损害,反过来又影响了尿酸的代谢。另外还有研究发现高尿酸血症与高同型半胱氨酸有关[20],高同型半胱氨酸不仅与动脉粥样硬化密切相关,还可诱导肾血管重构,造成肾小球和小管损害,从而减少肾小球滤过率和肾脏的血流量[21]。国内研究也发现不仅是甲减,而且亚甲减患者的尿酸水平均较对照组显着升高,并且与TSH呈正相关[17]。
高尿酸血症成为冠心病的独立危险因素,近年来已经得到共识。有文献报道尿酸升高可能影响急性冠脉综合征的产生[22]。冠心病患者的尿酸可能通过抑制内皮祖细胞,导致了冠心病及相关的临床症状的出现[23]。甚至也有研究认为,在亚甲减患者的动脉粥样硬化的进程中,血脂代谢紊乱和高尿酸血症可能是重要的危险因素,而与血糖水平变化无关[24]。
糖尿病肾病(diabetic kidney disease,DKD)与甲减的研究并不多。有研究[25]调查了588例2型糖尿病,发现伴DKD组TSH水平增高,FT4水平降低。同时还发现,亚甲减组发生糖尿病肾病比例也高于甲功正常组。这就提示糖尿病肾病与甲减可能有一定互为因果作用。国内也有研究提示2型糖尿病病情较重者更易合并甲减,而合并甲状腺激素水平的降低有可能进一步加重肾脏损害[26]。考虑这种情况可能因素较多。甲功下降导致机体基础代谢率下降,其中一个后果就是肾脏血流量的下降,从而导致肌酐排泄的降低和肾功能的损害。而且甲减后血尿酸的代谢也相应减缓,当较高水平的尿酸从肾脏排泄时,尿酸盐结晶可堵塞肾小管,甚至导致痛风性肾病。另外,肾脏基底膜受到损害,大量蛋白尿可致甲状腺结合球蛋白损失过多[27],同时糖脂代谢紊乱、低蛋白血症和酸性代谢产物增多,均可为5-脱碘酶活性下降,T4向T3转化的抑制因素[28]。对甲减患者血尿酸水平与血清肌酐水平的一项研究[29]中发现,甲减患者可能存在持续血肌酐水平升高和肾小球滤过率降低。这也就提示我们,即使亚甲减也同样可能会引起肾功能的损害。
本次研究中,亚甲减组尿微量白蛋白[(44.74± 76.62)mg/L]与甲功正常组[(33.31±92.55)mg/L]比较,未能见到显着性差异,也未发现是TSH升高的独立危险因素。本研究中的糖尿病患者包括1型和2型,年龄跨度也较大。考虑DKD致病因素复杂,尿微量蛋白的出现多种因素参与其中,甲状腺功能与糖尿病肾病的相关性有待扩大病例数量和继续的随访观察。
总之,对糖尿病患者合并亚甲减的研究,不仅对于讨论亚甲减是否进行早期干预治疗是必要的,而且对于预防动脉粥样硬化及心血管疾病的发生有益。同时,探讨甲状腺激素在糖尿病致病及发展过程中的作用,有助于我们深入研究糖尿病的发病机制,也为研究其他内分泌激素在代谢综合征中的作用提供借鉴和思路,从而为今后糖尿病及其并发症,以及代谢综合征的治疗提供更广阔的思路和前景。
[1]王佳妮,单忠艳,滕卫平,等.血清促甲状腺激素与代谢综合征及其组分的相关关系研究[J].中国实用内科杂志,2010,30(6):534-536.
[2]Ashizawa K,Imaizumi M,Usa T,et al.Metabolic cardiovas-cular disease risk factors and their clustering in subclinical hypothyroidism[J].Clin Endocrinol,2010,72(5):689-695.
[3]涂燕平,雷梦觉,吴小和,等.亚临床甲状腺功能减退与冠心病患者血管内皮功能与炎性反应之间关系的研究[J].临床荟萃,2011,26(6):491-493.
[4]中国2型糖尿病防治指南[J].中华糖尿病杂志,2014,6(7):447-498.
[5]陈作强,张玉彪.甲状腺功能减退症性心脏病的诊断和治疗进展[J].医学综述,2014,20(20):3741-3743.
[6]Vondra K,Vrbikova J,Dvorakova K.Thyroid gland diseases in adult patientswith diabetesmellitus[J].Minerva Endocrinol,2005,30(4):217-236.
[7]Radaideh AR,Nusier MK,AmariFL,etal.Thyroid dysfunction in patientswith type 2 diabetesmellitus in Jordan[J]. SaudiMed J,2004,25(8):1046-1050.
[8]张宏,白景文,赵伟,等.糖尿病大鼠甲状腺组织的超微病理改变[J].天津医药,2006,34(2):108-110.
[9]吴旻,潘韵峰,黄美先,等.不同程度亚临床甲状腺功能减退对脂代谢及糖代谢影响和心血管疾病危险性分析[J].医学研究杂志,2011,40(6):127-130.
[10]刘薇,华琳,于湄.糖尿病大血管并发症与亚临床甲状腺功能减退关系的研究[J].临床荟萃,2009,24(23):2063-2066.
[11]黄融,曹勤,顾静莉.亚临床甲状腺功能异常与高尿酸血症的临床研究[J].上海交通大学学报:医学版,2013,33(10),1348-1351.
[12]杨曙晖,谢培文,沈闲茹.老年2型糖尿病伴亚临床甲减患者代谢综合征的情况[J].中国老年学杂志,2012,32,2725-2727.
[13]黄融,曹勤,顾静莉.亚临床甲状腺功能异常与高尿酸血症的临床研究[J].上海交通大学学报:医学版,2013,33(10):1348-1351.
[14]Nyrnes A,Jorde R,Sundsfjord J.Serum TSH is positively associated with BMI[J].Int JObes(Lond),2006,30(1):100-105.
[15]Catl G,Anik A,Ünver Tuhan H,et al.The effect of L-thyroxine treatment on hpothyroid symptom scores and lipid profile in children with subclinical hypothyroidism[J].Jclin Res Pediatr Endocrinol,2014,6(4):238.
[16]Kahaly GJ.Cardiovascular and atherogenie aspects of subclinical hypothyroidism[J].Thyroid,2000,10:665-679.
[17]于文竹,原迪,范永馨.亚临床甲状腺功能减低患者血脂、同型半胱氨酸及血尿酸的相关分析[J].中国实验诊断学,2015,19(9),1496-1497.
[18]Dariyerli N,Andican G,Atakoglu AB,et al.Hyperuricemia in hypothyroidiam:is it associated with postinsulin in fusion gycemic response?[J].Thoku JExp Med,2003,199(2):59-68.
[19]邵金凤,吴淑琼.甲状腺功能减退症患者替代治疗前后血脂、血尿酸变化及临床意义[J].湖北中医学院学报,2010,12(3):58.
[20]金小桦.原发性高尿酸血症血尿酸与同型半胱氨酸的关系的研究[D].青岛:青岛大学,2006.
[21]Kumagai H,Kotoh S,Hirosawa K,et al.Renal tubulointerstitial injury in weanling rats with hyperhomocysteinemia[J].Kidney Int,2002,62(4):1219-1228.
[22]成忠,彭定凤,余意君,等.血清尿酸水平与冠状动脉病变的相关性[J].临床内科杂志,2004,21(11):777-778.
[23]崔斌,黄岚,宋耀明,等.冠心病患者循环内皮祖细胞与尿酸检测及相关性[J].中国动脉硬化杂志,2006,14(1):57-60.
[24]邓顺有,陈广原,张彤.亚临床甲状腺功能减退症患者血脂、血糖和血尿酸变化分析[J].现代中西医结合杂志,2008,17(6):816-817.
[25]Chen HS,Wu TE,Jap TS,etal.Subclincalhypothyroidism is a rsk factor for nephropathy and cardiovasvular disease in type 2 diabtic patients[J].Diabet Med,2007,24(12):1336-1344.
[26]张琳,扬光燃,谢荣荣,等.甲状腺激素水平与DN的关系[J].湖南中医药大学学报,2010,30(4):13-17.
[27]雷永华,李红,徐蓉娟.DM与甲状腺功能减退相关关系的研究进展[J].实用医学杂志,2011,27(16):2894-2896.
[28]高淑华,娄芳华.糖尿病肾病合并甲状腺功能减退症的临床分析[J].临床荟萃,2012,27(19):1714-1715.
[29]贾丹,梁利波,唐国华.血尿酸与肌酐在甲状腺功能减退人群中的相关性研究[J].四川大学学报:医学版,2015,46(5):747-749.
Effect of subclinical hypothyroidism on blood glucose,lipid and uric acid metabolism of patentswith diabetesmellitus
JIANG Qiuming ZHANG Xiyang LEILei
Department of Endocrinology,Aerospace Center Hospital,Beijing 100049,China
Objective To observe the influence of subclinical hypothyroidism on glucose,lipid and uric acid metabolism of patients with diabetesmellitus.Methods From January to December 2014,532 patients with diabetic who were hospitalized in the Department of Endocrinology of Aerospace Center Hospital were selected as the research objects.Based on their TSH levels,patientswere divided into the TSH≤4.5μU/mL group(466 cases)and the TSH>4.5μU/mL group(66 cases).Hemoglobin A1c,body mass index,lipid(including TG,TC,LDL-C and HDL-C),uric acid and urinemicroalbumin of the two groups were compared.Results Hemoglobin A1cand uric acid of the two groups had statistically significant difference(P<0.01).But no significant difference was observed in BMI,blood lipid and urinemicroalbumin(P>0.05).A multivariate linear regression model found that,low-density lipoprotein cholesterol,high-density lipoprotein cholesteroland uric acid were the independent contributors to TSH levels(P<0.05 or P<0.01).Conclusion TSH level of patientswith diabetesmellitus is related to the control of blood glucose,lipid and uric acid metabolism.
Subclinical hypothyroidism;Thyroid Stimulating Hormone;Hemoglobin A1c;Blood lipid;Uric acid
R587
A
1673-7210(2016)06(c)-0080-05
(2016-03-12本文编辑:任念)



