李燕 王娟 张仁琦
[摘要] 目的 对比促性腺激素释放激素与地屈孕酮片预防子宫内膜息肉(EMP)电切术后复发的临床效果。 方法 选取2016年3月~2018年12月新疆医科大学第一附属医院收治的行EMP电切术患者208例,根据随机数字表法将其分为A组(n = 104)和B组(n = 104),其中A组术后给予地屈孕酮片预防治疗,B组术后给予促性腺激素释放激素预防治疗。比较两组患者子宫内膜厚度、生活质量量表(SF-36)、血清性激素指标、复发率及不良反应发生率。结果 两组患者子宫内膜厚度的时间、组间、交互作用比较差异有高度统计学意义(P < 0.01),进一步两两比较,组内比较:术后3、6、12个月,两组子宫内膜厚度均较术前呈依次降低趋势(P < 0.05);组间比较:B组术后3、6、12个月子宫内膜厚度低于A组(P < 0.05)。术后12个月,两组SF-36量表各维度评分均较术前升高,且B组高于A组,差异有统计学意义(P < 0.05)。术后12个月,两组卵泡刺激素、孕酮、雌二醇均较术前降低,且B组低于A组,差异有统计学意义(P < 0.05)。B组随访期间复发率低于A组,差异有统计学意义(P < 0.05)。B组治疗期间不良反应发生率高于A组,差异有统计学意义(P < 0.05)。 结论 与地屈孕酮片预防治疗比较,促性腺激素释放激素预防治疗EMP电切术后患者,可有效改善子宫内膜厚度、生活质量及血清性激素指标,同时还可减少复发,但其用药安全性相对较差,临床可视患者具体耐受度综合用药。
[关键词] 促性腺激素释放激素;地屈孕酮片;子宫内膜息肉电切术;复发
[中图分类号] R711.74 [文献标识码] A [文章编号] 1673-7210(2020)05(b)-0086-04
Clinical comparative study of gonadotropin releasing hormone and Dydrogesterone Tablets in the prevention of recurrence of endometrial polyps after electrotomy
LI Yan WANG Juan ZHANG Renqi
Gynecology Clinic, the First Affiliated Hospital of Xinjiang Medical University, Xinjiang Uygur Autonomous Region, Urumqi 830000, China
[Abstract] Objective To compare the clinical effect of gonadotropin releasing hormone and Dydrogesterone Tablets in the prevention of recurrence of endometrial polyps (EMP). Methods From March 2016 to December 2018, 208 patients with EMP in the First Affiliated Hospital of Xinjiang Medical University were selected from March 2016 to December 2018, they were divided into group A (n = 104) and group B (n = 104) according to the random number table. Group A was given Dydrogesterone Tablets after operation for prevention and group B was given gonadotropin releasing hormone after operation for prevention. The endometrial thickness, quality of life scal (SF-36), serum sex hormone index, recurrence rate and adverse reactions of patients were compared between the two groups. Results There was high significant difference of endometrial thickness in time, group and interaction between the two groups (P < 0.01). Further comparison between the two groups: 3, 6 months and 12 months after the operation, the endometrial thickness of the two groups decreased in turn compared with that before the operation (P < 0.05); that of group B was lower than that of group A (P < 0.05). At 12 months after operation, SF-36 scores in both groups were higher than those before operation, and group B was higher than group A, the differences were statistically significant (P < 0.05). 12 months after operation, follicle-stimulating hormone, progesterone and estradiol in the two groups were lower than those before operation, and group B was lower than group A, the differences were statistically significant (P < 0.05). The recurrence rate in group B was lower than that in group A, the difference was statistically significant (P < 0.05). The incidence of adverse reactions in group B was higher than that in group A, the difference was statistically significant (P < 0.05). Conclusion Compared with the prophylactic treatment of Dydrogesterone Tablets, the prophylactic treatment of gonadotropin releasing hormone can effectively improve the endometrial thickness, quality of life and serum sex hormone indexes, and reduce the recurrence, but its safety is relatively poor. The specific tolerance of the patients can be seen in clinical practice.
[Key words] Gonadotropin releasing hormone; Dydrogesterone Tablets; Endometrial polypectomy; Recurrence
子宫内膜息肉(endometrial polyps,EMP)是妇科的常见疾病,是由于局部的子宫内膜过度增生所致。EMP早期无特异性症状,随着病情进展,可出现阴道不规则流血、月经过多、淋漓不尽,严重者甚至不孕,严重影响患者的生活质量[1-2]。伴随着B超的广泛使用及人们自检意识的提高,无临床症状的EMP诊断率明显增高。EMP电切术是治疗EMP的常用方案,疗效确切。但由于EMP患者遭受局部雌激素长期刺激,致使其术后极易复发[3-4]。现临床为预防EMP电切术后息肉复发,多给予患者持续高雌激素治疗,地屈孕酮片可为患者补充孕激素,有助于提高雌激素水平[5]。促性腺激素释放激素可直接作用于垂体,通过下调卵巢分泌雌激素的水平,从而达到抑制子宫内膜增生的目的,一定程度抑制EMP的复发[6]。但有关哪种治疗方式治疗效果最好,尚无统一定论,本研究通过对比促性腺激素释放激素与地屈孕酮片预防EMP电切术后复发情况,以期更好地服务于EMP电切术后患者。
1 资料与方法
1.1 一般资料
选取2016年3月~2018年12月新疆医科大学第一附属医院(以下简称“我院”)收治的行EMP电切术患者208例,本研究已通过我院医院伦理学委员会批准。纳入标准:①符合《现代中西医妇科学》[7]标准,并经B超等确诊;②具有手术指征;③手术均由同一组医师完成;④患者及其家属知情本研究且签署同意书。排除标准:①近半年内接受过宫腔手术者;②合并有恶性肿瘤者;③存在宫腔镜检查禁忌者;④子宫内膜复杂性增生及内膜恶性病变者;⑤合并有子宫黏膜下肌瘤或有节育环者。⑥对本研究用药有禁忌证者。根据随机数字表法将患者分为A组(n = 104)和B组(n = 104),其中A组年龄21~39岁,平均(31.68±4.18)岁;单发性息肉54例,多发性息肉50例;病程8~19个月,平均(13.62±2.38)个月;EMP直径0.8~1.9 cm,平均(1.47±0.25)cm。B组年龄23~41岁,平均(32.06±3.95)岁;单发性息肉53例,多发性息肉51例;病程7~21个月,平均(13.29±3.15)个月;EMP直径0.7~2.1 cm,平均(1.53±0.32)cm。两组患者一般资料比较,差异无统计学意义(P > 0.05),具有可比性。
1.2 方法
两组患者均于月经干净3~7 d内完善白带检查、肝肾功能、血常规、凝血功能等常规检查,确认无手术禁忌证后,择期于宫腔镜下实施EMP电切术。其中已生育者在术前12 h置入宫颈扩张棒,未生育者则于阴道后穹隆置入0.2~0.4 mg的米索前列醇(湖北葛店人福药业有限责任公司,生产批号:20150625,规格:0.2 mg)。术中,较小单发息肉,沿息肉基底部一次性完成息肉切除;息肉较大则分次完成;多发息肉者应先实施清宫术,再将残余息肉切除,电凝止血。术后常规予以缩宫素(上海禾丰制药有限公司,生产批号:20151207,规格:1 mL∶10 U)静脉滴注及抗感染治疗。A组术后给予地屈孕酮片(Abbott Biologicals B.V.,生产批号:20160827,规格:10 mg)治疗,1片/d,服药3周,月经结束后第5天再按照上述方法继续治疗,连续治疗3个月经周期。B组术后给予促性腺激素释放激素(上海丽珠制药有限公司,生产批号:20150824,规格:3.75 mg)治疗,皮下注射,3.75 mg/次,4次/周,连续治疗12周。术后以门诊复查的方式对所有患者进行为期12个月的随访。
1.3 观察指标
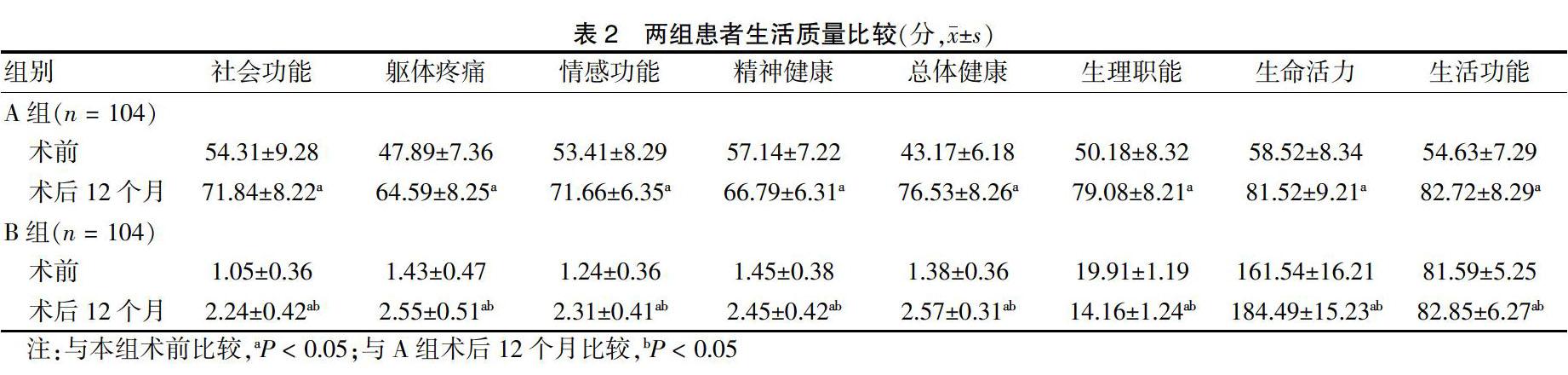
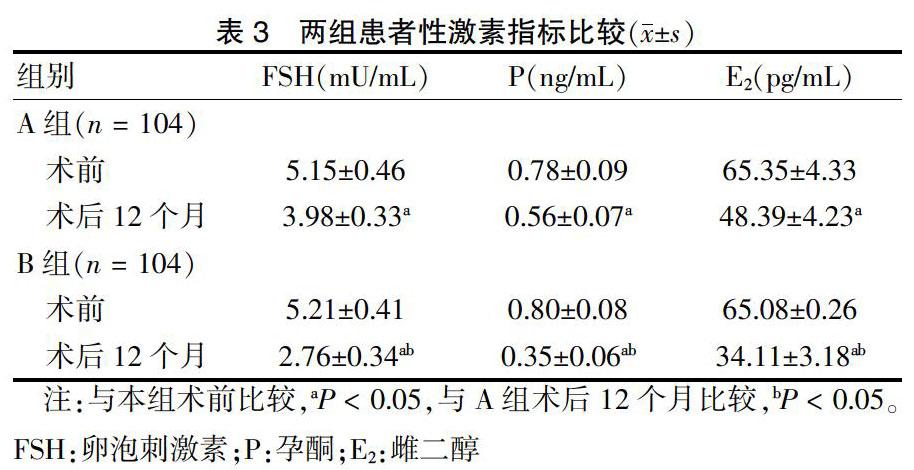
①于术前、术后3个月、术后6个月、术后12个月行阴道B超检查观察两组患者子宫内膜厚度变化情况。②术前、术后12个月清晨采集患者肘静脉血4 mL,4900 r/min离心15 min,离心半径9 cm,取上清液待测。采用化学发光法检测卵泡刺激素(FSH)、孕酮(P)、雌二醇(E2)水平,试剂盒购自宁波美康公司(生产批号:20151026),严格遵守说明书进行操作。③记录两组患者治疗期间不良反应情况及随访期间的复发情况,复发标准:经B超及宫腔镜检查再次明确为息肉,同时伴有月经量大、经期长等症状。④于术前、术后12个月采用生活质量量表(SF-36)[8]评价两组患者生活质量。其中SF-36共8个维度,分别为社会功能、躯体疼痛、情感功能、精神健康、总体健康、生理职能、生命活力、生活功能,每个维度均为100分,分数越高,表示患者生活质量越好。
1.4 统计学方法
采用SPSS 25.0统计学软件进行数据分析,计量资料用均数±标准差(x±s)表示,两组间比较采用t检验,重复测量数据采用方差分析,组间两两比较采用LSD检验,以P < 0.05为差异有统计学意义。
2 结果
2.1 两组患者子宫内膜厚度比较
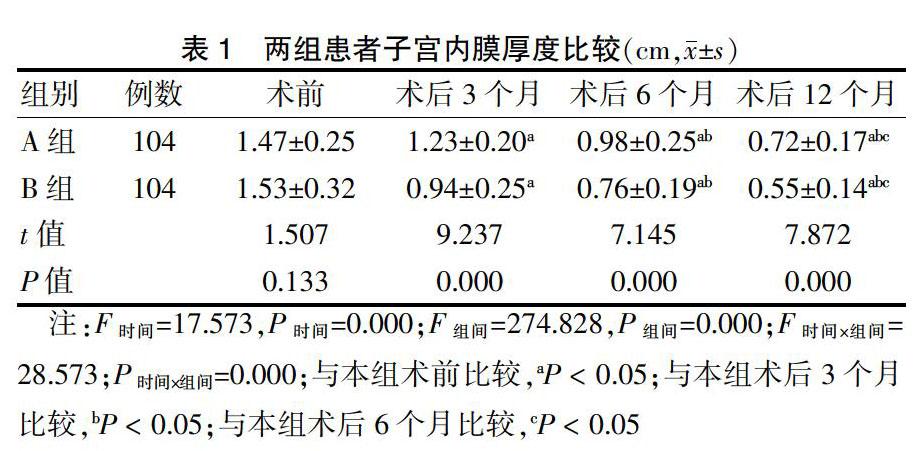
两组患者子宫内膜厚度时间、组间、交互作用比较差异有高度统计学意义(P < 0.01),进一步两两比较,组内比较:术后3、6、12个月,两组患者子宫内膜厚度均较术前呈依次降低趋势(P < 0.05);组间比较:术前比较A组子宫内膜厚度与B组比较,差异无统计学意义(P > 0.05);B组术后3、6、12个月子宫内膜厚度均低于A组(P < 0.05)。见表1。
2.2 两组患者生活质量比较
两组患者术前SF-36量表各维度评分比较,差异无统计学意义(P > 0.05);术后12个月,两组患者SF-36各维度评分均较术前升高,且B组高于A组,差异有统计学意义(P < 0.05)。见表2。
2.3 两组患者性激素指标比较
两组患者术前FSH、P、E2比较,差异无统计学意义(P > 0.05);术后12个月,两组患者FSH、P、E2均较术前降低,且B组低于A组,差异有统计学意义(P < 0.05)。见表3。
2.4 两组术后复发和不良反应发生情况比较
随访期间,A组有23例复发,复发率为22.12%(23/104);B组有8例复发,复发率为7.69%(8/104);B组随访期间复发率低于A组,差异有统计学意义(χ2=8.529,P = 0.003)。治疗期间,A组出现3例恶心呕吐、4例胃肠道不适、2例皮疹,不良反应发生率为8.65%(9/104);B组出现5例恶心呕吐、7例胃肠道不适、3例皮疹、4例乳涨,不良反应发生率为18.27%(19/104);B组治疗期间不良反应发生率高于A组,差异有统计学意义(χ2=4.127,P = 0.027)。
3 讨论
EMP是子宫内膜腺体和基质的增生性过度生长,从子宫内膜表面形成突起[9]。EMP不仅是临床常见的子宫内膜病变之一,同时也是引起子宫异常出血最常见的原因之一,若未能及时予以干预,还可引起不孕甚至癌变[10]。据以往研究资料统计[11],EMP所致的不孕症的发病率可达11%,而EMP的恶变率为0.5%~4.8%。EMP发病机制极其复杂,主要由长期的雌激素刺激无孕激素抵抗、抑癌基因的突变、细胞凋亡凋控基因的失衡等所致。现临床针对EMP的治疗主要选用EMP电切术,EMP电切术具有住院时间短、术后恢复迅速、保留生育功能等优点[12]。但因EMP发生于子宫内膜基底层,即便EMP电切术是世界公认的治疗EMP的最有效治疗手段,其术后复发情况仍然十分严重[13]。而当EMP再次发病后,患者不但受临床症状困扰,同时还担心有癌变风险,严重影响患者生活质量[14]。因此,在EMP电切术后给予合理的药物预防,有助于改善其预后。目前,孕激素类药物、促性腺激素释放激素是临床常用的术后预防用药,地屈孕酮片是孕激素类药物的一种,主要作用可以使子宫内膜增厚,但该药需长期服用,加之有不少患者对“激素”类药物认知不足,有一定的抗拒心理,导致依从性较差[15]。促性腺激素释放激素是下丘脑分泌产生的神经激素,外源性给予促性腺激素释放激素可以使性激素依赖的EMP萎缩,达到预防复发的目的[16]。但该药也存在费用较高、过于降低女性雌激素水平等缺陷。
本次研究结果显示,两组患者术后不同时间点子宫内膜厚度及生活质量均有所改善,且B组改善效果更佳。提示与地屈孕酮片预防治疗比较,促性腺激素释放激素预防治疗EMP电切术后患者,可有效改善子宫内膜厚度及生活质量。分析其原因,地屈孕酮片可促使子宫内膜分泌,通过促进细胞凋亡对抗雌激素进而抑制子宫内膜增殖。而促性腺激素释放激素是激素及内分泌类药,作用机制是通过刺激机体内加速释放激素和增加释放促性腺激素,可从根源上减少雌激素的分泌,同时其还具有调经止血的作用,故其子宫内膜厚度及生活质量改善更为明显[17]。既往研究显示[18],EMP的发生与性激素水平紊乱息息相关。FSH是垂体前叶嗜碱性细胞分泌的一种激素,可促进卵泡颗粒层细胞增生分化;P是促进女性生殖系统和胸腺生长发育的重要激素;E2是雌激素中最主要、活性最强的激素,是性腺功能启动的标志。本研究中B组的性激素改善水平更佳,提示与促性腺激素释放激素能够持续作用于垂体,从而减少雌激素合成有关[19]。另B组随访期间复发率低于A组,提示促性腺激素释放激素预防治疗可有效减少EMP术后复发,这可能与促性腺激素释放激素具有较强受体亲和力,可有效改善子宫内膜环境,促使病灶萎缩并吸收,从而降低术后复发率[20]。B组治疗期间不良反应发生率高于A组,提示促性腺激素释放激素用药安全性相对较差,可能在一定程度上影响患者耐受性,临床可视患者具体耐受度综合用药。
综上所述,与地屈孕酮片预防治疗比较,促性腺激素释放激素预防治疗EMP电切术后患者,可有效改善子宫内膜厚度、生活质量及血清性激素指标,同时还可减少复发,但其用药安全性相对较差。
[参考文献]
[1] 陈梅,马莉.宫腔镜子宫内膜息肉电切术联合左炔诺孕酮宫内缓释系统治疗子宫内膜息肉[J].长春中医药大学学报,2016,32(2):396-398.
[2] Park YR,Lee SW,Kim Y,et al. Endometrial?thickness cut-off value by transvaginal ultrasonography for screening of endometrial pathology in premenopausal and postmenopausal women [J]. Obstet Gynecol Sci,2019,62(6):445-453.
[3] 梁荣丽,罗宋,黄小静,等.TCRP联合左炔诺孕酮缓释系统治疗子宫内膜息肉效果观察[J].海南医学,2018,29(8):1093-1096.
[4] Lindheim SR,Lincenberg K,Wood MA,et al. The Impact of Hysteroscopic Tissue Removal Systems on Histopathologic Analysis for Benign and Cancerous Endometrial Pathology:An Ex Vivo Study [J]. J Obstet Gynaecol India,2019,69(Suppl 2):182-187.
[5] 陈勇,张少霞,陈小燕,等.左炔诺孕酮宫内缓释系统在预防宫腔镜术后息肉复发中的应用[J].广东医学,2014, 35(14):2213-2215.
[6] 李红梅,张洁,王秀艳,等.宫腔镜治疗子宫内膜息肉切除术108例临床分析[J].重庆医学,2013,42(3):339-341.
[7] 马其江,桑海莉,岳小方.现代中西医妇科学[M].北京:中国科学技术出版社,2006.
[8] 徐丽珍.SF-36量表评价LAVH对患者生存质量的影响[D].杭州:浙江大学,2006.
[9] 袁蓉,孙琰,钱芳波,等.子宫内膜息肉电切术后宫内放置左炔诺孕酮宫内缓释系统预防复发的临床研究[J].现代中西医结合杂志,2017,26(2):150-152.
[10] Takeda T,Banno K,Kobayashi Y,et al. Mutations of RAS genes in endometrial polyps [J]. Oncol Rep,2019, 42(6):2303-2308.
[11] 黄杭珍,曹佳萍.孕激素联合宫腔镜手术治疗多发性子宫内膜息肉及术后复发分析[J].中国计划生育学杂志,2019,27(6):698-701.
[12] 江雪娟,丁彩飞,陈晓菲,等.桃红四物汤联合地屈孕酮片防治子宫内膜息肉术后复发效果观察[J].浙江中西医结合杂志,2019,29(9):748-750.
[13] Zhang Y,Chen J,Zhen Z,et al. Antidiastole Value of Three-dimensional Ultrasonography and Power Doppler between Uterine Parenchyma Lumps and Endometrial Cancer: A Retrospective Study [J]. Curr Med Sci,2019, 39(5):816-819.
[14] Sletten ET,Arnes M,Vereide AB,et al. Intrauterine Progestin Therapy as a New Approach to Premalignant?Endometrial Polyps: A Prospective Observational Study [J]. Anticancer Res,2019,39(9):4897-4903.
[15] 刘怡.促性腺激素释放激素加左炔诺孕酮宫内节育系统对子宫内膜息肉的复发情况的影响分析[J].中国处方药,2018,16(5):79-80.
[16] 梁海燕,于欢,韩素慧,等.不同孕激素预防子宫内膜息肉术后复发的临床疗效[J].国际生殖健康/计划生育杂志,2014,33(1):18-20.
[17] 吴伟瑛,陈丽平,罗海华,等.不同方法预防子宫内膜息肉切除术后复发的疗效对比[J].临床医学工程,2018, 25(5):631-632.
[18] 王桢.不同孕激素对预防宫腔镜下子宫内膜息肉切除术后复发的临床观察[J].现代实用医学,2019,31(3):380-381.
[19] Sauerbrun-Cutler MT,Alvero R. Short-and long-term impact of gonadotropin-releasing hormone analogue treatment on bone loss and fracture [J]. Fertil Steril,2019, 112(5):799-803.
[20] 左艳,闫彩平,吴碧青,等.雌激素受体、孕激素受体水平及微血管密度与子宫内膜息肉复发关系探讨[J].中国现代药物应用,2016,10(15):162-164.
(收稿日期:2019-12-20 本文编辑:任 念)



