郑 益 王文彬 单春燕
1.江苏省苏州市第九人民医院耳鼻咽喉科,江苏苏州 215200;2.江苏省苏州市立医院耳鼻咽喉科,江苏苏州 215000;3.江苏省苏州市吴江区中医医院耳鼻咽喉科,江苏苏州 215200
胃食管反流性咽喉病可导致咽喉处黏膜受损,增加消化道疾病的发病风险[1-2]。目前临床中对胃食管反流性咽喉病的治疗以药物干预为主,通过降低反流物酸度或抑制胃酸分泌而达到治疗效果[3-4]。兰索拉唑对胃壁细胞H+-ATP 酶系统具有特异性抑制作用,对缓解反流性疾病具有一定的临床疗效[5]。但有学者发现[6],部分反流性疾病患者对兰索拉唑存在缺乏或不完全应答,临床疗效仍具有提升空间。富马酸伏诺拉生片在反流性食管炎治疗中具有一定的临床效果[7]。但目前富马酸伏诺拉生片与兰索拉唑在胃食管反流性咽喉病联合用药的临床疗效及安全性尚待证实。基于目前研究现状,现本研究通过选取江苏省苏州市第九人民医院(以下简称“我院”)收治的胃食管反流性咽喉病患者进行研究。
1 资料与方法
1.1 一般资料
选取我院2020 年1 月至2021 年11 月收治的82 例胃食管反流性咽喉病患者作为研究对象,其中女47 例,男35 例;年龄28~57 岁,平均(45.11±4.62)岁,以电脑随机数字表法将其分为研究组和对照组,各41 例。两组一般资料比较,差异无统计学意义(P>0.05),具有可比性。见表1。本研究由我院医学伦理委员会审批[批号:x2020-014-(003)]。纳入标准:①符合《胃食管反流病中医诊疗专家共识意见(2017)》[8]中胃食管反流性咽喉病的临床诊断;②食管内镜检查显示食管黏膜存在不同程度炎症反应;③年龄≥18 岁;④患者家属均对本研究及使用药物知情并签署知情同意书。排除标准:①胸部、颈部或咽喉、食管、胃部等消化道手术史;②消化道畸形;③肝肾功能损伤或对本研究药物过敏;④心脑血管疾病;⑤肺结核或慢性阻塞性肺疾病等呼吸系统传染性疾病;⑥临床病理学检查存在食管癌等消化道恶性病变。
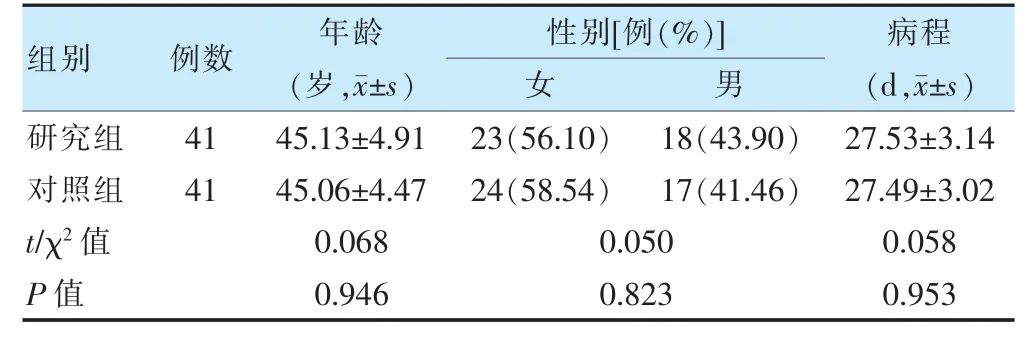
表1 两组一般资料比较
1.2 治疗方法
两组入院后均予以营养健康饮食指导,戒酒戒烟,保证充分睡眠时间,并予以硫糖铝1.0 g/次,3 次/d 辅助给药。对照组在此常规治疗的基础上予以兰索拉唑治疗:入院后口服兰索拉唑片(扬子江药业集团四川海蓉药业有限公司,批号:20070106,规格:15 mg×10 粒)30 mg/次,1 次/d,给药28 d。研究组在常规治疗基础上予以兰索拉唑联合富马酸伏诺拉生片治疗:兰索拉唑给药方案同对照组,同时予以富马酸伏诺拉生片(天津武田药品有限公司,批号:12023811,规格:20 mg×7 片)20 mg/次,1 次/d,口服给药,给药28 d。
1.3 观察指标
1.3.1 咽喉反流症状评估 分别于两组治疗前后采用反流病问卷(reflux disease questionnaire,RDQ)及胃肠道影响量表(gastrointestinal impact scale,GIS)[9]对咽喉反流症状进行评估,其中RDQ 包括症状程度和发作频率,发作频率记分如下,无(0 分),<1 d/周(1 分),1 d/周(2 分),2~3 d/周(3 分),4~5 d/周(4 分),6~7 d/周(5 分);发作程度记分如下,不明显由医师提醒获知(1 分),明显需间断性服药(3 分),严重需长期服药(5 分),介于1~3 分或3~5 分分别记为2 分和4 分,得分越高提示症状越严重。GIS 共计10 个条目,总分值40 分,得分越高提示症状越严重。
1.3.2 临床疗效评估 治疗后患者咽部不适、胸痛、反流、烧心等症状消失且持续时间≥72 h 为基本痊愈;24~<72 h 或症状均明显减轻为好转;治疗后患者上述症状未明显改善或加重为无效。
1.3.2 胃肠激素水平检测 分别于两组治疗前后采用放射免疫法检测血清中血管活性肠肽及促胃液素水平。
1.3.3 血清炎症因子水平检测 采用酶联免疫吸附试验检测肿瘤坏死因子-α(tumor necrosis factor-α,TNFα)和白细胞介素-1β(interleukin-1β,IL-1β)水平。
1.3.4 不良反应 记录两组用药期间不良反应发生情况。
1.4 统计学方法
采用SPSS 26.0 对所得数据进行统计学分析。计量资料采用均数±标准差(±s)表示,比较采用t 检验;计数资料采用例数和百分率表示,比较采用χ2检验或Fisher 确切概率法。等级资料比较采用秩和检验。以P <0.05 为差异有统计学意义。
2 结果
2.1 两组治疗前后RDQ、GIS 评分比较
治疗前,两组RDQ、GIS 评分比较,差异无统计学意义(P >0.05)。治疗后,两组RDQ、GIS 评分均低于治疗前,且研究组均低于对照组(P <0.05)。见表2。
表2 两组治疗前后RDQ、GIS 评分比较(分,±s)

表2 两组治疗前后RDQ、GIS 评分比较(分,±s)
注 与本组治疗前比较,aP <0.05。RDQ:反流病问卷;GIS:胃肠道影响量表
2.2 两组临床疗效比较
研究组临床疗效优于对照组(P <0.05)。见表3。
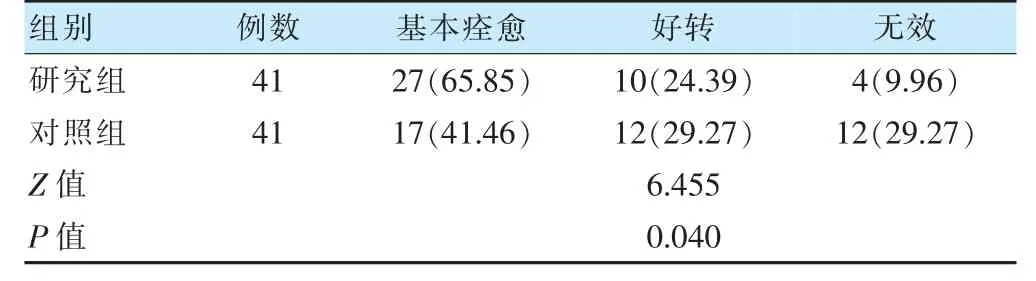
表3 两组临床疗效比较[例(%)]
2.3 两组治疗前后血管活性肠肽及促胃液素水平比较
治疗前,两组血管活性肠肽及促胃液素水平比较,差异无统计学意义(P >0.05)。治疗后,两组血管活性肠肽水平低于治疗前,促胃液素水平高于治疗前(P <0.05),且研究组血管活性肠肽水平低于对照组,促胃液素水平高于对照组(P <0.05)。见表4。
表4 两组治疗前后血管活性肠肽及促胃液素水平比较(pg/ml,±s)
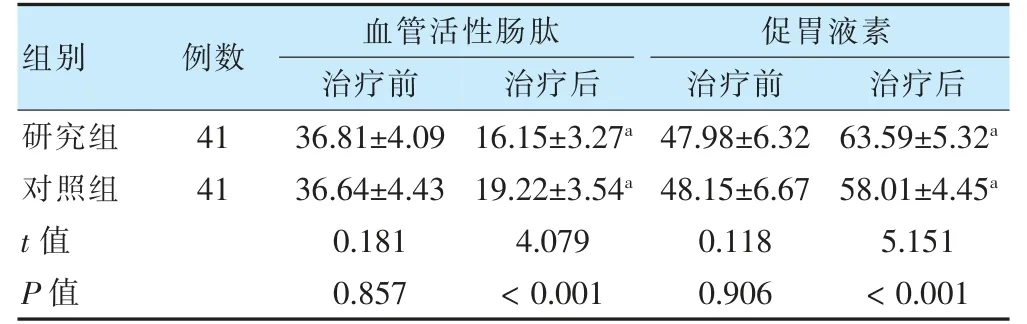
表4 两组治疗前后血管活性肠肽及促胃液素水平比较(pg/ml,±s)
注 与本组治疗前比较,aP <0.05
2.4 两组治疗前后血清TNF-α 及IL-1β 水平比较
治疗前,两组血清TNF-α 及IL-1β 水平比较,差异无统计学意义(P >0.05)。治疗后,两组血清TNF-α及IL-1β 水平低于治疗前,且研究组低于对照组(P <0.05)。见表5。
表5 两组治疗前后血清TNF-α 及IL-1β 水平比较(pg/ml,±s)
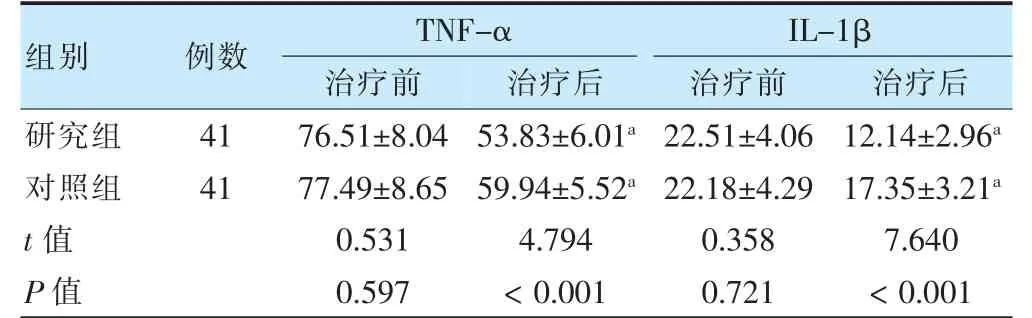
表5 两组治疗前后血清TNF-α 及IL-1β 水平比较(pg/ml,±s)
注 与本组治疗前比较,aP <0.05。TNF-α:肿瘤坏死因子-α;IL-1β:白细胞介素-1β
2.5 两组给药期间不良反应发生情况比较
研究组给药期间出现胃肠道反应1 例,过敏性皮炎1 例,药物不良反应发生率为4.88%(2/41);对照组给药期间胃肠道反应3 例,嗜睡1 例,药物不良反应发生率为9.76%(4/41),两组不良反应总发生率比较,差异无统计学意义[P=0.675(Fisher 确切概率法)]。
3 讨论
有研究指出,缓解或治愈反流性疾病的基础应以抑制患者胃酸过量分泌、中和或降低胃酸分泌物酸性为主[10-14]。兰索拉唑可特异性抑制胃壁细胞K+/H+-ATP酶系统以迅速阻滞胃酸分泌,在胃食管反流性咽喉病的治疗中具有一定的临床效果[15-16]。但随着研究的深入,有学者发现兰索拉唑的生物利用度个体差异较大且疗效呈剂量依赖性,在保证患者给药安全性的前提下部分患者表现出不完全应答现象,预后不佳[17]。因此如何在稳定药物安全性的前提下,进一步提升对胃食管反流性咽喉病患者的抑酸作用,成为近年临床学者探索的重点。富马酸伏诺拉生片是近年经国家批准的一类新型质子泵抑制剂,以K+竞争性方式可逆性抑制K+/H+-ATP 酶活性,具有优越的临床应用前景。本研究结果显示,研究组治疗后RDQ、GIS 评分均低于对照组,临床疗效优于对照组,且两组不良反应总发生率比较差异无统计学意义(P >0.05),提示应用富马酸伏诺拉生片有助于降低患者RDQ、GIS 评分,提升患者的临床疗效且安全性良好。
相关研究表明,富马酸伏诺拉生片可长时间滞留于胃壁细胞部位而抑制胃酸的生成及分泌,继而有效抑制胃酸反流对咽喉部黏膜损伤的形成[18-19]。黄博等[20]通过对60 例难治性反流性食管炎患者进行研究后得出,应用伏诺拉生有助于提升患者的临床疗效,且未增加药物毒性,与本研究结论基本一致。此外,富马酸伏诺拉生片给药168 h 后,98.5%的放射性药物可经尿液或粪便排除,而兰索拉唑的药物代谢半衰期仅为1.3~1.7 h,且在体内无积蓄性[21-23]。因此本研究认为,联合给药后并未增加药物毒性可能与伏诺拉生药代动力学良好有关。本研究中,研究组治疗后血管活性肠肽水平低于对照组,促胃液素水平高于对照组,提示应用富马酸伏诺拉生片有助于降低患者血管活性肠肽表达,并提高促胃液素水平。血管活性肠肽可通过促进靶细胞合成一氧化氮促使平滑肌舒张,激活食道括约肌的松弛反射,促胃液素可促进幽门括约肌收缩,间接抑制胃液反流至咽喉部,二者均可在一定程度反映胃肠激素分泌水平[24-27]。TNF-α 和IL-1β 均是机体重要的炎症因子,可反映免疫细胞的抗感染及吞噬作用[28-30]。本研究结果中,研究组治疗后血清TNF-α 及IL-1β 水平均低于对照组,提示应用富马酸伏诺拉生片更有助于降低患者机体炎症反应,对反映咽部黏膜损伤具有重要的临床参考价值。
本研究同样存在不足之处,研究样本量受限可能导致结论出现微小偏差,后续临床实践中仍需进行大样本随机对照研究证实本研究结论,共同推动胃食管反流性咽喉病的研究,完善治疗方案,改善患者预后。
综上,予以胃食管反流性咽喉病患者富马酸伏诺拉生片联合兰索拉唑治疗,可有效提升患者的临床效果且安全性良好,具有优越的临床应用前景。



