杨德勇 凯沙尔·百合提亚尔 姜钧耀 舒 莉▲
1.新疆医科大学第六附属医院关节外一科,新疆乌鲁木齐 830002;2.河南科技大学基础医学院,河南洛阳 471003
前交叉韧带(anterior cruciate ligament,ACL)损伤发病率高[1-2],目前ACL 重建失败率为0.7%~10.0%[3-4],其中腱骨愈合不良是重要原因之一[5-6]。为了加速腱骨愈合,干细胞移植和生长因子植入是目前的研究热点[7-8],然而单独使用干细胞或生长因子都有较大的局限性[9-10]。本研究将携带高表达肝细胞生长因子(hepatocyte growth factor,HGF)基因的腺病毒转染至骨髓间充质干细胞(mesenchymal stem cell,MSC)中,使HGF 在MSCs 扩增及分化的过程中持续表达,以期促进ACL 腱骨愈合。
1 材料与方法
1.1 实验动物
新西兰兔45 只(雄性),3~5 个月,体重3.0~3.5 kg,由新疆医科大学动物实验中心提供,生产许可证SCXK(新)2018-0002,使用许可证SYXK(新)2018-0003,实验方案经新疆医科大学批准(XJYK20211125)。实验兔饲养于新疆医科大学动物实验中心SPF 级屏障环境中,温度(22±2)℃,湿度60%~80%。
1.2 主要试剂及设备
兔MSCs(武汉普诺赛生物科技有限公司,CPRb007);冻干纤维蛋白胶(华兰生物工程股份有限公司,S20020084);携带重组HGF 基因的腺病毒载体(Ad-HGF)(上海汉恒生物科技有限公司,KS11672);Trizol试剂(美国Invitrogen,15596026);ReverttAid First Strand cDNA Synthesis Kit(美国Thermo,K1621)NanoDrop 2000 紫外-可见分光光度计(美国Thermo);荧光显微镜(日本Olympus,V251947);数字化电子万能生物材料试验机(深圳德迈胜公司,DMS-2T)。
1.3 研究方法
1.3.1 动物分组 采用随机数字表法将兔分为A、B、C组,每组15 只,行双后肢ACL 重建。A 组术后不注射任何物质;B 组术后胫骨骨道内注射MSCs 纤维蛋白胶;C 组术后胫骨骨道内注射HGF 修饰的MSCs 纤维蛋白胶。
1.3.2 HGF 转染MSCs 将兔MSCs(2×105/孔)接种于6 孔板内(培养体系含10%胎牛血清的α-MEM 培养基),待细胞融合至70%~80%时,进行腺病毒转染。37℃下,以感染复数MOI=150 加入2 ml 含Ad-GFPHGF 的α-MEM 培养基,置于二氧化碳培养箱内,24 h后,更换培养基。48 h 后,荧光显微镜下观察绿色荧光蛋白表达并计算细胞转染率;术前4 h 配置纤维蛋白胶。
1.3.3 ACL 重建A 组兔麻醉后,取跟腱为移植腱,长4 cm,直径2 mm[11]。显露膝关节,切断ACL,使用直径2 mm 克氏针钻取股骨、胫骨隧道。移植腱经胫、股骨隧道穿过,股骨外侧皮质钻孔,将韧带经骨孔缝合在股骨隧道外口皮质处;屈膝30°,收紧胫骨隧道内移植腱,同法固定胫骨止点,屈伸膝关节,ACL 牢靠,造模成功[12-13],逐层缝合(图1A)。B 组ACL 重建后取0.2 ml MSCs 悬液,细胞浓度5×109/L,与2 ml 纤维蛋白胶混合,注射至胫骨骨道内。C 组ACL 重建后取0.2 ml HGF 基因转染MSCs 悬液,细胞浓度为5×109/L,与2 ml 纤维蛋白胶混合,注射至胫骨骨道内。
1.3.4 腱骨组织学观察和关节液抽取 术后6 周处死实验兔(图1B),1 ml 注射器(含1 ml 注射用水)刺入关节腔,反复抽注,吸取关节液。取左侧腱骨组织行HE 染色。
1.3.5 力学检测 右膝保留胫、股骨各4 cm 结构,为防止移植腱在实验时从股骨骨道内脱出,先使用牙托粉填塞股骨骨道,随后包埋两端骨质,剔除多余组织,获得股骨-移植腱-胫骨标本,进行拉力实验(图1C)。
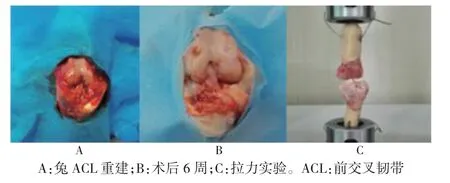
图1 兔ACL 重建及力学实验
1.3.6 RT-PCR 检测 拉力实验后取胫骨骨道内骨组织3 mm3,RT-PCR 检测成纤维细胞生长因子2(fibroblast growth factor 2,FGF2)、SMAD4 mRNA 及关节液HGF mRNA 的表达。PCR 反应体系:2×SYBR Green Select Mix 5 μl,正向引物0.7 μl,反向引物0.7 μl,ROX 0.05 μl,cDNA 1 μl,RNase-free Water 10 μl。反应条件:94℃×5 min,56℃×40 s,72℃×30 s,40 个循环,结束后,取反应液5 μl 进行电泳,确认产物。β-actin为对照,采用2-△△Ct法计算目的基因相对表达量。相关引物序列见表1。

表1 引物列表
1.4 统计学方法
采用SPSS 25.0 软件进行数据分析。计量资料用均数±标准差()表示,比较采用t 检验;计数资料用例数或百分率表示。以P<0.05 为差异有统计学意义。
2 结果
2.1 组织学观察结果
术后6 周,A 组腱骨分界连接疏松,胶原纤维排列紊乱(图2D);B 组腱骨界面连接较紧密,间隙小,但胶原纤维排列仍不整齐(图2E);C 组腱骨界面连接紧密,无明显间隙,胶原纤维排列较整齐(图2F)。
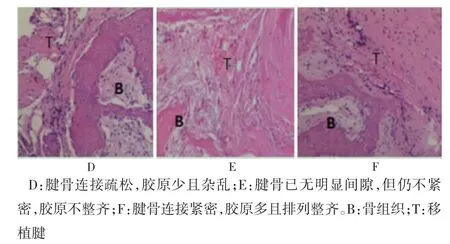
图2 腱骨愈合组织学(HE 染色,100×)
2.2 各组术后6 周各组拉力测试结果比较
术后6 周,B 组最大拉力载荷高于A 组,且C 组高于B 组,差异有统计学意义(P<0.05);A、B 组及B、C 组最大拉伸距离比较,差异无统计学意义(P>0.05)。见表2。
表2 各组术后6 周各组拉力测试结果比较()
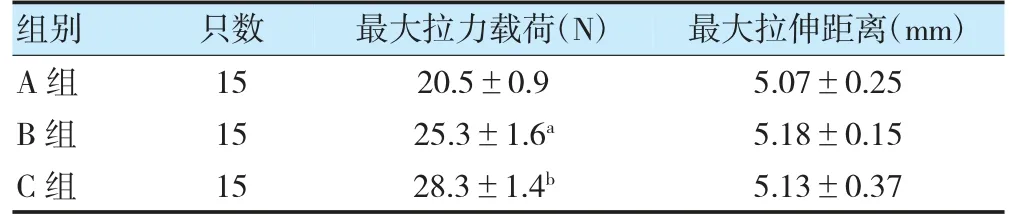
表2 各组术后6 周各组拉力测试结果比较()
注 与A 组比较,aP<0.05;与B 组比较,bP<0.05
2.3 各组骨道内FGF2 mRNA、SMAD4 mRNA 及关节液HGF mRNA 比较
B 组骨道内FGF2 mRNA、SMAD4 mRNA 大于A组,且C 组大于B 组,差异有统计学意义(P<0.05);C 组关节液HGF mRNA 大于B 组,差异有统计学意义(P<0.05)。见表3、图3。
表3 各组骨道内FGF2、SMAD4 mRNA 及关节液HGF mRNA比较()
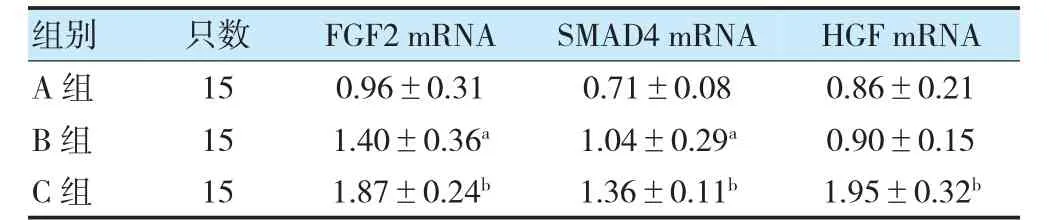
表3 各组骨道内FGF2、SMAD4 mRNA 及关节液HGF mRNA比较()
注 与A 组比较,aP<0.05;与B 组比较,bP<0.05。FGF2:成纤维细胞生长因子2;HGF:肝细胞生长因子

图3 mRNA 电泳图
3 讨论
ACL 术后腱骨愈合需多种细胞及因子的参与[14]。HGF 具有促进血管增生,减少细胞凋亡,加速细胞增殖等作用[15-16]。研究显示,HGF 能够促进腱骨愈合[17],然而单纯应用HGF 降解速度快,难以持续发挥作用,本研究将HGF 转入MSCs 中,达到了长期发挥作用的目的。
组织学观察、力学实验是测试腱骨愈合的传统方法[18]。本研究结果显示,C 组腱骨连接紧密,胶原纤维排列规整,最大拉力载荷高于B 组,提示局部应用HGF 转染MSCs 能够促进ACL 腱骨愈合。
FGF2 具有促进成纤维细胞增殖、分化,增加Ⅰ、Ⅲ型胶原等功能[19]。局部使用FGF2 能够促进成骨细胞、腱原母细胞增生,加速腱骨愈合[20-22]。SMAD4 以三聚体的形式在BMP、TGF-β 信号通路中发挥骨代谢作用[23],增加SMAD4 的表达,可以促进骨形成,反之则造成骨流失[24-25]。本研究结果显示,C 组FGF2 mRNA、SMAD4 mRNA 大于B 组,提示局部注射HGF 转染MSCs 可能通过提高细胞因子及激活BMP、TGF-β信号通路来促进腱骨愈合。
综上所述,局部注射HGF 转染MSCs 能够促进腱骨愈合,其机制可能是通过提高细胞因子及激活经典骨代谢信号通路来实现的。



