许 杰 王 晖 温 洪 张 舰
首都医科大学附属北京朝阳医院麻醉科,北京 100020
脑卒中是最常见的临床脑血管疾病之一[1]。缺血性脑卒中可导致脑损伤和神经功能障碍[2]。脑缺血/再灌注虽可挽救死亡细胞,但也可能加重细胞损伤[3]。因此,有必要探究影响脑卒中进程的病理机制,寻找缓解脑缺血/再灌注损伤的有效策略。目前,缺氧/复氧(hypoxia/reoxygenation,H/R)诱导的大鼠PC12 细胞已经被广泛用于模拟脑卒中体外模型[4],这为开展脑卒中的相关研究提供了方便。异丙酚是一种高脂溶性麻醉药物[5],被发现可缓解缺血/再灌注诱导的脑损伤[6]。此外,异丙酚被证实可改善神经炎症损伤,并可能作为脑卒中神经保护的有效策略[7-8]。因此,揭示异丙酚调控脑卒中进程的分子机制至关重要。微RNA(microRNA,miRNA)是脑卒中进程的关键调控子。研究显示,miR-1246 在缺血性脑卒中患者血清中高表达[9]。然而,异丙酚是否通过影响miR-1246 表达调控脑卒中进程尚不清楚。因此,本实验研究异丙酚是否通过调控miR-1246 表达影响H/R 诱导的PC12 细胞损伤,为脑卒中的治疗提供潜在分子靶点。
1 材料与方法
1.1 材料
PC12 细胞(货号:CL-0412)购自中国武汉procell;异丙酚(货号:2078-54-8)购自Sigma-Aldrich;DMEM 培养基(货号:11965092)、胎牛血清(货号:10100147)购自Gibco;Lipofectamine3000(货号:L300-0075)、Trizol 试剂(货号:15596026)购自Invitrogen;逆转录(货号:RR047A)和荧光定量试剂盒(货号:DRR041A)购自TaKaRa;RIPA 裂解液(货号:P0013B)、BCA 试剂盒(货号:P0012S)、MTT试剂盒(货号:C0009S)、Annexin V-FITC/PI 凋亡检测试剂盒(货号:C1062S)购自上海碧云天生物技术有限公司;酶联免疫吸附试验(enzyme-linked immunoadsordent assay,ELISA)试剂盒(货号:ml002813、ml028514、ml002859、ml028510)购自上海酶联生物科技有限公司;miR-1246 模拟物及抑制剂(miR-1246 和anti-miR-1246)购自上海吉玛制药技术有限公司;B 淋巴细胞瘤-2(B lymphocyte-2,Bcl-2)抗体(货号:ab32124)、B 淋巴细胞瘤-2关联x 蛋白(B lympho-blastoma-2 associated with x protein,Bax)抗体(ab32503)、GAPDH 抗 体(货 号:ab9485)与HRP 羊抗兔IgG(货号:ab205718)购自Abcam。
1.2 H/R 处理与分组
将PC12 细胞分为七组:control 组(正常条件21%O2/5%CO2/74%N2培养)、H/R 组(缺氧条件3%O2/5%CO2/92%N2培养2 h,正常条件下培养12 h)、H/R+异丙酚组(用50 μmol/L 异丙酚预处理1 h[6]后用H/R 处理)、H/R+anti-miR-NC 组(转染anti-miR-NC 后用H/R处理)、H/R+anti-miR-1246 组(转染anti-miR-1246后用H/R 处理)、H/R+异丙酚+miR-NC 组(转染miR-NC,再经50 μmol/L 异丙酚和H/R 处理)、H/R+异丙酚+miR-1246 组(转染miR-1246,再经50 μmol/L异丙酚和H/R 处理)。上述组别进行相关实验时,每组均设3 个复孔。转染步骤根据Lipofectamine3000 的说明书进行。
1.3 MTT 检测细胞活力
PC12 细胞用不同浓度(0、25、50、100 μmol/L)的异丙酚预处理1 h,然后用H/R 处理。取各组细胞(1×105个/ml),接种于96 孔板(100 μl/孔)培养48 h,每组6 个复孔,然后与MTT 溶液孵育4 h,与Formazan溶解液孵育4 h。在570 nm 测定吸光度值(A 值),细胞存活率为相对于对照组存活率的百分比,即细胞存活率=A实验组/A对照组×100%[10]。
1.4 Annexin V-FITC/PI 分析凋亡率
根据Annexin V-FITC/PI 试剂盒说明书,PC12 细胞用Binding Buffer 重悬,然后与Annexin V-FITC 和PI 孵育15 min。最后使用流式细胞仪检测细胞凋亡。
1.5 Western blot 分析蛋白水平
RIPA 裂解液提取总蛋白,经SDS-PAGE 电泳后,蛋白被转移至PVDF 膜上。膜经封闭后与一抗(anti-Bcl-2 稀释1∶1 000、anti-Bax 稀释1∶1 000、anti-GAPDH稀释1∶2 500)孵育,然后与HRP 羊抗兔IgG(稀释1∶50 000)孵育。最后,用ECL 溶液显示蛋白条带,Image J 软件分析蛋白条带灰度值。
1.6 ELISA 分析炎症因子水平
根据ELISA 试剂盒说明书,检测肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素(interleukin,IL)-1β、IL-18 和IL-10 在PC12 细胞培养基中的水平。
1.7 定量逆转录聚合酶链反应(quantitative reverse transcription polymerase chain reaction,qRT-PCR)
总RNA 用Trizol 试剂提取,然后用逆转录试剂盒合成cDNA。用荧光定量试剂盒进行RT-PCR。引物序 列:miR-1246 正向引物:5’-TGAAGTAGGACTGGGCAGAGA-3’,反向引物:5’-TTTGGGTCAGGTGTCCACTC-3’;U6 正向引物:5’-CTCGCTTCGGCAGCACA-3’,反向引物:5’-AACGCTTCACGAATTTGCGT-3’。反应体系:10×PCR Buffer 2.5 μl,MgSO42.5 μl,dNTPs 2.5 μl,正反向引物各0.5 μl,cDNA 2 μl,RNase-Free ddH2O 补足体系至25 μl;反应条件:95℃预变性2 min,95℃变性30 s,60℃退火30 s,72℃延伸30 s,共40 次循环。以U6 为内参,miR-1246 的相对表达量采用2-△△Ct法计算。
1.8 统计学方法
采用SPSS 21.0 统计学软件进行数据分析。计量资料采用均数±标准差()表示,两组比较采用t 检验,多组间比较采用单因素方差分析,组间比较采用LSD-t 检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 不同浓度异丙酚对H/R 处理PC12 细胞活力的影响
与control 组比较,H/R 组PC12 细胞存活率显着降低(P<0.05)。与H/R 组比较,采用异丙酚处理后的细胞存活率上升(P<0.05),且50 μmol/L 异丙酚处理时细胞存活率最高(图1)。故后续实验,异丙酚浓度选择50 μmol/L。
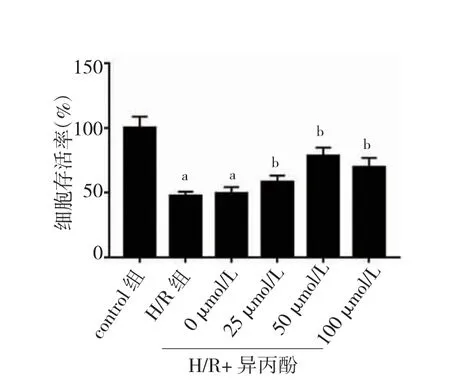
图1 不同浓度异丙酚对H/R 处理PC12 细胞活力的影响(n=6)
2.2 异丙酚对H/R 处理PC12 细胞损伤的影响
与control 组比较,H/R 组细胞凋亡率、Bax 蛋白、TNF-α、IL-1β 和IL-18 水平升高,Bcl-2 蛋白和IL-10水平降低(P<0.05)。与H/R 组比较,H/R+异丙酚组细胞凋亡率、Bax 蛋白、TNF-α、IL-1β 和IL-18 水平降低,Bcl-2 蛋白和IL-10 水平升高(P<0.05)。见图2,表1。
表1 异丙酚对H/R 处理PC12 细胞损伤的影响(,n=3)
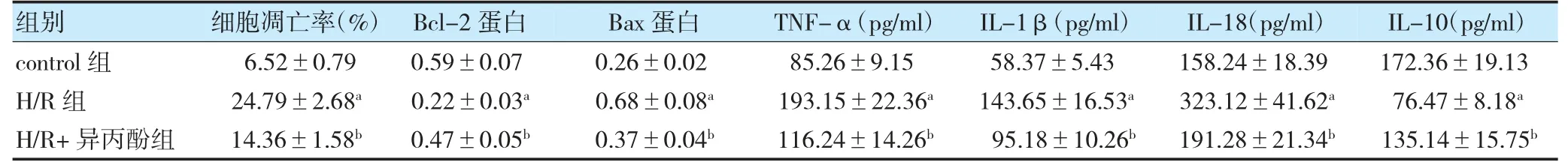
表1 异丙酚对H/R 处理PC12 细胞损伤的影响(,n=3)
注 与control 组比较,aP<0.05;与H/R 组比较,bP<0.05。H/R:缺氧/复氧;Bcl-2:B 淋巴细胞瘤-2;Bax:B 淋巴细胞瘤-2 关联x 蛋白;TNF-α:肿瘤坏死因子-α;IL:白细胞介素
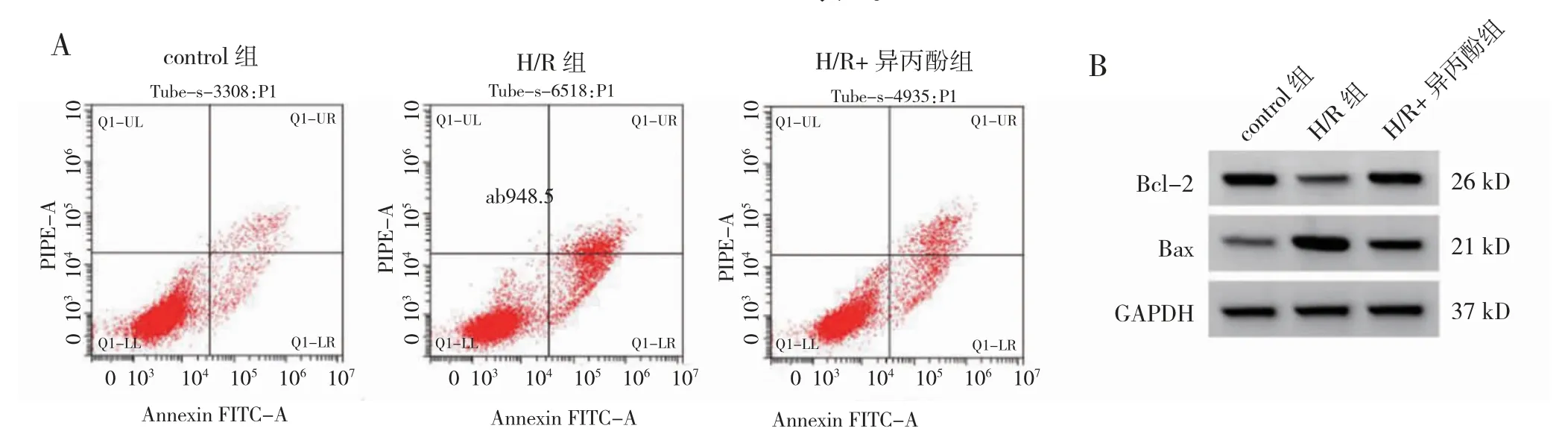
图2 异丙酚对H/R 处理PC12 细胞凋亡的影响
2.3 异丙酚对miR-1246 表达的影响
与control 组比较,H/R 组中miR-1246 表达升高(P<0.05)。与H/R 组比较,H/R+异丙酚组中miR-1246表达降低(P<0.05)。见图3。
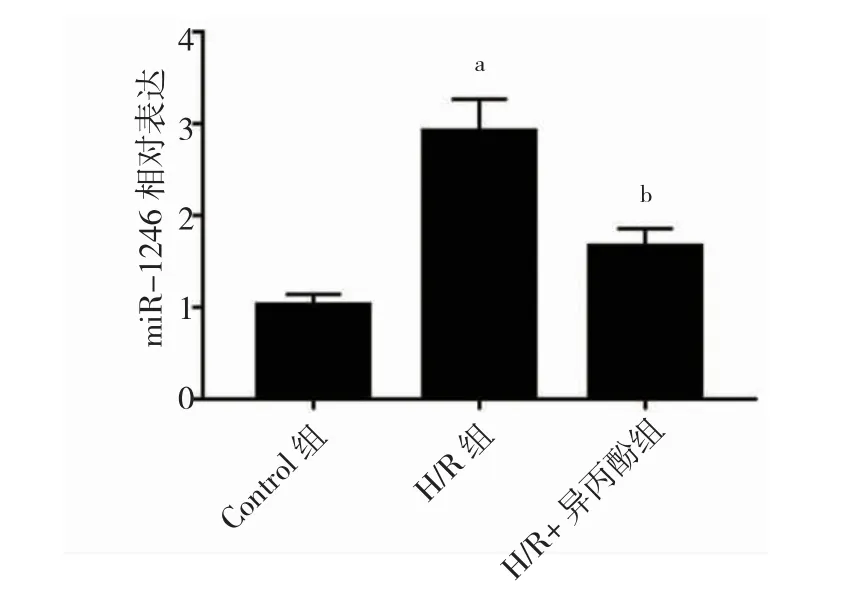
图3 异丙酚对H/R 处理PC12 细胞中miR-1246 表达的影响(n=3)
2.4 miR-1246 抑制剂对细胞损伤的影响
H/R 组与H/R+anti-miR-NC 组miR-1246 水平、细胞凋亡率、Bcl-2 蛋白、Bax 蛋白、TNF-α、IL-1β、IL-18、IL-10 水平比较,差异无统计学意义(P>0.05)。与H/R+anti-miR-NC 组比较,H/R+anti-miR-1246 组miR-1246 水平、细胞凋亡率、Bax 蛋白、TNF-α、IL-1β和IL-18 水平降低,Bcl-2 蛋白和IL-10 水平升高(P<0.05)。见图4,表2。
表2 抑制miR-1246 对H/R 处理PC12 细胞损伤的影响(,n=3)
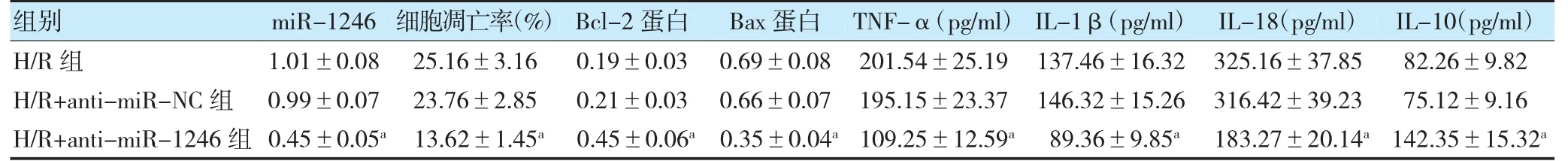
表2 抑制miR-1246 对H/R 处理PC12 细胞损伤的影响(,n=3)
注 与H/R+anti-miR-NC 组比较,aP<0.05。H/R:缺氧/复氧;Bcl-2:B 淋巴细胞瘤-2;Bax:B 淋巴细胞瘤-2 关联x 蛋白;TNF-α:肿瘤坏死因子-α;IL:白细胞介素
图4 抑制miR-1246 对H/R 处理PC12 细胞凋亡的影响
2.5 过表达miR-1246 逆转异丙酚对H/R 处理PC12细胞损伤的影响
H/R+异丙酚组与H/R+异丙酚+miR-NC 组miR-1246 水平、细胞凋亡率、Bcl-2 蛋白、Bax 蛋白、TNF-α、IL-1β、IL-18、IL-10 水平比较,差异无统计学意义(P>0.05)。与H/R+异丙酚+miR-NC 组比较,H/R+异丙酚+miR-1246 组miR-1246 表达水平、细胞凋亡率、Bax 蛋白及TNF-α、IL-1β、IL-18 水平升高,Bcl-2 蛋白和IL-10 水平降低(P<0.05)。见图5,表3。
表3 miR-1246 过表达逆转了异丙酚对H/R 处理PC12 细胞损伤的影响(,n=9)
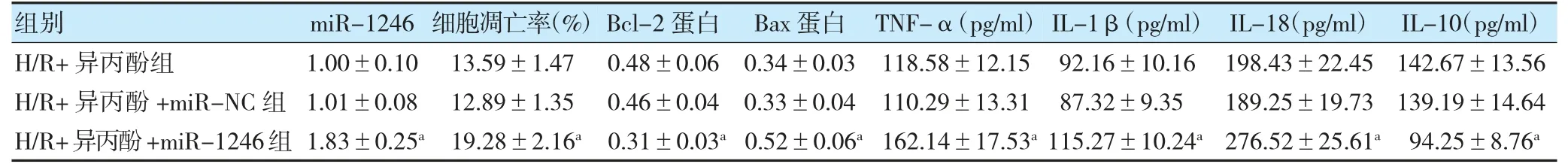
表3 miR-1246 过表达逆转了异丙酚对H/R 处理PC12 细胞损伤的影响(,n=9)
注 与H/R+异丙酚+miR-NC 组比较,aP<0.05。H/R:缺氧/复氧;Bcl-2:B 淋巴细胞瘤-2;Bax:B 淋巴细胞瘤-2 关联x 蛋白;TNF-α:肿瘤坏死因子-α;IL:白细胞介素
图5 过表达miR-1246 逆转了异丙酚对H/R 处理PC12 细胞凋亡的影响
3 讨论
PC12 细胞具有神经细胞的一般特征,广泛应用于神经生理和神经药理学研究,且近年来多被用于在细胞水平模拟临床脑卒中过程[11-12]。在本研究,H/R 处理PC12 细胞,诱导细胞凋亡和炎症反应。另外,异丙酚通过降低miR-1246 表达抑制H/R 诱导的PC12 细胞凋亡和炎症反应,这为异丙酚治疗脑卒中提供了新的证据。
研究表明,异丙酚可减轻多种细胞损伤,具有抑制炎症反应和凋亡等作用[13]。既往的研究显示,异丙酚处理可缓解细胞炎症和凋亡[14-15],并改善肾缺血/再灌注损伤[16]。此外,异丙酚可减轻人脐静脉内皮细胞的炎症和凋亡[17],并缓解大鼠肠缺血/再灌注损伤[18]及减轻H/R 诱导的肝细胞损伤[19]。本研究指出,异丙酚提高了H/R 处理PC12 细胞的存活率,降低了细胞凋亡和炎症反应。这些结果显示,异丙酚可缓解H/R诱导的PC12 细胞损伤,提示异丙酚可能用于脑卒中的治疗。
miR-1246 在细胞损伤相关疾病中可发挥促进作用。在脂多糖诱导的小鼠成软骨细胞ATDC5 中,下调miR-1246 则可减轻细胞的炎症损伤[20]。沉默miR-1246 可抑制脂多糖诱导肺微血管内皮细胞凋亡和炎症因子的产生[21]。这些结果表明,miR-1246 可能具有促炎和促凋亡作用。本研究结果显示,H/R 处理PC12 细胞中miR-1246 表达升高。功能分析结果显示,抑制miR-1246 表达可以减轻H/R 诱导的PC12 细胞损伤,这与前人报道miR-1246 的功能是一致的[20-21]。
近年来,越来越多研究发现,异丙酚可通过调控相关miRNA 的表达来缓解多种细胞损伤。例如,异丙酚可通过抑制miR-449a/miR-494 表达减轻心肌细胞损伤[22-23]。异丙酚可通过调控miR-20b-5p 抑制H/R诱导的人脐静脉内皮细胞死亡[24],并通过上调miR-153缓解缺氧诱导的PC12 细胞神经损伤[25]。本研究显示异丙酚可降低miR-1246 表达水平,且过表达miR-1246逆转了异丙酚对H/R 诱导PC12 细胞损伤的影响,这提示异丙酚通过调控miR-1246 表达减轻H/R 诱导的PC12 细胞损伤。
综上所述,本研究显示,在H/R 诱导的脑卒中细胞损伤模型中,异丙酚可通过下调miR-1246 缓解H/R 诱导的PC12 细胞凋亡和炎症。这些发现为异丙酚治疗脑卒中提供了新的证据。



