孙兴华 于 涛 张学新 常鸿艳 洪月光 李伟伟
1.河北省秦皇岛市中医医院肿瘤科,河北秦皇岛 066000;2.潍坊医学院生命科学与技术学院,山东潍坊 261053;3.河北省秦皇岛市中医医院心血管内科,河北秦皇岛 066000;4.河北省秦皇岛市妇幼保健院生殖医学科,河北秦皇岛 066000
前列腺癌是危害全世界男性健康的最常见恶性肿瘤之一[1]。炎症在多种人类肿瘤包括前列腺癌的发生、促进和发展中起重要的作用[2]。脂多糖(lipopolysaccharide,LPS)是革兰氏阴性菌外膜的主要成分,LPS的识别与跨膜信号转导,是引起细胞炎症效应的关键。有研究显示,长期慢性炎症反应的发生是非小细胞肺癌、胃癌和宫颈癌发生的重要致病因素[3-6]。感染及炎症与前列腺癌的关系密不可分,革兰氏阴性杆菌的反复感染是慢性前列腺炎发病的重要原因,增加了PCa细胞的增殖能力、迁移能力及局部侵袭能力[7-8]。前列腺六段跨膜上皮抗原(six-segment transmembrane epithelial antigen of prostate,STEAP)家族参与多种生物学过程,包括增殖和炎症,在癌症治疗中发挥潜在作用[9]。STEAP4 是STEAP 家族成员之一,参与乳腺癌和膀胱癌的发展,并与结肠癌的炎症有关[10-12]。另有研究表明,STEAP4 在前列腺癌组织中高度表达,并且相关性分析得出STEAP4 高表达的患者比低表达的患者其前列腺癌复发的时间更快,可作为前列腺癌患者的预后指标[13]。然而,STEAP4 在前列腺癌发展中的作用和相关机制仍不清楚。本研究旨在探讨STEAP4 对LPS 诱导的前列腺癌细胞增殖的影响,可能为前列腺癌的治疗提供新思路。
1 材料与方法
1.1 细胞培养与处理
人前列腺癌细胞系PC3(货号:CRL-1435)和VCaP(货号:CRL-2876)由ATCC 提供,并在含有10%胎牛血清(Gibco,美国)和1%青霉素/ 链霉素的DMEM(赛默飞世尔科技公司,中国)中于37℃、5%CO2条件下培养。参照Xu 等[14]研究,将PC3 和VCaP细胞暴露于1 μg/ml 的LPS(索莱宝,北京)中孵育24 h诱导炎症环境。
1.2 细胞转染
采用Lipofectamine 2000(赛默飞世尔科技公司,中国)将沉默载体(si-STEAP4 及其对照si-con)转染进入细胞。经48 h 转染后,观察细胞生长情况,收集细胞用于进一步研究。STEAP4 的siRNA(si-STEAP4:5’-AUCUUACAAGUUUUCUCCAU-3’)和siRNA 阴性对照(si-con:5’-AGACAUGUGUGUGUCCGCCTT-3’)购自GenePharma(上海)。实验重复3 次,设3个复孔。将细胞分为对照组、LPS 处理组、转染对照组(LPS+si-con)和转染沉默组(LPS+si-STEAP4)。
1.3 蛋白免疫印迹
采用放射免疫沉淀法测定蛋白浓度,根据光密度(optical density,OD)值从标准曲线中计算蛋白的浓度。根据蛋白浓度计算上样量。本研究实验的样品量为20 μl,上样量为30 μg。临用前加入最终的样品缓冲液:2%SDS、100 mmol/L DTT、60 mmol/L Tris(pH 6.8)、0.01%溴酚蓝和10%甘油。在电极(正极)上依次叠放PVDF 膜和凝胶。转膜结束,将膜浸入封闭液(含5%脱脂奶粉的TBS)中缓慢振荡后洗涤。抗STEAP4(cat.No.PA5-106509,1∶1 000 稀释度,赛默飞世尔科技公司);环鸟苷酸(cyclic guanosine monophosphate,cGMP)(cat.No.#A11070,1∶1000 稀释度,赛默飞世尔科技公司);抗-cGMP 依赖性蛋白激酶(cGMP-dependent protein kinase,PKG)1(cat.No.#3248,1∶1 000 稀释度,Cell Signaling Technology)、抗-PKG2(cat.No.PA5-116863,1∶1 000 稀释度,赛默飞世尔科技公司)、抗血管扩张剂刺激磷酸蛋白(vasodilator stimulated phosphoprotein,VASP)(cat.No.ab109321,1∶1 000 稀释度,Abcam)、抗磷酸化VASP(p-VASP,ab218619,1∶1 000 稀释度,Abcam)、抗β-actin(cat.No.ab8227,1∶2 000 稀释度,Abcam),4℃缓慢振荡过夜;加HRP标记的二抗(1∶12 000 稀释),室温缓慢振荡2 h 后洗涤;以β-action 作为内参,采用Quantity One 软件将条带转化为灰度值,蛋白表达量=目的条带灰度值/内参条带灰度值。实验重复3 次。
1.4 采用酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)检测细胞因子的含量
取对数生长期的PC3 和VCaP 细胞,以2×107/L接种于6 孔板中,每孔2 ml,细胞贴壁后按照分组进行处理。用si-con 或si-STEAP4 转染PC3 和VCaP 细胞。转染24 h 后,用1 μg/ml LPS 另外再处理细胞24 h。收集上清液于4℃、4 000 r/min 离心10 min(离心半径10 cm)。按照ELISA 试剂盒白细胞介素(interleukin,IL)-6(cat.No.KHC0061)、IL-8(cat.No.KHC0081)和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)(cat.No.MS223-4)说明书操作,检测上清液中IL-6、IL-8 和TNF-α 含量。实验重复3 次,设3 个复孔。
1.5 CCK-8 法检测细胞存活率
将PC3 和VCaP 细胞(1×104/ 孔)接种至96 孔板。经LPS 处理后,加入10 μl 的CCK-8 试剂(Beyotime)并孵育4 h。使用SpectraMax iD5 微板读取器(Molecular Devices,Sunnyvale,CA)检测450 nm 处的OD 值。实验重复3 次,设3 个复孔。
1.6 EdU 染色
将PC3 和VCaP 细胞(5×105/孔)接种至6 孔板,用si-con 或si-STEAP4 转染PC3 和VCaP 细胞。转染24 h 后,用1 μg/ml LPS 另外再处理细胞24 h。根据操作说明书使用EdU 检测试剂盒(Abcam)进行孵育。使用DAPI(Beyotime)将细胞核进行染色,在荧光显微镜下观察细胞。细胞增殖以总细胞中EdU 阳性细胞的百分比来表示。实验重复3 次。
1.7 统计学方法
采用GraphPad Prism 8 统计学软件进行数据分析。计量资料采用均数±标准差(±s)表示,比较采用t 检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 LPS 处理后各组前列腺癌细胞中STEAP4 蛋白表达水平的变化
LPS 处理组PC3 和VCaP 细胞的STEAP4 蛋白表达水平显着高于对照组,差异有统计学意义(P<0.05);LPS 处理组PC3 和VCaP 细胞的STEAP4 的表达水平与转染对照组比较,差异无统计学意义(P>0.05);转染沉默组PC3 和VCaP 细胞的STEAP4 的表达水平显着低于转染对照组,差异有统计学意义(P<0.05)。见图1。
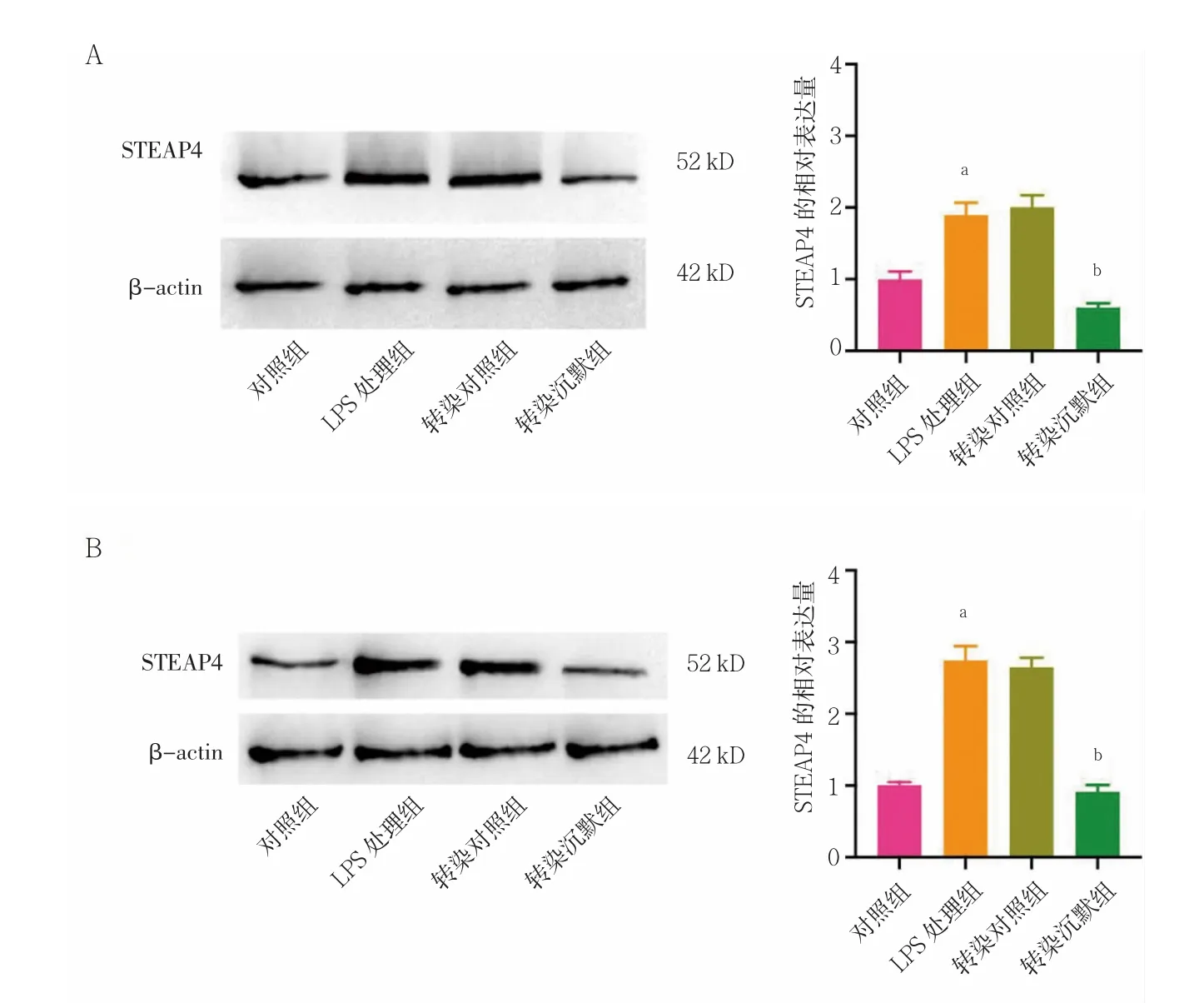
图1 LPS 处理后各组细胞中STEAP4 蛋白表达水平的变化(n=3)
2.2 STEAP4 敲除对LPS 诱导的各组前列腺癌细胞的炎症反应的影响
LPS 处理组PC3 和VCaP 细胞的IL-6、IL-8 和TNF-α 的表达水平显着高于对照组,差异有统计学意义(P<0.05);LPS 处理组和转染对照组PC3 和VCaP细胞的IL-6、IL-8 和TNF-α 的表达水平比较,差异无统计学意义(P>0.05);转染沉默组PC3 和VCaP 细胞的IL-6、IL-8 和TNF-α 的表达水平显着低于转染对照组,差异有统计学意义(P<0.05)。见图2。
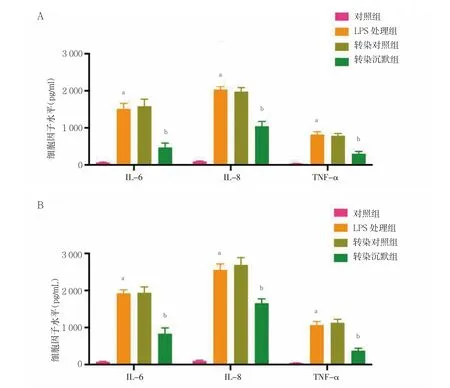
图2 STEAP4 敲除对LPS 诱导的各组前列腺癌细胞的炎症反应的影响(n=3)
2.3 STEAP4 敲除对LPS 诱导的各组前列腺癌细胞增殖的影响
LPS 处理组PC3 和VCaP 细胞24、48、72 h 的增殖活力显着高于对照组,差异有统计学意义(P<0.05);LPS 处理组和转染对照组PC3 和VCaP 细胞24、48、72 h 的增殖活力比较,差异无统计学意义(P>0.05);转染沉默组PC3 和VCaP 细胞24、48、72 h 的增殖活力均低于转染对照组,差异有统计学意义(P<0.05)LPS 处理组PC3 和VCaP 细胞的增殖活力显着高于对照组,差异有统计学意义(P<0.05);LPS 处理组和转染对照组PC3 和VCaP 细胞的增殖活力比较,差异无统计学意义(P>0.05);转染沉默组PC3 和VCaP 细胞的增殖活力显着低于转染对照组,差异有统计学意义(P<0.05)。见图3。
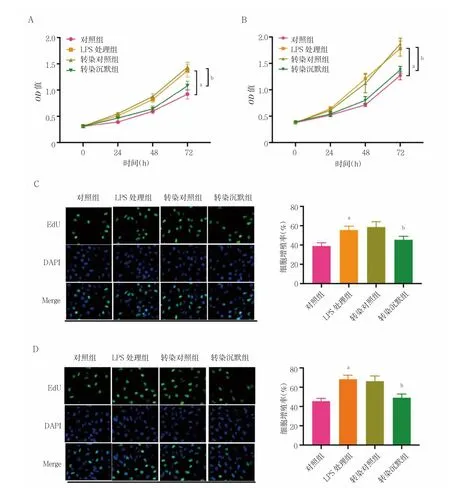
图3 STEAP4 敲除对LPS 诱导的各组前列腺癌细胞增殖的影响(n=3)
2.4 STEAP4 敲低对LPS 诱导的前列腺癌细胞中cGMPPKG 信号途径的影响
LPS 处理组PC3 和VCaP 细胞中cGMP、PKG1、PKG2 和pVASP/VASP 的相对表达量显着低于对照组,差异有统计学意义(P<0.05);转染对照组和LPS处理组PC3 和VCaP 细胞中cGMP、PKG1、PKG2 和pVASP/VASP 的相对表达量比较,差异无统计学意义(P>0.05);转染沉默组的PC3 和VCaP 细胞中cGMP、PKG1、PKG2 和pVASP/VASP 的相对表达量显着高于转染对照组,差异有统计学意义(P<0.05)。见图4。
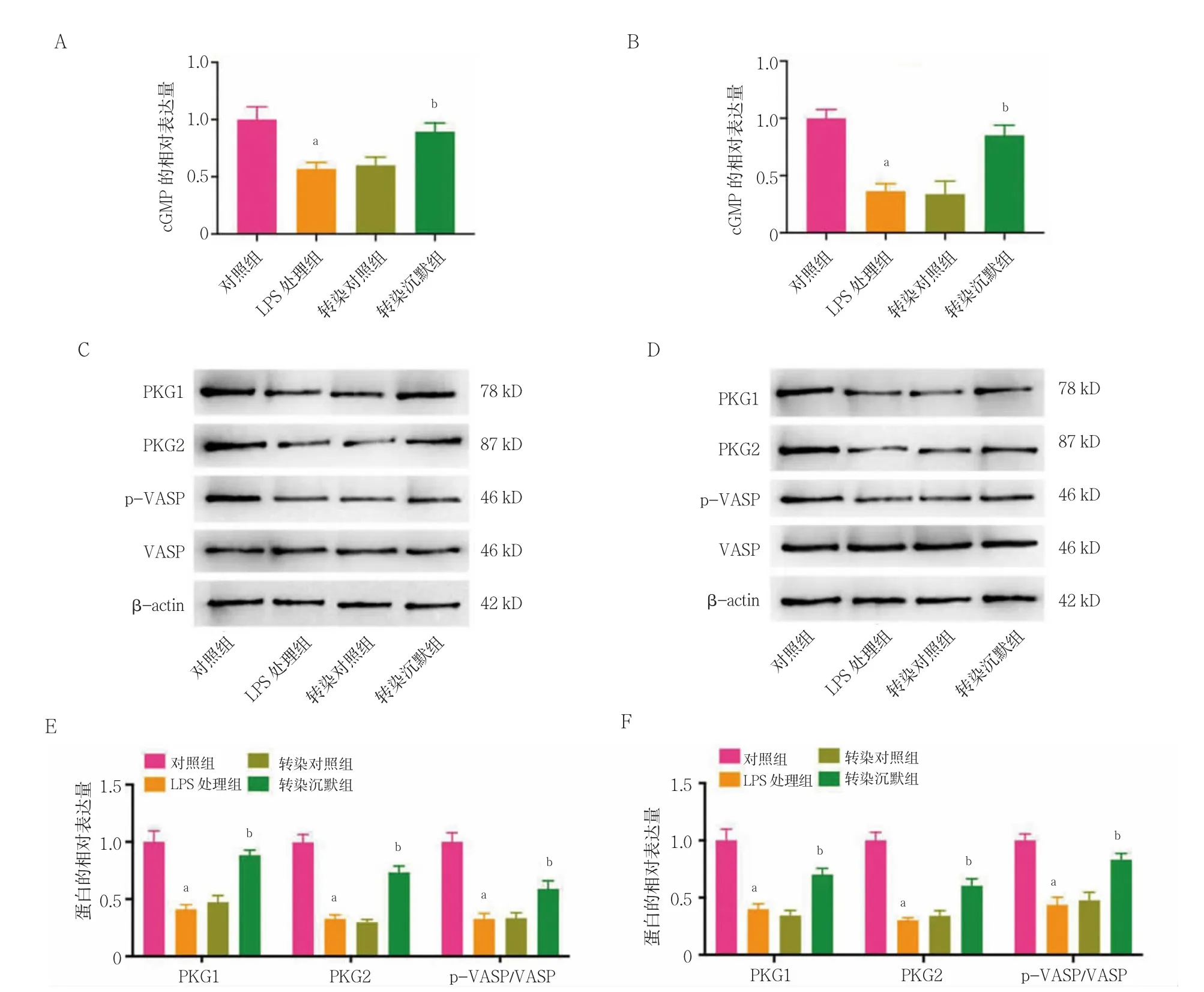
图4 STEAP4 敲低对LPS 诱导的前列腺癌细胞中cGMP-PKG 信号途径的影响(n=3)
3 讨论
前列腺癌是世界范围内男性发病率排名第二的恶性肿瘤[15]。近年研究报道,在前列腺癌组织中能观察到慢性炎症反应,被认为是前列腺癌进展的驱动因素之一[16]。另有研究报道,感染及炎症与前列腺癌的关系是密不可分的,革兰氏阴性杆菌的反复感染是慢性前列腺炎发病的重要原因,并且大量证据表明,感染促进了前列腺癌的发展和转移[17-18]。LPS 作为革兰氏阴性菌的主要化合物,能够激活免疫细胞产生多种细胞因子和后续的炎症反应[19]。有研究显示,LPS 可增加前列腺癌细胞增殖的能力、迁移的能力及局部侵袭的能力,增加了癌细胞的恶性程度[20]。STEAP 家族在前列腺癌中发挥重要作用。既往研究表明,STEAP4 是受炎症细胞因子调节的靶点[21-22];此外研究表明,在炎症相关环境下STEAP4 在结肠癌的发展中起重要作用[12]。目前,STEAP4 在炎症环境下对前列腺癌发展的影响的相关研究鲜见报道。
本实验采用LPS 诱导前列腺癌模拟炎症环境,结果显示,LPS 处理后的前列腺癌细胞的增殖能力升高,STEAP4 蛋白的表达水平升高,差异有统计学意义(P<0.05)。转染si-STEAP4 敲低STEAP4 能够抑制炎症条件下前列腺癌的细胞增殖及炎症因子的水平,差异有统计学意义(P<0.05)。另外EdU 染色分析结果显示,LPS 能够促进细胞增殖,而STEAP4 沉默逆转了这一效应。以上结果显示,STEAP4 敲低可减轻LPS 诱导的前列腺癌增殖,提示STEAP4 在前列腺癌治疗中的潜力。
本研究进一步探索了STEAP4 在前列腺癌中介导的下游途径,并发现其可能与cGMP-PKG 信号传导有关。cGMP 参与多个信号转导过程,有研究表明,PKG2 可以抑制许多肿瘤的细胞增殖,如结肠癌、黑色素瘤和卵巢癌[23-25]。既往研究表明,cGMP-PKG 信号的激活有助于减少前列腺癌中的细胞增殖[26]。本研究显示,在LPS 存在的情况下,cGMP-PKG 通路在前列腺癌中失活。本研究仍存在不足,今后仍需要进行体内实验以进一步研究STEAP4 的潜在功能。
综上所述,STEAP4 下调能够抑制LPS 诱导的前列腺癌的增殖。本研究为炎症环境下前列腺癌的进展提供了新的见解,并指出了治疗前列腺癌的潜在靶点。



