唐奇远,吴晓娟,赖晓娟,赖长祥,李知玉,周 旋,王 方
(深圳市第三人民医院肝病二科,广东 深圳 518000)
乙型肝炎病毒(hepatitisBvirus,HBV)感染仍是目前最主要的公共卫生问题之一,全世界约有2.4亿HBV 感染者,每年约有65 万人死于HBV 感染所致的肝衰竭、肝硬化或肝癌[1]。抗病毒治疗可延缓HBV 相关疾病的进展,减少肝硬化、肝衰竭、肝癌的发生及相关死亡。根据我国最新指南,对于慢性HBV 感染者,血清HBV DNA 阳性,ALT 持续升高(>ULN)排除其他原因所致,建议进行抗病毒治疗[2]。目前主要的抗病毒药物包括核苷(酸)类似物(nucleoside analogues,NAs)和干扰素(interferon,IFN)两类。NAs 通过抑制逆转录过程抑制HBV的复制,大部分慢性乙型肝炎患者通过NAs 治疗可出现病毒学应答及生化学应答,但药物作用时间较短,仅在用药期间发挥作用,停药后容易出现病毒学复发[3-5]。IFN 则有直接抗病毒和免疫调节两方面作用,IFN通过加速前基因组HBV RNA 降解而抑制HBV 复制,同时也通过激活NK 细胞、促进TNF、IFN-γ 等分泌发挥免疫调节作用;IFN 持续时间较长,停药后仍可继续发挥免疫调控作用,疗程较短[3-5]。由于两者不同机制,理论上IFN 与NAs 联合治疗可能发挥协同作用。但目前对两者是否应联合应用尚存争议,基于此,本研究拟分析Peg-IFNa-2b 单药与Peg-IFNa-2b 联合NAs 治疗HBeAg 阳性慢性乙型肝炎(chronichepatitis B,CHB)的疗效,现报道如下。
1 资料与方法
1.1 资料与方法 收集2017 年1 月-2020 年12 月就诊于深圳市第三人民医院的HBeAg 阳性CHB 初治患者共69 例,根据治疗方案分为单药治疗组(30例)和联合治疗组(39 例)。两组年龄、性别及HBV DNA 水平比较,差异无统计学意义(P>0.05),具有可比性,见表1。本研究经深圳市第三人民医院伦理委员会批准,批号:2018-(087)。患者及其家属自愿参与并签署知情同意书。
表1 两组基线资料比较[n(%),]

表1 两组基线资料比较[n(%),]
1.2 纳入与排除标准 纳入标准:①符合《慢性乙型肝炎防治指南(2019 年版)》中的慢性乙型肝炎诊断标准;②HBeAg 阳性;③ALT>1ULN;④年龄18~60岁;⑤Peg-IFNa-2 单药治疗≥48 周,或Peg-IFNa-2联合NAs(恩替卡韦ETV 或替诺福韦TDF)治疗≥48 周;⑥启动治疗时为CHB 初治;⑦在本院HIS 系统中可查到完整病例资料。排除标准:①合并其他肝病:其他肝炎病毒性(HAV、HCV、HDV、HEV)感染、自身免疫性肝病、酒精性肝病、遗传代谢性肝病;②伴有肝衰竭、肝硬化、肝癌或其他系统肿瘤。
1.3 药物及剂量 单药治疗组采用Peg-IFNa-2b(厦门特宝生物工程股份有限公司,国药准字S20174006,规格:135 μg/支或180 μg/支)治疗,1次/周;联合治疗组在此基础上联合恩替卡韦(中美上海施贵宝制药有限公司,国药准字H20052237,规格:0.5 mg/片;苏州东瑞制药有限公司,国药准字H20100129,规格:0.5 mg/片)或富马酸替诺福韦二吡呋酯片(葛兰素史克<天津>有限公司,国药准字H20130589,规格:300 mg/片;齐鲁制药有限公司,国药准字H20173185,规格:0.3 g/片)治疗,恩替卡韦用量为0.5 mg/次,1 次/d;富马酸替诺福韦二吡呋酯片用量为300 mg/次,1 次/d。
1.4 观察指标 收集两组治疗基线、12 周、24 周、48周的乙肝五项、HBV DNA、ALT、eGFR 等指标,比较两组HBV DNA 转阴率、HBeAg 转阴率、HBsAg 下降值、ALT 复常率及eGFR 变化。
1.5 统计学方法 应用SPSS 22.0 统计软件对原始数据进行统计分析。符合正态分布的计数资料用()表示,两组间比较采用独立样本t检验;不符合正态分布的计数资料先进行log10对数转换后再采用()表示,两组间比较采用独立样本t检验;计数资料采用[n(%)]表示,两组间比较采用χ2检验。P<0.05 为差异有统计学意义。
2 结果
2.1 两组HBV DNA 转阴率比较 治疗12 周,两组HBV DNA 转阴率比较,差异无统计学意义(P>0.05);治疗24 周、48 周,联合治疗组HBV DNA 转阴率高于单药治疗组,差异有统计学意义(P<0.05),见表2。
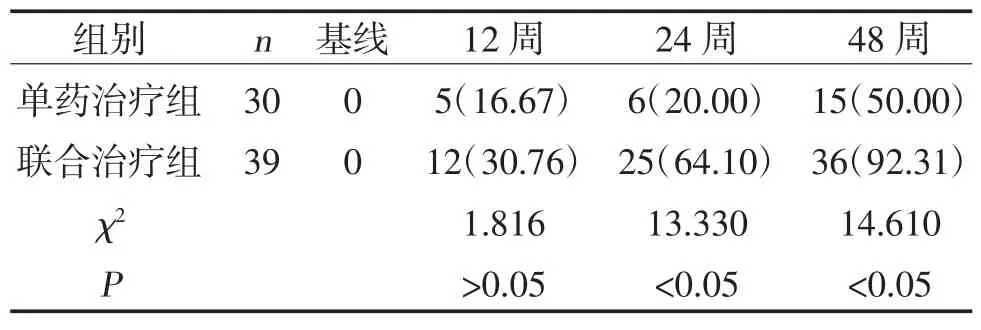
表2 两组HBV DNA 阴转率比较[n(%)]
2.2 两组HBeAg 转阴率比较 治疗12、24、48 周,两组HBeAg 转阴率比较,差异无统计学意义(P>0.05),见表3。
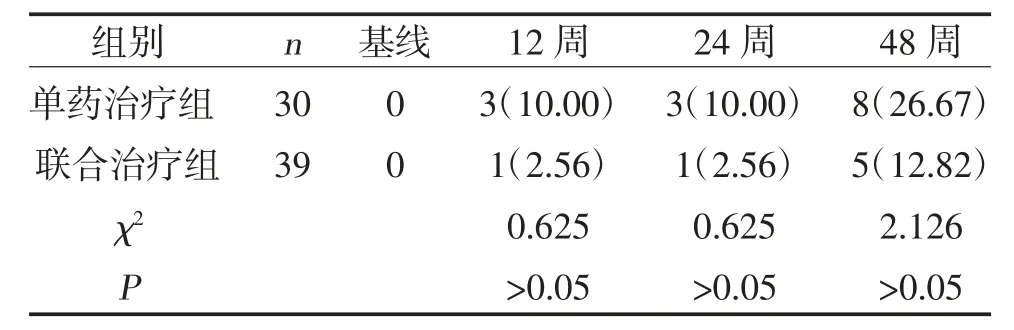
表3 两组HBeAg 转阴率比较[n(%)]
2.3 两组HBsAg的动态变化比较 治疗12、24、48周,两组HBsAg 水平及HBsAg 下降值比较,差异无统计学意义(P>0.05),见表4。
表4 两组HBsAg的动态变化比较(,logIU/ml)
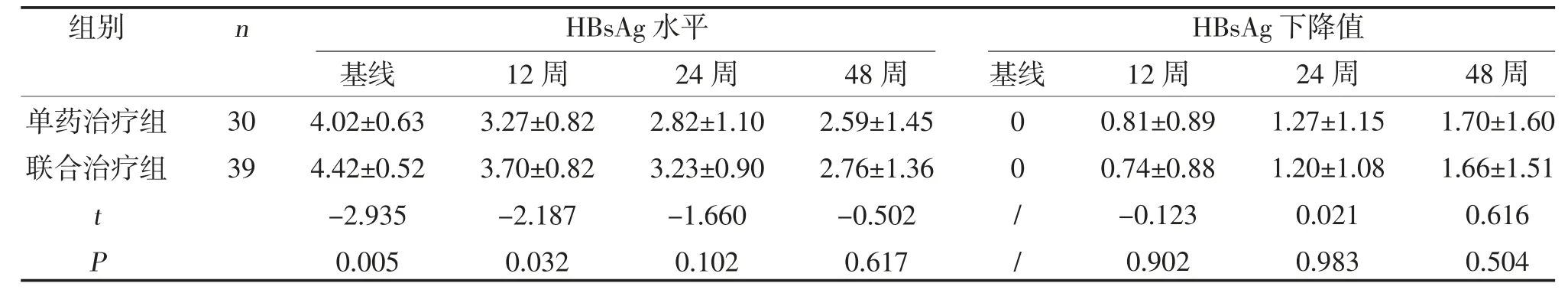
表4 两组HBsAg的动态变化比较(,logIU/ml)
2.4 两组ALT 水平及复常率比较 治疗12、24、48周,两组ALT 水平及ALT 复常率比较,差异无统计学意义(P>0.05),见表5。
表5 两组ALT 水平及复常率比较[,n(%)]
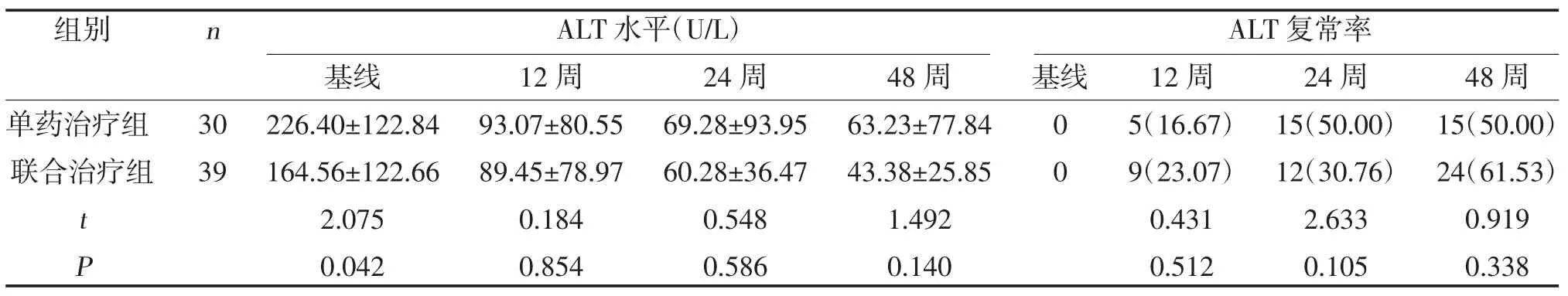
表5 两组ALT 水平及复常率比较[,n(%)]
2.5 两组eGFR 变化比较 两组eGFR 变化比较,差异无统计学意义(P>0.05),见表6。
表6 两组eGFR 变化比较(,ml/min)
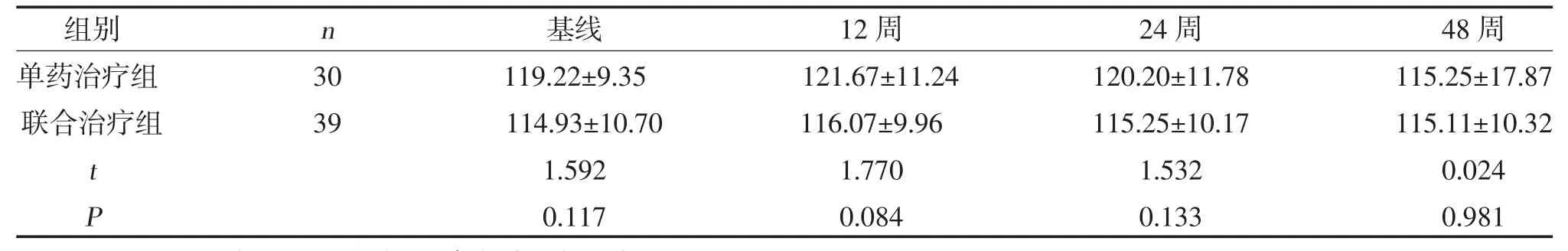
表6 两组eGFR 变化比较(,ml/min)
3 讨论
慢性乙型肝炎抗病毒治疗的目的是通过持续抑制病毒,达到持续病毒学应答甚至HBV 清除的结果。NAs 和IFN 是国内外指南推荐的两类一线抗病毒药物。NAs 通过与细胞内源的dNTP 竞争结合抑制P 蛋白的活性来抑制新HBV DNA 链的合成[6],但由于细胞内大量dNTP的存在,NAs 并不能完全抑制HBV 复制及阻止新感染肝细胞中cccDNA 形成[7],因此需长期NAs 治疗以降低停药后复发的风险。IFN 一方面通过加速前基因组HBV RNA 降解而抑制HBV 复制[8];另一方面通过调节天然免疫因子,如NK 细胞、TNF、IFN-γ 等发挥免疫调节作用[9]。由于两者作用机制不同,理论上两者联合治疗CHB可提高抗病毒的效果。
本研究比较了NAs 联合Peg-IFNa-2b 与Peg-IFNa-2b 单药治疗HBeAg 阳性慢性乙型肝炎的疗效差异,结果提示联合治疗组有更好的HBV DNA阴转率,与Lin S 等[10]的研究结果基本一致。治疗过程中HBsAg 下降是评估疗效的另一重要指标。IFN与NAs 联合治疗是否能加快HBsAg的清除,目前研究尚缺乏统一认识。Marcellin P 等[11]研究发现,与IFN 单药治疗相比,初始联合IFN 和NAs 治疗HBeAg 阴性CHB 并未加快48 周HBsAg的下降程度。Tangkijvanich P 等[12]研究发现,ETV+Peg-IFNa 可增加HBsAg 下降程度及HBsAg 清除率。还有研究发现,联合治疗虽可提高病毒学应答率,却并未改善HBsAg 水平。本研究中,联合治疗并未降低HBsAg水平。可能原因为:①基线病毒学不同:本研究中联合治疗组HBsAg 基线水平高于单药治疗组,可能是导致联合治疗组HBsAg 下降并未优于Peg-IFNa-2b单药治疗的原因;②联合NAs 并不能改善HBeAg阳性患者的HBsAg 水平和HBsAg 阴转。
综上所述,Peg-IFNa-2b 联合NAs 治疗可提高HBeAg 阳性的慢性乙型肝炎的病毒学应答率,对临床上高病毒载量的CHB 患者,为尽快达到HBV DNA 阴转可予IFN 联合NAs 治疗。



