常胜 相宏飞 魏嘉豪 刘勇
[摘要] 目的
探讨腰椎单纯斜外侧入路椎间融合术(OLIF)后椎间融合器沉降的相关影响因素。
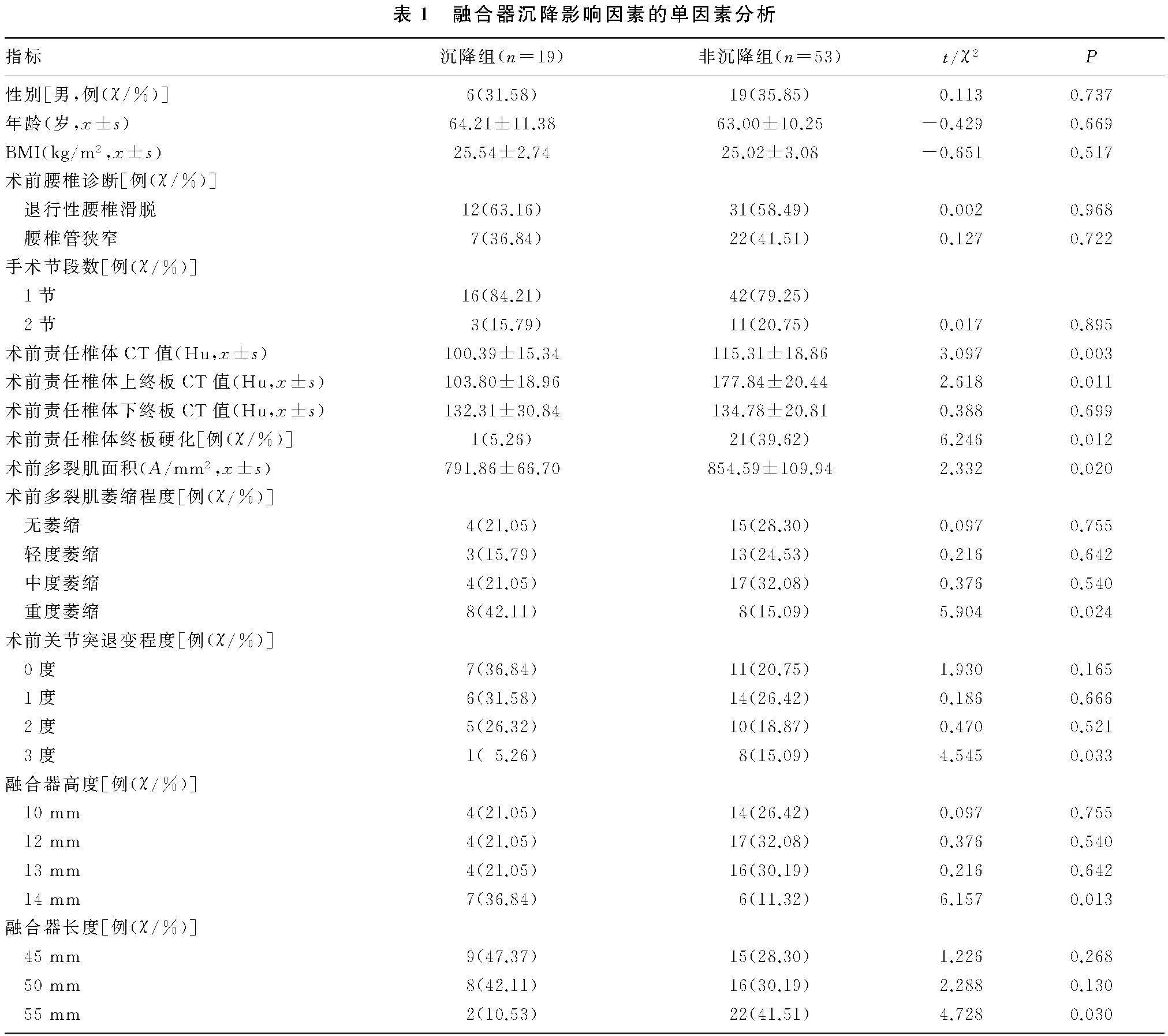
方法 选择2019年1月—2023年1月于我院择期行腰椎单纯OLIF患者65例(72个腰椎节段),根据椎间隙高度下降程度将患者手术腰椎节段分为沉降组(19段)和非沉降组(53段)。收集并比较两组患者的性别、年龄、体质量指数、手术腰椎节段数、责任椎体终板是否硬化、融合器高度与长度、术前责任椎体及其上下终板CT值、术前责任椎体界面多裂肌面积及多裂肌萎缩程度、术前关节突退变程度等临床资料。通过logistic回归分析融合器沉降的影响因素。
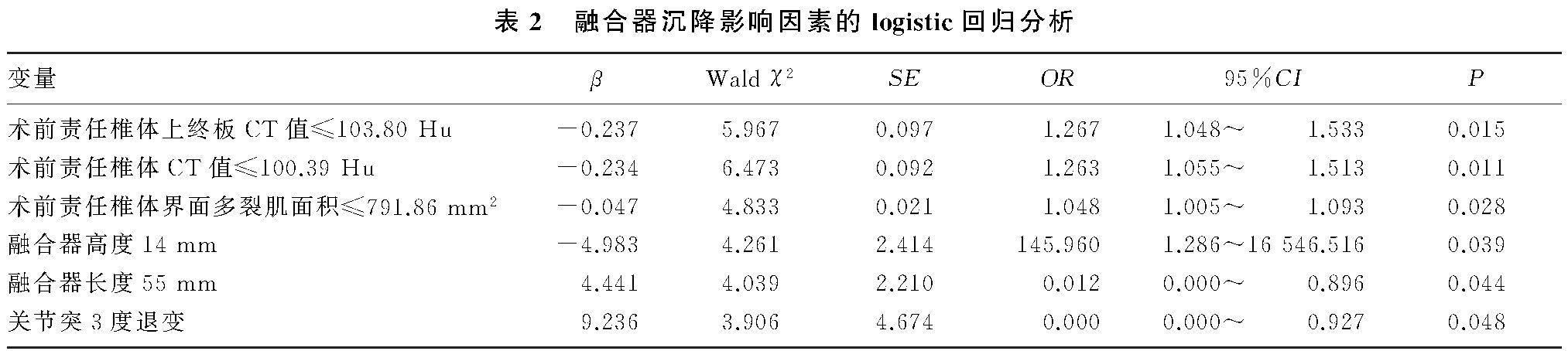
结果 两组的术前责任椎体CT值及上终板CT值、术前责任椎体终板硬化患者构成比、术前责任椎体界面多裂肌面积、术前多裂肌重度萎缩患者构成比、融合器高度14 mm患者构成比、融合器长度55 mm患者构成比、术前关节突3度退变患者构成比间比较差异显着(t=2.332~3.097,χ2=4.545~6.246,P<0.05)。Logistic回归分析结果显示,术前责任椎体CT值≤100.39 Hu、术前责任椎体上终板CT值≤103.80 Hu、术前多裂肌面积≤791.86 mm2和融合器高度为14 mm是融合器沉降的危险因素(P<0.05),融合器长度为55 mm、术前关节突3度退变是融合器沉降的保护因素(P<0.05)。
结论 拟行腰椎单纯OLIF的患者临床应重点关注术前责任椎体及其上终板CT值、责任椎体界面多裂肌面积、关节突退变等情况,同时选择合适型号的椎间融合器,从而降低术后椎间融合器沉降的发生风险。
[关键词] 腰椎;脊柱融合术;内固定器;影响因素分析
[中图分类号] R681.5 [文献标志码] A
椎间融合术是目前腰椎退行性疾病经典而有效的手术方法[1],按其手术入路不同可分为前路融合术、后路融合术、经椎间孔入路融合术、直接外侧入路椎间融合术/极外侧入路椎间融合术和斜外侧入路椎间融合术(OLIF)等,每种入路都有其优缺点。相较于传统后路融合术,OLIF具备微创、出血少、康复快,不损伤后方肌肉、韧带和骨性结构的特点。同时OLIF因能够减少腰大肌、腰丛神经及血管的损伤而被广泛应用于腰椎疾病的治疗。单纯OLIF治疗腰椎退变性疾病也被证明可获得良好临床效果[2-3]。术后融合器沉降被认为是不加内固定的单纯OLIF最常见的并发症之一,融合器发生沉降会导致腰椎融合失败、神经根管狭窄、神经根损伤、长期慢性腰痛等并发症,严重者甚至需要进行二次翻修手术。目前文献对于单纯OLIF融合器沉降的原因及对策进行了多方面探讨,但仍有较大争议,关于椎体-终板界面相关因素、椎旁因素及椎体退变因素与融合器沉降之间的关系目前尚无系统研究报道。本研究回顾性分析了2019年1月—2023年1月我院65例单纯OLIF患者的病历资料,探讨了单纯OLIF术后影响椎间融合器沉降的相关因素,以求为脊柱外科医生的围术期临床决策提供参考。
1 资料与方法
1.1 一般资料
选择2019年1月—2023年1月于我院择期行单纯OLIF的患者65例。患者纳入标准:①手术水平在L2~L5腰椎,且操作为单节段或双节段水平者;②术中置入融合器材料(聚醚醚酮融合器,北京Naton公司)相同者;③围术期及术后6个月回访病历资料完整者。排除标准:①接受联合/附加腰椎间融合术或附加后路直接减压术者;②既往有腰椎内固定或注射骨水泥者;③手术病变椎体(后文简称责任椎体)终板损伤者。
收集患者的临床资料,包括性别、年龄、体质量指数(BMI)、术前腰椎疾病诊断、手术节段数、术后1周及术后6个月时的椎间隙高度(DH)、术前责任椎体及其上下终板CT值[4]、术前责任椎体界面多裂肌萎缩程度及多裂肌面积[5]、术前责任椎体终板是否硬化、术前关节突退变程度、融合器高度及长度。上述指标中需要测量的数据(如CT值、多裂肌面积等)均由两名经验丰富的外科医生独立进行,以两次测量的平均值为取值标准。依据KIM等[6]制定的椎间融合器沉降评估标准,通过对术后1周或术后6个月时患者DH下降程度的评估,将患者的手术腰椎节段分为沉降组(DH下降>2 mm,19段)和非沉降组(DH下降≤2 mm,53段)。
1.2 统计学方法
采用SPSS(26.0)软件对数据进行统计学分析。符合正态分布的计量资料以[AKx-D]±s表示,组间比较采用t检验。计数资料以例(率)表示,组间比较采用χ2检验。对于两组之间具有统计学差异的指标进行logistic回归分析。以P<0.05为差异具有统计学意义。
2 结 果
2.1 两组患者的临床资料比较
所有患者均顺利完成手术,共有19例患者出现椎间融合器沉降,沉降率为25.39%。两组的术前责任椎体CT值、术前责任椎体上终板CT值、术前责任椎体界面终板硬化患者构成比、术前责任椎体界面多裂肌面积、术前多裂肌重度萎缩患者构成比、术前关节突3度退变患者构成比、融合器高度14 mm患者构成比、融合器长度55 mm患者构成比差异显着(t=2.332~3.097,χ2=4.545~6.246,P<0.05)。见表1。
2.2 影响融合器沉降的多因素logistic回归分析
以单因素分析中差异显着的指标为自变量,以患者融合器沉降为因变量,自变量赋值如下:术前责任椎体CT值(≤100.39 Hu=1而>100.39 Hu=0)、术前责任椎体上终板CT值(≤103.80 Hu=1而>103.80 Hu=0)、术前责任椎体界面多裂肌面积(≤791.86 mm2=1而>791.86 mm2=0)、多裂肌重度萎缩(是=1而否=0)、术前责任椎体终板硬化(是=1而否=0)、关节突关节3度退变(是=1而否=0)、融合器高度14 mm(是=1而否=0)、融合器长度55 mm(是=1而否=0)。Logistic回归分析结果显示,术前责任椎体CT值≤100.39 Hu、术前责任椎体上终板CT值≤103.80 Hu、术前责任椎体界面多裂肌面积≤791.86 mm2以及融合器高度14 mm均为融合器沉降的危险因素,而关节突3度退变和融合器长度55 mm为融合器沉降的保护因素。见表2。
3 讨 论
椎间融合器沉降是OLIF后最常见的并发症之一,其可能导致进行性脊柱畸形、神经系统恶化和腰椎不融合等一系列疾病的发生[7-8]。KIM等[6]研究认为DH降低超过2 mm即为融合器沉降的判断标准,此标准目前在临床得到较为广泛的应用。本研究中符合此标准的OLIF后椎间融合器沉降率约为
25.39%,与既往研究报道的结果较为一致[7,9-10]。
决定椎间融合器沉降发生与否的先决条件是椎间融合器-椎体终板界面的应力和支撑强度是否均衡[11]。与融合器直接接触的界面为责任椎体及其上下终板,本研究结果显示沉降组术前责任椎体CT值及责任椎体上终板CT值均显着低于非沉降组,logistic回归分析结果进一步说明术前责任椎体CT值≤100.39 Hu或者责任椎体上终板CT值≤103.80 Hu是融合器沉降的危险因素。XI等[12]研究也证实了责任椎体CT值降低会增加侧方入路椎间融合术后融合器沉降风险。骨质减少或骨质疏松是目前公认的导致腰椎融合术后融合器沉降的重要危险因素,其诊断金标准是双能X射线骨密度测量法,但肠道内容物、椎体骨赘硬化及其他病变等均可造成椎体骨量测定结果与实际骨量产生偏差[13-14]。CT扫描测量的CT值已被证实与骨密度显着相关,通过针对性选择测量部位获得的CT值为确定局部骨密度提供了有效方法,有利于预测OLIF后椎间融合器沉降的发生,对手术计划的制定能够起指导作用[13,15]。
本研究显示高度14 mm的椎间融合器使用是其沉降的危险因素。融合器高度的选择直接影响DH的恢复,DH的适当恢复不仅有利于黄韧带及后纵韧带的回纳,且有助于腰椎滑脱的复位及其后期稳定,而DH的过度撑开则有可能加大融合器两端终板应力,导致沉降发生。KALIYA-PERUMAL等[16]研究显示,侧方入路椎间融合术术中DH矫正过度与术后早期随访时DH下降有关。STRUBE等[17]则认为术中椎间融合器高度选择应与术前测量的DH匹配,不必追求DH恢复到所谓标准高度。同时,本研究显示使用长度55 mm的椎间融合器是OLIF后融合器沉降的保护因素。大部分学者认为椎间融合器横跨责任椎体终板双侧骨骺长度越长,融合器沉降所需的破坏载荷就越大,这在ZHANG等[18]的生物力学试验中也得到了证明;而融合器越短,表面接触面积越小,责任椎体终板上应力就越大。55 mm长度融合器相较于45、50 mm长度融合器拥有更大的椎体接触面积,其责任椎体终板局部应力小,融合器更不易沉降。
退变因素也影响融合器的沉降。多裂肌是椎旁肌中最内侧和最大的肌肉,其作为后张力带结构为腰椎和椎间盘提供支撑,约占脊柱主动稳定作用的三分之二[19]。当多裂肌退变(面积缩小或脂肪变程度增加)时,椎间融合器相应承担较高压力,更容易发生责任椎体终板破坏和随后的融合器沉降。本研究亦表明责任椎体轴面多裂肌面积≤791.86 mm2是单纯OLIF后融合器沉降的危险因素之一。此外,本研究中关节突3度退变为融合器沉降的保护因素。既往研究显示,关节突关节退变并不会影响OLIF后椎间融合器的间接减压效果[20]。从生物力学角度来讲,关节突关节的主要功能除了引导椎体节段运动外,还承受牵拉、压缩、剪切及扭转等不同类型的荷载。据KALICHMAN等[21]报道,正常情况下3%~25%的椎体节段负荷通过关节突关节传递,但是在退变的关节突关节这一比例则增加到47%[22-23]。椎体后方退变关节突承担更多椎体节段负荷时,前方椎间融合器-椎体终板界面的应力减小,融合器沉降的风险降低。责任椎体界面终板硬化亦为椎间融合器沉降的保护因素之一。OKANO等[24]的一项针对单纯侧方入路椎间融合术后融合器沉降的研究发现,终板炎各时期终板都可出现硬化表现。SUN等[25]通过CT扫描椎体终板也证实终板硬化可出现在终板炎各个时期。终板硬化可增强融合器-椎体终板界面强度,使局部CT值(即代表骨密度)上升,当融合器和椎体间界面有足够强度抵抗机体重力和椎体节段间运动负荷时,即可防止融合器沉降发生[8]。
综上,单纯OLIF患者术前责任椎体CT值≤100.39 Hu、责任椎体上终板CT值≤103.80 Hu、责任椎体界面多裂肌面积≤791.86 mm2,以及使用高度14 mm的椎间融合器均为术后椎间融合器沉降发生的危险因素;而术前关节突3度退变及术中使用长度55 mm的椎间融合器则为椎间融合器沉降发生的保护因素。
伦理批准和知情同意:本研究涉及的所有试验均已通过青岛大学附属医院医学伦理委员会的审核批准(文件号QYFYWZLL28482)。所有试验过程均遵照《人体医学研究的伦理准则》的条例进行。受试对象或其亲属已经签署知情同意书。
[参考文献]
[1]KAISER M G, ECK J C, GROFF M W, et al. Guideline update for the performance of fusion procedures for degenerative disease of the lumbar spine. Part 1: Introduction and methodology[J]. J Neurosurg Spine, 2014,21(1):2-6.
[2]YAO Y C, CHOU P H, LIN H H, et al. Risk factors of cage subsidence in patients received minimally invasive transforaminal lumbar interbody fusion[J]. Spine, 2020,45(19):E1279-E1285.
[3]MARIE-HARDY L, PASCAL-MOUSSELLARD H, BARNABA A, et al. Screw loosening in posterior spine fusion: Prevalence and risk factors[J]. Global Spine J, 2020,10(5):598-602.
[4]SCHREIBER J J, ANDERSON P A, ROSAS H G, et al. Hounsfield units for assessing bone mineral density and strength: A tool for osteoporosis management[J]. J Bone Joint Surg Am, 2011,93(11):1057-1063.
[5]KADER D F, WARDLAW D, SMITH F W. Correlation between the MRI changes in the lumbar multifidus muscles and leg pain[J]. Clin Radiol, 2000,55(2):145-149.
[6]KIM M C, CHUNG H T, CHO J L, et al. Subsidence of polyetheretherketone cage after minimally invasive transforaminal lumbar interbody fusion[J]. J Spinal Disord Tech, 2013,26(2):87-92.
[7]KOTHEERANURAK V, JITPAKDEE K, LIN G X, et al. Subsidence of interbody cage following oblique lateral interbody fusion: An analysis and potential risk factors[J]. Global Spine J, 2023,13(7):1981-1991.
[8]ABBUSHI A, CABRAJA M, THOMALE U W, et al. The influence of cage positioning and cage type on cage migration and fusion rates in patients with monosegmental posterior lumbar interbody fusion and posterior fixation[J]. Eur Spine J, 2009,18(11):1621-1628.
[9]JIN C Z, JAISWAL M S, JEUN S S, et al. Outcomes of oblique lateral interbody fusion for degenerative lumbar disease in patients under or over 65years of age[J]. J Orthop Surg Res, 2018,13(1):38.
[10]MARCHI L, ABDALA N, OLIVEIRA L, et al. Radiographic and clinical evaluation of cage subsidence after stand-alone lateral interbody fusion[J]. J Neurosurg Spine, 2013,19(1):110-118.
[11]HOU Y, LUO Z J. A study on the structural properties of the lumbar endplate: Histological structure, the effect of bone density, and spinal level[J]. Spine, 2009,34(12):E427-E433.
[12]XI Z, MUMMANENI P V, WANG M H, et al. The association between lower Hounsfield units on computed tomography and cage subsidence after lateral lumbar interbody fusion[J]. Neurosurg Focus, 2020,49(2):E8.
[13]RAN L Y, XIE T H, ZHAO L, et al. Low Hounsfield units on computed tomography are associated with cage subsidence following oblique lumbar interbody fusion (OLIF)[J]. Spine J, 2022,22(6):957-964.
[14]周晶,周蕾,刘超,等. 椎体CT值预测单纯斜外侧腰椎间融合术后融合器下沉[J]. 中国修复重建外科杂志, 2021,35(11):1449-1456.
[15]CHEUNG K M, ZHANG Y G, LU D S, et al. Reduction of disc space distraction after anterior lumbar interbody fusion with autologous iliac crest graft[J]. Spine, 2003,28(13):1385-1389.
[16]KALIYA-PERUMAL A K, SOH T L T, TAN M, et al. Factors influencing early disc height loss following lateral lumbar interbody fusion[J]. Asian Spine J, 2020,14(5):601-607.
[17]STRUBE P, HOFF E K, SCHRINGS M, et al. Parameters influencing the outcome after total disc replacement at the lumbosacral junction. Part 2:Distraction and posterior translation lead to clinical failure after a mean follow-up of 5 years[J]. Eur Spine J, 2013,22(10):2279-2287.
[18]ZHANG X Y, WU H, CHEN Y L, et al. Importance of the epiphyseal ring in OLIF stand-alone surgery: A biomechanical study on cadaveric spines[J]. Eur Spine J, 2021,30(1):79-87.
[19]CHEN J D, LI J H, SHENG B, et al. Does preoperative morphology of multifidus influence the surgical outcomes of standalone lateral lumbar interbody fusion for lumbar spondylolisthesis?[J]. Clin Neurol Neurosurg, 2022,215:107177.
[20]WOO J B, SON D W, LEE S H, et al. Which factor can predict the effect of indirect decompression using oblique lumbar interbody fusion?[J]. Medicine, 2022,101(32):e29948.
[21]KALICHMAN L, HUNTER D J. Lumbar facet joint osteoarthritis: A review[J]. Semin Arthritis Rheum, 2007,37(2):69-80.
[22]NACHEMSON A. Lumbar intradiscal pressure. Experimental studies on post-mortem material[J]. Acta Orthop Scand Suppl, 1960,43:1-104.
[23]YANG K H, KING A I. Mechanism of facet load transmission as a hypothesis for low-back pain[J]. Spine, 1984,9(6):557-565.
[24]OKANO I, JONES C, RENTENBERGER C, et al. The association between endplate changes and risk for early severe cage subsidence among standalone lateral lumbar interbody fusion patients[J]. Spine, 2020,45(23):E1580-E1587.
[25]SUN C, WANG H L, JIANG J Y, et al. The pathology of type Ⅱ modic changes: Fat deposition or osteosclerosis? A study using CT scan[J]. Biomed Res Int, 2018,2018:6853720.



