卢尚兵,金 昊,赵鑫鑫,朱 玲,李俊岑,曾 茜,李 龙,康春雨
(1.米兰柏羽医学美容医院美容整形外科 四川 成都 610041;2.成都医学院实验技术教研室 四川 成都 610081)
皮肤创伤后修复过程复杂,大致经历以下三个阶段:①止血和炎症反应阶段;②细胞增殖分化阶段;③组织重建或瘢痕形成阶段[1]。如何缩短愈合周期,减少感染发生,是临床外科医生所面临的难题。据文献报道[2]:丹参是皮肤愈合,创伤修复的良药,但其中的分子机制尚待阐明。本文通过建立大鼠皮肤创伤修复模型,探讨丹参对伤口愈合的作用以及对创伤后血管内皮生长因子(vascular endothelial growth factor, VEGF)表达的影响,为进一步阐明其潜在的修复分子机制提供实验依据,也为临床治疗皮肤创伤提供新的思维。
1 材料和方法
1.1 实验动物:取3月龄SD品系大鼠36只,雌雄不限,体重200~220g,平均(200±20)g,由四川省医学科学院·四川省人民医院实验动物研究所提供,生产许可证号:SCXK(川)2013-15。
1.2 药品和试剂:丹参注射液(国药准字Z51021303,5支/盒,四川升和药业股份有限公司生产)置冰箱4℃保存;免疫组化所用一抗:VEGF Antibody(货号BA0407),效价1:200,抗体来源为兔,购自Boster Biological Technology;二抗:购自中杉金桥的SP-9001兔SP检测试剂盒,批号:17173A02;B液:生物素化山羊抗兔二抗工作液;C液:辣根酶标记链霉卵白素工作液。
1.3 实验仪器:智能程控生物组织自动脱水机:TC-120(泰维科技生产);生物组织自动包埋机:TB-718(泰维科技生产);轮转切片机:RM2235(Leica BiosystemsNusslochGmbh生产);电脑生物组织摊烤片机:KD-T(浙江省金华市科迪仪器设备有限公司生产);电热恒温培养箱(型号:HROP-80AB,青岛海尔特种电冰柜有限公司生产);生物显微镜(型号:BA210,麦克奥迪实业集团有限公司生产)。均由成都医学院实验技术教研室提供。
1.4 实验方法
1.4.1 创伤模型制备:36只3月龄SD大鼠,随机分为丹参组和对照组。将所有SD大鼠适应性喂养1周,实验前1d脱毛,称重;用3.6%水合氯醛腹腔注射麻醉(剂量:1ml/kg) ,固定大鼠于手术台上,常规消毒;在距脊柱0.5cm处,用刀将1.5cm×1.5cm范围内的皮肤切除,但不伤及脊柱旁肌肉上的脂肪及筋膜,简单包扎后待后续处理。
1.4.2 创伤修复:造模成功后,大鼠单笼饲养。术后1h开始用药,丹参组用丹参注射液喷洒创面(剂量:1ml/只),对照组用相同剂量的生理盐水喷洒创面。各组每日09:00、18:00各喷1次,持续1周,给予标准饲料喂养,供给清洁水,动物饲养室温维持在25℃~30℃,鼠笼每隔2d重换垫料。
1.4.3 组织取材:按术后1d、3d、7d时间点取材,取材前行3.6%水合氯醛腹腔注射麻醉,切取距离创缘8mm以内的皮肤全层组织,置于4%多聚甲醛溶液中固定。
1.4.4 HE染色和免疫组织化学染色(immunohistochemistry staining, IHC):标本用4%多聚甲醛固定后制作5μm厚的石蜡切片。每例标本间隔取石蜡切片20张,入60℃烤箱30min,梯度酒精水化,一部分常规HE染色,另一部分高压热抗原修复,非生物素二步法进行VEGF免疫组化染色:用3% H2O2预处理10min,封闭内源性过氧化酶,用0.01mol/L PBS漂洗3次,每次2min。用正常山羊血清在37℃温箱中封闭非特异性抗原10min。用0.01mol/L PBS漂洗3次,每次2min。用VEGF抗体(效价1:200)孵育切片,入冰箱(4℃)过夜,用0.01mol/L PBS漂洗3次,每次2min。用羊抗兔二抗37℃恒温孵育30min,用PBS洗3次,每次2min;把切片入DAB-H¬2O2显色液,室温下反应,待显色充分,及时用0.01mol/L PBS漂洗2次,每次2min;苏木素复染,梯度洒精逐级脱水,二甲苯透明,树胶封片。
1.4.5 阴性对照实验:用PBS代VEGF抗体,其余步骤不变。
1.4.6 观察指标
1.4.6.1 未愈面积的测量:造模成功后,采用OLYMPUS数码照像机采集每只动物造模后1d、3d、7d的未愈面积图像,然后利用Image-Pro Plus6.0图像处理软件( Mdia Cybernetics公司,美国)测量面积, 并记录。
1.4.6.2 平均光密度值(MD)测定:将各组免疫组化切片置于光学显微镜下,采用OLYMPUS数码照像机采集图像进行观察分析。在400倍下从每张切片中各随机选择5个视野进行拍照。然后用Image-Pro Plus6.0图像处理软件对染色阳性的细胞进行光密度分析,测量阳性细胞的平均光密度值。
1.5 统计学分析:各组未愈合面积和平均光密度值数据以均数±标准差表示,用SPSS20.0软件包,组间比较采用独立样本t检验,组内比较采用方差分析LSD 法。
2 结果
2.1 两组创伤未愈面积测量结果:损伤后1d、3d、7d对照组和丹参组大鼠创伤皮肤未愈合面积均逐渐缩小,3d、7d丹参组未愈合面积均小于对照组(P<0.05)。见图1,表1。
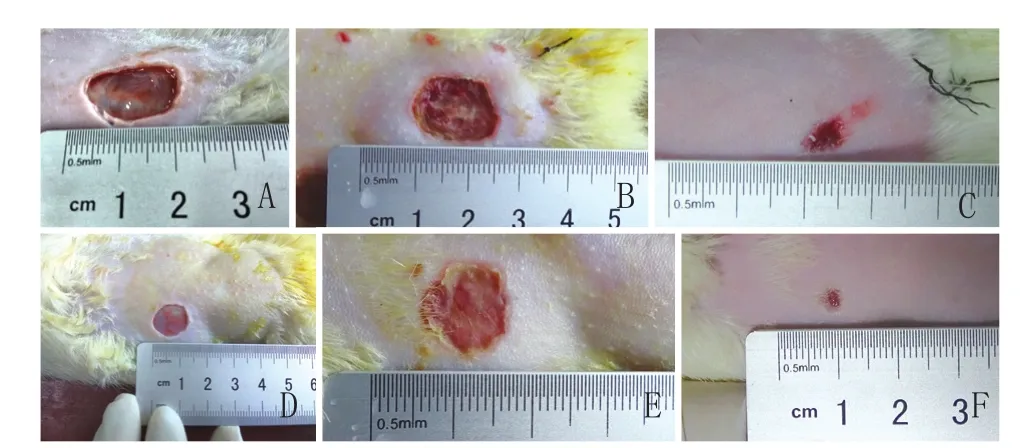
图1 两组创伤皮肤未愈合创面
表1 两组创伤后不同时间段未愈合面积测量结果
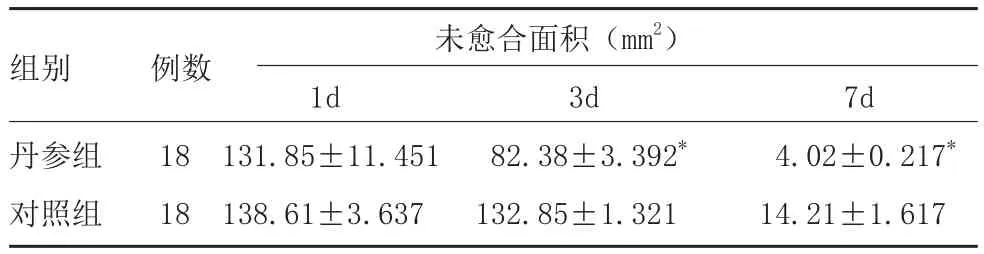
表1 两组创伤后不同时间段未愈合面积测量结果
注:*表示与对照组比较,P<0.05
组别 例数 未愈合面积(mm2)1d 3d 7d丹参组 18 131.85±11.451 82.38±3.392* 4.02±0.217*对照组 18 138.61±3.637 132.85±1.321 14.21±1.617
2.2 HE染色结果:损伤后1d,丹参组和对照组镜下均可见真皮层毛细血管扩张充血,大量红细胞散布于组织间隙,小血管内红细胞淤积形成血栓,损伤周围见少量中性粒细胞浸润,表皮层可见少量炎性细胞浸润。见图2A、D。
损伤后3d,大量肉芽组织形成并向创口生长。各组真皮层和表皮层均可见明显扩张的毛细血管,损伤区周围可见毛细血管生成,大量中性粒细胞和巨噬细胞浸润,除炎症细胞外,尚可见大量成纤维细胞。丹参组小血管内红细胞淤积情况较对照组轻,新生毛细血管数量较对照组多。见图2B、E。
损伤后7d,各组创口已基本为肉芽组织填平,创口基本愈合。成纤维细胞大量增殖,分泌胶原蛋白。肉芽组织纤维化,向瘢痕组织转变。损伤区周围炎性细胞少见。见图2C、F。
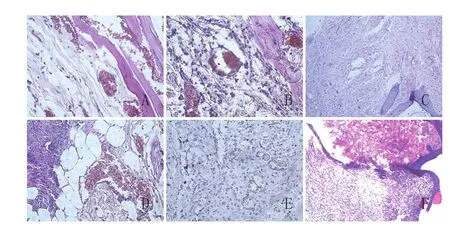
图2 两组创伤皮肤组织HE染色结果
2.3 免疫组化染色结果
2.3.1 损伤边缘皮肤内VEGF免疫阳性反应物的分布概况:在本实验中观察到VEGF在动物皮肤表皮细胞、皮脂腺上皮细胞、毛囊、中性粒细胞、巨噬细胞、成纤维细胞中有表达,但以成纤维细胞的表达为主,阳性反应物主要定位在胞核、胞浆和基质中。
2.3.2 皮肤创伤后VEGF的变化情况:损伤后1d,各组皮肤表皮细胞、皮脂腺上皮细胞、成纤维细胞的胞浆内可见VEGF免疫反应阳性物。在浸润的中性粒细胞中少数细胞胞浆中呈VEGF阳性染色,在扩张的血管内皮细胞中也可见VEGF阳性表达。经平均光密度值测定,丹参组VEGF表达强度高于对照组(P<0.05)。见图3A、D。
损伤后3d,损伤区成纤维细胞大量增殖,炎症细胞浸润,VEGF在表皮细胞、中性粒细胞、巨噬细胞、成纤维细胞的胞浆表达增强,表达强度明显高于损伤后1d(P<0.05)。丹参组VEGF表达强度仍高于对照组(P<0.05)。见图3B、E。
损伤后7d,各组皮肤表皮细胞、皮脂腺上皮细胞、成纤维细胞的胞浆内VEGF免疫反应阳性物减弱,较损伤后3d比较,差异有统计学意义(P<0.05)。丹参组VEGF表达强度与对照组比较,差异无统计学意义(P>0.05)。见图3C、F。见表2。
免疫组织化学方法对照实验结果均为阴性。
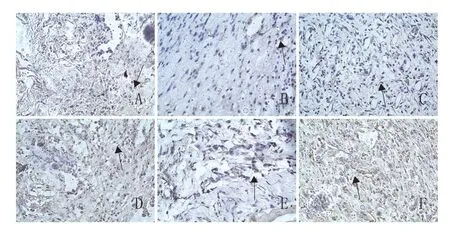
图3 两组创伤皮肤组织免疫组织化学染色结果(400×)
表2 两组VEGF免疫反应阳性物平均光密度值
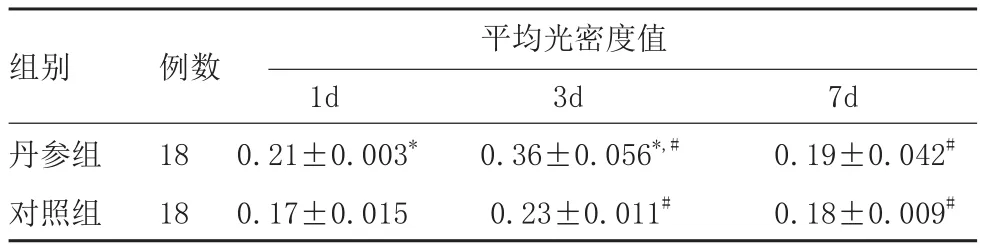
表2 两组VEGF免疫反应阳性物平均光密度值
注:*表示与对照组比较,P<0.05;#表示组内比较,P<0.05
组别 例数 平均光密度值1d 3d 7d丹参组 18 0.21±0.003* 0.36±0.056*,# 0.19±0.042#对照组 18 0.17±0.015 0.23±0.011# 0.18±0.009#
3 讨论
3.1 丹参对大鼠皮肤创伤修复的促进作用:丹参为唇形科多年生草木植物,是中医活血化瘀的代表性药物。大量临床实践证明,丹参可通过促进微循环、免疫调节、抑制过再生、减轻组织缺血-再灌注损伤、促进创伤组织再生、抑制炎症反应及细胞凋亡等多个方面促进创伤组织修复[2]。本次研究中大鼠在皮肤创伤后不同时间点,对照组和丹参组的未愈皮肤面积均逐渐缩小,3d、7d丹参组未愈合面积均小于对照组(P<0.05),表明丹参对大鼠皮肤创伤修复有促进作用。组织病理学结果显示:损伤后1d,丹参组和对照组镜下均可见真皮层毛细血管扩张充血,血管内有血栓形成,损伤周围有炎性细胞浸润,此时处于止血和炎症反应阶段。损伤后3d,大量肉芽组织形成并向创口生长,进入细胞增殖和分化阶段,两组损伤区域周围均可见新生毛细血管及大量成纤维细胞,且丹参组小血管内红细胞淤积程度较对照组轻,新生毛细血管数量较对照组多,表明丹参不仅可减少修复损伤过程中的血栓形成,还能通过促进毛细血管增生,加速创伤组织修复。损伤后7d,进入组织重建或瘢痕形成阶段,创口已基本为肉芽组织填平,成纤维细胞大量增殖,并分泌胶原蛋白;肉芽组织纤维化,向瘢痕组织转变,此阶段丹参组与对照组组织病理学改变相似。
目前认为丹参对血管新生的调节作用呈双向性[3],Bian W等[4]研究发现丹参的活性成分二氢丹参酮Ⅰ可抑制毛细血管内皮细胞增殖和迁移,从而抑制血管生成。因此,其对肿瘤细胞有毒性作用。Luo Y等[5]研究发现隐丹参酮能通过抑制VEGFR-3 而调停细胞外调节蛋白激酶磷酸化,从而抑制淋巴内皮细胞的血管形成。然而,在刘暖[6]、张淑娟[7]等关于心肌梗死的研究中发现丹参提取物可以促进大鼠心肌梗死后心肌组织血管新生,并且在其他心脑血管疾病研究中也有类似的实验结果[8-9]。因此,丹参在不同的疾病或组织中,对血管新生具有不同的调节作用。本研究结果显示:在细胞增殖和分化阶段,丹参可促进创伤皮肤真皮层及表皮层的毛细血管增生,加速损伤修复。
3.2 丹参上调VEGF的表达水平促进创伤修复:VEGF是一种对血管生成有极强诱导作用的多功能诱导因子,能特异性作用于血管内皮细胞,具有促进血管内皮细胞分裂、增殖、细胞质钙聚集以及诱导血管生成、使血管通透性增强等作用,是已知促血管生成所有因子中的最强因子[10-12]。研究显示,其在心脑血管疾病、肾脏疾病、创伤修复及肿瘤的形成中均有重要作用[13-14]。本实验通过免疫组织化学染色方法对损伤边缘皮肤内VEGF免疫阳性反应物的分布进行观察,并对VEGF阳性反应物进行了光密度检测,以实现对其表达水平的半定量分析。结果显示:VEGF在大鼠皮肤表皮细胞、皮脂腺上皮细胞、毛囊、中性粒细胞、巨噬细胞、成纤维细胞中均有表达,但以成纤维细胞的表达为主。目前研究表明,正常皮肤表皮中有少量 VEGF存在,具有维持自身稳态的作用[15-16]。Corral 等[17]研究发现VEGF mRNA 在皮肤损伤后表达可提高 6~7倍,可持续至伤后10d,提出VEGF在局部创伤修复中的作用超过了碱性成纤维细胞转化因子。因此,VEGF在皮肤损伤修复中起有益作用。
相关文献报道[18],皮肤损伤后,随炎性细胞的趋化、渗出,VEGF在表皮及毛囊上皮细胞的表达逐渐减弱,而在中性粒细胞、巨噬细胞及成纤维细胞的表达逐渐增加,巨噬细胞等炎性细胞产生VEGF,TGF-β等多种细胞因子参与创伤的愈合过程。本研究结果显示:3d、7d后成纤维细胞的胞浆内可见VEGF免疫反应阳性物,明显多于伤后1d;经平均光密度值测定,1d、3d后丹参组VEGF表达强度高于对照组,而7d后丹参组VEGF表达强度与对照组比较,差异无统计学意义。提示丹参可增加创伤修复过程中止血和炎症反应阶段和细胞增殖分化阶段VEGF的表达水平。目前,国内外已有大量研究表明丹参可以调节VEGF的表达。高丽等[19]提出丹参酮ⅡA可通过抑制VEGF的表达抑制乳腺癌细胞株MDAMB-231的体外血管生成拟态的形成和细胞增殖。周利红等[20-21]研究也证实,丹参酮ⅡA能够通过抑制VEGF的表达从而明显抑制小鼠肠癌皮下移植瘤内血管新生。而Wang W等[22]研究证明丹参酮ⅡA可抑制 VEGFR-1影响肿瘤血管内皮细胞(TECs)的血管形成功能。以上研究均表明丹参的活性物质能够调节VEGF的表达水平,结合本实验结果,笔者认为丹参可通过上调VEGF的表达水平促进皮肤创伤修复。此外,也有研究提出隐丹参酮能够通过影响TGF-β1、b-FGF、bax、bcl-2、NF-kB等多种细胞因子诱导平滑肌细胞增殖、迁移及血管生成[3,23-24]。因此,丹参对损伤修复的作用机制并不是通过单一因子的调节,而是一个复杂的分子网络,值得进一步深入探索。
[1]李晓康,王舒,于杨,等.皮肤创伤修复研究进展[J].中国中西医结合皮肤性病学杂志,2016,15(1):62-65.
[2]张泽曦,夏庆梅,刘洋,等.丹参促创伤修复机制的研究进展[J].天津中医药大学学报,2015,34(1):51-54.
[3]余杨潇,赵砚瑾,常先磊,等.新型芳基脲类血管内皮生长因子受体抑制剂的合成与抗肿瘤活性研究[J].解放军药学学报,2016,32(3):198-201.
[4]Bian W,Chen F,Bai L,et al.Dihydrotanshinone I inhibits angiogenesis both in vitro and in vivo[J]. Acta Biochim Biophys Sin(Shanghai),2008,40(1):1-6.
[5]Luo Y,Chen W,Zhou H,et al.Cryptotanshinone inhibits lymphatic endothelial cell tube formation by suppressing VEGFR-3/ERK and small GTPase pathways[J].Cancer Prev Res(Phila),2011,4(12):2083-2091.
[6]刘暖,杨雷,毛秉豫,等.丹参提取物促大鼠心肌梗死后心肌组织血管新生的作用[J].中国病理生理杂志,2015,31(8):1490-1494.
[7]张淑娟,王振涛,韩丽华,等.丹参注射液对心肌梗死后大鼠缺血心肌血管新生的影响[J].中医杂志,2011,52(18):1590-1592.
[8]刘朝辉,高晓虹.血管内皮生长因子及其受体的研究进展[J].中国药物与临床,2017,17(8):1162-1164.
[9]唐乾利,郭满,吴标良.血管内皮生长因子的研究现状与进展[J].中国烧伤创疡杂志,2017,29(2):77-87.
[10]闫怡轩.血管内皮生长因子在口腔恶性肿瘤研究中的进展[J].现代诊断与治疗,2015,26(24):5550-5551.
[11]范雪,屈艺,母得志,等.缺氧缺血性脑病中血管内皮生长因子作用的研究进展[J].中华妇幼临床医学杂志(电子版),2016,12(4):453-457.
[12]庄钦,毛威.丹参多种活性成分调节血管新生机制的研究概述[J].浙江中医药大学学报,2014,38(4):506-510.
[13]何帅兵,张百霞,王慧慧,等.基于“中药作用机理辅助解析系统”的丹参治疗心血管疾病作用机制解析[J].中国中药杂志,2015,40(19):3713-3717.
[14]余小平,张超群,覃仁安,等.复方丹参片对急性脑缺血大鼠血管新生因子影响的研究[J].中华中医药学刊,2011,29(5):1145-1148.
[15]Mcluckie M,Schmidt CA,Oosthuysen A,et al.High heparin content surface-modified polyurethane discs promote rapid and stable angiogenesis in full thickness skin defects through VEGF immobilization[J].J Biomed Mater Res A,2017,105(9): 2543-2550.
[16]李学锋,李道萍,王慧君.小鼠皮肤创伤愈合过程中VEGF、TGF-β、bFGF表达的免疫组织化学研究[J].中国组织化学与细胞化学杂志,2003,12(4):367-371.
[17]Corral CJ,Siddiqui A,Wu L,et al.Vascular endothelial growth factor is more important than basic fibroblastic growth factor during ischemic wound healing[J].Arch Surg,1999,134(2):200-205.
[18]Wang N,Wu Y,Zeng N,et al.E2F1 Hinders Skin Wound Healing by Repressing Vascular Endothelial Growth Factor (VEGF) Expression,Neovascularization, and Macrophage Recruitment[J].PLoS One,2016,11(8):160-164.
[19]高丽,徐长亮,何赟绵,等.丹参酮ⅡA对乳腺癌细胞株MDAMB-231体外血管生成拟态(VM)的抑制作用[J].药学与临床研究,2011,19(4):315-317.
[20]周利红,刘宣,王炎,等.丹参酮ⅡA对小鼠肠癌皮下移植瘤血管新生的抑制作用[J].世界华人消化杂志,2009,17(31):3203-3209.
[21]周利红,王炎,范忠泽,等.丹参酮ⅡA调节COX-2对人结肠癌HCT-116细胞VEGF表达的影响[J].世界华人消化杂志,2011,19(15):1561-1567.
[22]Wang WQ,Liu L,Sun HC,et al.Tanshinone IIA inhibits metastasis after palliative resection of hepatocellular carcinoma and prolongs survival inpart via vascular normalization[J].J Hematol Oncol,2012,5(69):58-62.
[23]Takamiya M,Saigusa K,Aoki Y.Immunohistochemical study of basic fi broblast growth factor and vascular endothelial growth factor expression for age determ inationof cutaneous wounds[J].Am J Forensic Med Pathol,2002,23(3):264-267.
[24]周建清,王永忠,胡治国,等.大鼠创伤皮肤内血管内皮生长因子表达的免疫组化研究[J].江苏大学学报(医学版),2003,13(5):46-49.



