刘 超,张雪宁,刘 东,闵 苏
天津医科大学第二医院 1放射科 2神经外科,天津300211 3重庆医科大学附属第一医院麻醉科,重庆 400016
异丙酚、人参皂苷Rg-1、蛋白磷酸酯酶-2A和氯化锂对大鼠电休克后学习记忆及海马内谷氨酸含量的影响
刘 超1,张雪宁1,刘 东2,闵 苏3
天津医科大学第二医院1放射科2神经外科,天津3002113重庆医科大学附属第一医院麻醉科,重庆 400016
目的观察异丙酚、人参皂苷Rg-1、蛋白磷酸酯酶-2A(PP-2A)和氯化锂对电休克 (ECT)后嗅球切除抑郁模型大鼠学习记忆和海马内谷氨酸 (Glu)浓度的影响。方法按随机单位组设2个干预因素,即ECT干预 (2水平:无处置、施行1疗程ECT)和药物干预 (5水平:海马CA1区分别微量注射生理盐水、异丙酚、人参皂苷Rg-1、PP-2A、氯化锂,20 g/L)的所有组合 (2×5析因设计)。全部ECT处置结束24 h内开始Morris水迷宫检测,高效液相色谱法检测Glu在海马内的浓度。结果单独使用异丙酚或ECT均可造成学习记忆障碍,而二者联合使用则会缓解ECT后的学习记忆障碍;人参皂苷Rg-1、PP-2A和氯化锂对学习记忆无明显影响,但与ECT合用则可改善ECT后的学习记忆;ECT干预与药物干预存在交互作用。ECT可明显增加海马中Glu浓度;异丙酚和人参皂苷Rg-1在ECT前后均可减少Glu浓度;且ECT干预与药物干预存在交互作用。PP-2A和氯化锂在ECT前后对Glu浓度无明显影响。结论 ECT可使海马Glu浓度升高,导致学习记忆障碍;异丙酚与人参皂苷Rg-1、PP-2A和氯化锂均可改善ECT后的学习记忆;前两者与降低海马中Glu浓度有关,后两者与此无关。
异丙酚;人参皂苷Rg-1;蛋白磷酸酯酶-2A;氯化锂;电休克;学习记忆能力;谷氨酸
Acta Acad Med Sin,2014,36(3):234-240
抑郁症是一种心理障碍性疾病[1],电休克 (electmconrulsive therapy,ECT)是重度抑郁患者的首选治疗方法。电抽搐发作时间超过120~180 s可造成认知障碍,其原因为谷氨酸 (glutamic acid,Glu)信号系统功能异常[2]引起氧化应激,导致海马长时程增强作用 (long-term potentiation,LTP) 饱和状态[3],造成突触可塑性障碍[4],最终导致记忆的缺失。
异丙酚 (又名二异泊酚)作用于中枢神经系统,其产生麻醉作用的药理机制与抑制 Glu[5]及离子型GluR有关,可通过减弱神经系统的兴奋性毒性减轻ECT导致的学习记忆障碍[2,4]。人参皂苷Rg-1是人参的主要成分之一,具有保护中枢神经系统的作用[6],可易化学习记忆的获得、巩固和再现。蛋白磷酸酯酶-2A(protein phosphatase 2A,PP-2A)是活性最强的p-tau磷酸酯酶[7],可缓解 Tau蛋白的过磷酸化[8-9]。锂可诱导糖原合成酶激酶-3β (glycogen synthase kinase-3β,GSK-3β)在Ser9位点的磷酸化水平增加,进而抑制GSK-3β的活性[10],缓解Tau蛋白过磷酸化[11]。本研究旨在观察异丙酚与人参皂苷 Rg-1、PP-2A和氯化锂对ECT后嗅球切除大鼠抑郁模型学习记忆和海马内Glu浓度的影响,并分析其神经机制的异同。
材料和方法
主要试剂及仪器异丙酚纯品 (2,6-Diisopropylphenol,产品编号D126608,纯度>97%,美国Sigma公司),人参皂苷Rg-1单体 (Ginsenoside Rg-1,纯度>98%,安徽芜湖甙而塔医疗科技有限公司),氯化锂 (Lithium,纯度>97%,上海实验试剂有限公司);蛋白质磷酸酶-2A(抗原)(protein phosphatae-2A,PP-2A,上海雅吉生物科技有限公司),纯品L-谷氨酸 (L-Glutamic acid,美国Sigma公司);Harvard啮齿类动物电休克仪 (美国自然基因有限公司),Morris水迷宫视频分析系统 (北京军事医学科学院),HPLC色谱系统 (美国Waters公司),18-ODS色谱柱(美国Dima公司),Centrifuge 5810R型低温高速离心机 (德国Eppendof公司)。
实验动物及模型建立24周龄健康雄性SD大鼠,体重250~300 g,由天津医科大学实验动物科学部提供。将大鼠置于通风良好、12 h明暗交替、自由饮水摄食条件,每日触摸2 min,使其适应实验室环境及实验人员操作。适应性饲养1周后,建立大鼠嗅球切除抑郁模型[12]:2.75%戊巴比妥钠 (55 mg·kg-1,上海西塘生物科技有限公司)腹腔麻醉大鼠,在两耳联线中点处切开皮肤暴露颅骨,在距前囟前7~8 mm、与正中缝两侧旁开2 mm交点,用电动磨钻将颅骨钻两个直径2 mm小孔,用探针搅动破坏嗅球后用真空泵将其吸出,待全部嗅球组织吸出后方结束,吸收性明胶海绵填入小孔止血。青霉素溶液 (2×104万U·L-1,上海医药集团上海新先锋药业有限公司)冲洗切口,缝合皮肤,肌注青霉素钠 (2×104万U·L1,4万U/只,上海医药集团上海新先锋药业有限公司),连续给药3 d。术后每天对大鼠抚摸和称重,恢复2周后进行Open field测试,每次测试均于上午9:00开始,选取旷场箱内水平计分及垂直计分总分在30~120 s之间的80只大鼠。本实验按照美国医学研究协会《实验动物处理原则》及美国科学学会和国家卫生研究院《实验动物使用和处理指南》进行;遵循双盲原则;大鼠行单笼饲养。
实验动物分组采用随机单位组析因设计:将每只大鼠视为1个单位给予2个处理因素,即ECT干预(2水平:无处置、施行1疗程 ECT)和药物干预(5水平:海马脑区CA1区立体定位微量注射生理盐水、异丙酚、人参皂苷Rg-1、PP-2A和氯化锂)的所有组合 (2×5析因设计,共10组)。80只实验大鼠随机分为10个实验组 (n=8):Ⅰ组:海马CA1区微量注射1 μl生理盐水;Ⅱ组:海马CA1区微量注射1 μl异丙酚纯品,20 μg;Ⅲ组:海马CA1区微量注射1 μl人参皂苷Rg-1,20 μg;Ⅳ组:海马CA1区微量注射1 μl PP-2A,20 μg;Ⅴ组:海马CA1区微量注射1 μl氯化锂,20 μg;Ⅵ组:海马CA1区微量注射1 μl生理盐水+1个疗程ECT;Ⅶ组:海马CA1区微量注射1 μl异丙酚纯品20 μg+1个疗程ECT;Ⅷ组:海马CA1区微量注射1 μl人参皂苷Rg-1 20 μg+1个疗程ECT;Ⅸ组:海马CA1区微量注射1 μl PP-2A 20 μg+1个疗程ECT;Ⅹ组:海马CA1区微量注射1 μl氯化锂20 μg+1个疗程ECT。
脑立体定位及海马微量注射大鼠麻醉后参照大鼠脑立体定位图谱,以Bregma为坐标原点,向海马处(AP-3.8 mm,RL+/-2.5 mm,V2.5 mm)植入一直径0.9 mm带有内芯的不锈钢套管,用磷酸锌水门汀(上海齿科材料厂)固定,外层用牙托粉加固,青霉素溶液 (2×104万U·L-1,上海医药集团上海新先锋药业有限公司)冲洗切口,缝合皮肤,肌注青霉素钠 (2×104万U·L1,4万U/只,上海医药集团上海新先锋药业有限公司),连续给药3 d。术后正常饲养,恢复1周后开始实验。实验中采用微量进样器通过埋植套管给海马注射药品。药品用生理盐水配置,匀速注射,1 min内注完,停针1 min[13]。
ECT处置Ⅰ~Ⅴ组不施行ECT处理,Ⅵ~Ⅹ组每次注射药物15 min后行ECT处置,于大鼠双颞侧安放电极,用Harvard啮齿类动物电休克仪行ECT,给予方波 (单个正弦半波20 ms,50 Hz),电流50 mA,持续1 s,引起大鼠强直阵挛抽搐发作为成功[4],隔天1次,共7次,于9:00 am开始。
Morris水迷宫视频分析系统检测大鼠的空间学习记忆ECT处置结束24 h内开始Morris水迷宫检测。Morris水迷宫被均分为Ⅰ、Ⅱ、Ⅲ、Ⅳ4个象限。水迷宫内盛自来水,加墨汁浑浊,检测前将平台置于Ⅰ象限水面下2 cm。所有实验在9:00 am~3:00 pm进行,室内安静,物品放置及灯光状态一致,水温(24±1)℃。Morris1.0软件跟踪记录分析相关数据。第1~6天行定位航行实验:按逆时针方向分别从Ⅰ、Ⅱ、Ⅲ、Ⅳ4个象限将大鼠面向池壁放入水中,观察并计时120 s,检测前将平台置于Ⅰ象限正中水面下2 cm。摄像系统记录大鼠寻找并爬上平台的时间为逃避潜伏期 (escape latency,EL),若120 s内还未找到平台,则引导其至平台,停留30 s,逃避潜伏期记为120 s。检测结束后以第1~6天逃避潜伏期的平均值作为学习成绩,越短显示学习能力越好。第7天空间行探索实验:撤除平台,将大鼠从距原平台最远Ⅲ象限面向池壁放入水中,摄像系统记录大鼠在60 s内各象限游泳时间,以原平台象限Ⅰ象限游泳时间即空间探索时间 (space exploration time,SET)作为记忆成绩,越长显示记忆能力越好。
海马中Glu含量的检测采用高效液相色谱法(high performance liquid chromatography,HPLC)[13]:
取样:在Morris水迷宫测试结束后24 h内取大鼠的海马,腹腔注射1.5 g/kg 20%氨基甲酸乙酯麻醉,快速断头开颅取全脑;在焦碳酸二乙酯 (diethy pyrocarbonate,DEPC)冰面上吸除血迹,分离双侧海马,称重,加入1 ml甲醇-水离心液,低温匀浆,取匀浆液4℃、10 000×g、离心15 min,取上清,滤膜过滤后-80℃保存待测液 (Glu含量以μg·g-1计)。
色谱条件:18-ODS色谱柱柱温35℃。流动相A:0.1 mol·L-1醋酸钾。流动相B:甲醇,进行二元梯度洗脱,梯度洗脱程序:(T,B%)(0,45%)(1,65%)(6,75%)(20,45%)。流动相经0.45 m微孔滤膜过滤,超声脱气。流速1.0 ml·min-1、激发波长250 nm,发射波长410 nm,以Glu峰面积定量。
氨基酸标准液的配制:Glu标准品配成100 μmol·L-1的标准溶液,测前稀释。衍生及分析:取100 μl标准液或者组织样品液于EP管中,加入100 μl衍生化试剂反应2 min后进样20 μl。
Glu标准曲线的建立:配制浓度分别为0.15、0.30、0.74、1.47、2.94、3.68、5.88 mg·L-1的Glu标准溶液,衍生化处理后测定,采用外标法进行定量分析。
海马中Glu含量的测定:将海马匀浆上清液解冻,置入玻璃匀浆器,加入1 mol·L-1冰冻甲酸2 ml,冰浴下手动充分匀浆。将匀浆液于4℃ 7 000 r·min-1离心30 min。取上清液置于-20℃保存备用。每1 ml匀浆上清液加0.75 ml 4%的碳酸氢钠溶液混匀,4℃、3 000 r·min-1离心5 min,取上清液0.45 μm滤膜过滤,分装。取分装液24 μl,在进样瓶中加入衍生试剂12 μl,四硼酸钠缓冲液 (pH=9.18)960 μl,混匀,20℃下静置3 min后依次进样,梯度洗脱,测定Glu含量。
统计学处理采用SPSS 17.0统计软件,实验数据以均数±标准差表示;对各组样本行方差齐性检验,采用析因设计方差分析方法分析各处理因素主效应和交互效应;采用单因素方差分析方法分析各处理因素的单独效应;行LSD检验和SNK-q检验进行两两比较;P<0.05为差异有统计学意义。
结果
Morris水迷宫视频分析系统检测实验大鼠的EL和 SET ECT可造成大鼠学习记忆障碍,即延长EL(F =147.258,P=0.000)并缩短SET(F=119.710,P =0.000)。异丙酚单独使用亦可造成大鼠学习记忆障碍,即延长EL并缩短EL,而ECT和异丙酚合用之后,其造成的学习记忆障碍程度反而减轻;人参皂苷Rg-1、PP-2A和氯化锂单独使用对大鼠学习记忆无明显影响,但与ECT合用则可明显改善ECT后的学习记忆 (EL:F=47.851,P=0.000;SET:F=33.145,P =0.000)。ECT干预与药物干预存在交互作用 (EL:F=44.635,P=0.000;SET:F=22.125,P=0.000) (表1、表2)。
HPLC法检测神经递质Glu在海马中含量ECT可明显增加海马中 Glu浓度 (F=349.310,P= 0.000),异丙酚和人参皂苷Rg-1在ECT前后均可减少海马中Glu浓度 (ECT前:F=3.170,P=0.025; ECT后:F=9.159,P=0.000)(总效应:F=6.557,P=0.000),且ECT干预与异丙酚和人参皂苷Rg-1的药物干预存在交互作用 (F=2.749,P=0.035),而PP-2A和氯化锂在ECT前后对Glu浓度均无明显影响(表3)。
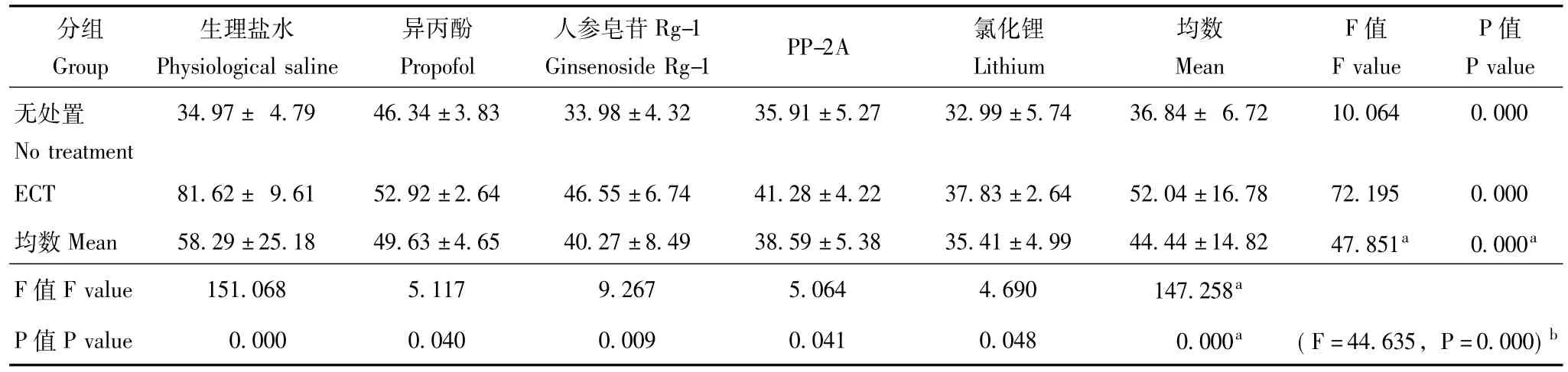
表1 Morris水迷宫学习记忆成绩:EL(n=8,x-±s,s)Table 1 Morris water maze test:EL(n=8,x-±s,s)
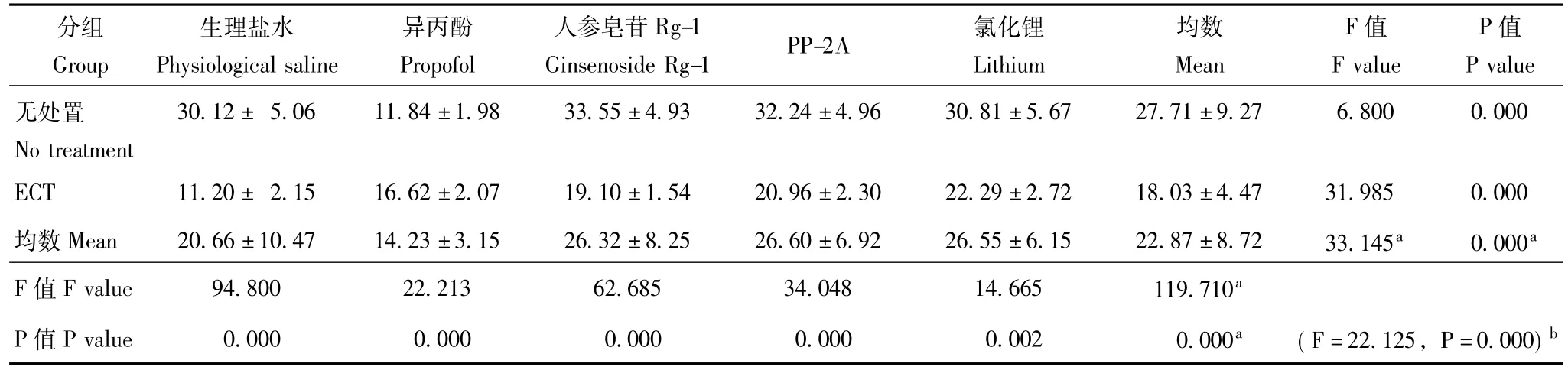
表2 Morris水迷宫学习记忆成绩:SET(n=8,x-±s,s)Table 2 Morris water maze test:SET(n=8,x-±s,s)
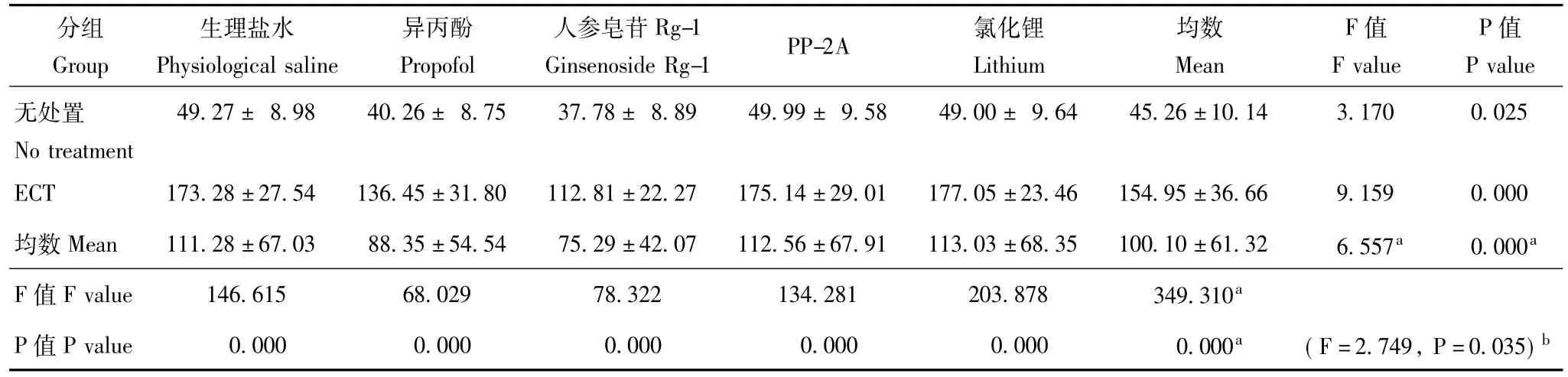
表3 Glu在大鼠海马组织中的含量 (n=8,x-±s,μmol/gprot)Table 3 The content of glutamate in the hippocampus of rats(n=8,x-±s,μmol/gprot)
讨论
海马CA1区和齿状回在大鼠空间长时记忆形成中具有重要作用[14-15],认知地图即储存于海马[15-16]。水迷宫主要测试空间记忆,故本实验选择海马区域进行研究。Glu对学习记忆的影响具有双向作用,适当激动N-甲基-D-天门冬氨酸受体 (N-methyl-D-aspartate receptor,NMDAR)是学习记忆所必须的,但如果脑内Glu释放过多,过度激动膜电位依赖式GluR会导致Ca2+大量内流[17-18],激活对 Ca2+敏感的各种酶类,产生氧自由基,导致线粒体损害,激活磷酸肌醇环路,破坏细胞的超微结构[19],使神经元变性乃至死亡,进而造成学习记忆障碍。ECT后学习记忆障碍与Glu信号系统功能异常有关[2,20]。本研究发现ECT后导致的学习记忆障碍伴发海马内Glu浓度升高,验证了过高浓度的Glu可诱发兴奋性毒性,揭示了ECT导致认知障碍的机制。
本研究发现单独使用异丙酚会导致学习记忆减退,但与ECT合用时则可明显减轻ECT后的学习记忆障碍。而且异丙酚可以减少海马中Glu的浓度,尤其以ECT后为甚,此点或与异丙酚改善ECT后认知功能相关。结合既往研究,推测其机制如下:异丙酚可抑制神经元合成和释放Glu[21];异丙酚的苯环基团可作用于NMDAR的苯环己哌啶结合位点,非竞争性拮抗NMDAR,减少因NMDAR过度兴奋导致的神经元损伤;异丙酚通过升高蛋白激酶 B性抑制神经元凋亡[22];异丙酚直接作为 NMDAR阻滞剂而发挥作用[23]。
本研究还发现人参皂苷Rg-1、PP-2A和氯化锂均可缓解ECT后学习记忆障碍。人参皂苷含有由17个碳原子排列成4个环的gonane类固醇核,其中人参二醇类皂苷Rgl是人参的主要活性成分。人参皂甙Rg-l对应激性认知障碍产生保护作用的机制可能是:调节海马内的钙浓度;增加海马的突触密度;增加ChAT活性,抑制AchE活性;增加突触体对胆碱的摄取、提高脑中去甲肾上腺素、多巴胺的含量;减少Glu的释放,增加神经胶质细胞对Glu的再摄取,抑制Glu兴奋性毒性;增加神经元的细胞膜和突触小体膜流动性;通过JNK/p38 MAPK途径、GSK3β途径或CDK5途径使过度磷酸化的Tau蛋白去磷酸化[24-26];上调学习记忆相关蛋白NR1和NR2B的表达以及基底前脑神经生长因子 (nerve growth factor,NGF)的表达[27]。PP-2A是真核生物体内的主要丝/苏氨酸蛋白磷酸酶,可催化人脑Tau蛋白多个位点去磷酸化[28],使Tau蛋白恢复生物学功能[29];占人脑总Tau蛋白磷酸酯酶活性的71%。氯化锂神经元保护机制可能是:通过抑制GSK-3β的活性[10]抑制Tau蛋白磷酸化;通过激活磷酸肌醇3-激酶或抑制早期基因的磷酸化,抑制神经元凋亡[30];作用于Wnt通路,拮抗由易凝聚蛋白引起的毒性;阻断Glu的兴奋毒性,下调NMDA受体活性[31];通过防止脂质过氧化和DNA的断裂拮抗Glu引起的氧化损伤。本研究结果显示,人参皂苷Rg-1、PP-2A和氯化锂单独短期内应用对学习记忆没有明显影响,但与ECT合用则可明显逆转ECT后的学习记忆能力。在4种实验药物中,氯化锂改善应激后学习记忆的效果最为明显。
比较4种药物改善认知功能的机制,发现无论行ECT与否,异丙酚和人参皂苷Rg-1均可减少海马中Glu浓度;而PP-2A和氯化锂对Glu浓度似无明显影响。综合相关研究和本研究的实验结果,可知4种药物作用机制不同:异丙酚、人参皂苷Rg-1可减少Glu浓度、拮抗其兴奋性毒性;氯化锂可拮抗Glu兴奋性毒性;而PP-2A似乎通过拮抗Glu兴奋性毒性以外的途径改善应激后的学习和记忆能力。
综上,异丙酚在ECT过程中使用,不但可以使患者进入麻醉状态,减轻ECT治疗的痛苦,还可缓解ECT治疗后的认知障碍。此外,本研究还提示,若在ECT治疗中使用人参皂苷Rg-1、PP-2A和氯化锂,亦可明显减轻ECT治疗后的认知障碍。因此,本研究进一步比较和分析这4种药物缓解ECT治疗后认知障碍的药理学机制,对于制定最优ECT治疗方案具有重要的临床价值。
[1] Ebert M,Loosen P,Nurcombe B,et al.Current diagnosis and treatment psychiatry[M].2th ed.New York:McGraw-Hill Press,2008:306.
[2] Luo J,Min S,Wei K,et al.Propofol protects against impairment of learning-memory and imbalance of hippocampal Glu/GABA induced by electroconvulsive shock in depressed rats[J].J Anesth,2011,25(5):657-665.
[3] Andrade C,Singh NM,Thyagarajan S,et al.Possible glutamatergic and lipid signalling mechanisms in ECT-induced retrograde amnesia:experimental evidence for involvement of COX-2,and review of literature[J].J Psychiatr Res,2008,42(10):837-850.
[4] Dong J,Min S,Wei K,et al.Effects of electroconvulsive therapy and propofol on spatial memory and glutamatergic system in hippocampus of depressed rats[J].J ECT,2010,26 (2):126-130.
[5] Zhang H,Wang W,Gao W,et al.Effect of propofol on the levels of neurotransmitters in normal human brain:a magnetic resonance spectroscopy study[J].Neurosci Lett,2009,467(3):247-251.
[6] Fang F,Chen X,Huang T,et al.Multi-faced neuroprotective effects of Ginsenoside Rg1 in an Alzheimer mouse model[J].Biochim Biophys Acta,2011,1822(2):286-292.
[7] Zhang Y,Liang J,Sun L,et al.Inhibition of PP2A and the consequent activation of JNK/c-Jun are involved in tributyltininduced apoptosis in human amnionic cells[J].Environ Toxicol,2013,28(7):390-400.
[8] Liu F,Liang Z,Gong CX.Hyperphosphorylation of tau and protein phosphatases in Alzheimer disease[J].Panminerva Med,2006,48(2):97-108.
[9] Liang Z,Liu F,Iqbal K,et al.Decrease of protein phosphatase 2A and its association with accumulation and hyperphosphorylation of tau in Down syndrome[J].J Alzheimers Dis,2008,13(3):295-302.
[10] Zhao L,Wang F,Gui B,et al.Prophylactic lithium alleviates postoperative cognition impairment by phosphorylating hippocampal glycogen synthase kinase-3β (Ser9)in aged rats[J].Exp Gerontol,2011,46(12):1031-1036.
[11] 陆文惠,屈秋民,曹红梅,等.锂对慢性铝暴露大鼠脑内CDK5和PP2A表达的影响[J].西安交通大学学报:医学版,2010,31(4):463-466.
[12] Tasset I,Medina FJ,Peña J,et al.Olfactory bulberctomy induced oxidative and cell damage in rat:protective effect of melatonin[J].Physiol Res,2010,59(1):105-112.
[13] 董素平,徐畅,原婷婷,等.海马NMDA受体经SP-NK1受体通路参与慢性应激诱发的抑郁样行为[J].心理学报,2011,43(9):1045-1054.
[14] Wall AM,Corcoran AE,O’Halloran KD,et al.Effects of prolyl-hydroxylase inhibition and chronic intermittent hypoxia on synaptic transmission and plasticity in the rat CA1 and dentate gyrus[J].Neurobiol Dis,2014,62(1):8-17.
[15] Preissmann D,Bertholet L,Sierro G,et al.Accurate performance of a rat model of schizophrenia in the water maze depends on visual cue availability and stability:a distortion in cognitive mapping abilities[J].Behav Brain Res,2011,223(1):145-153.
[16] Dennis SH,Jaafari N,Cimarosti H,et al.Oxygen/glucose deprivation induces a reduction in synaptic AMPA receptors on hippocampal CA3 neurons mediated by mGluR1 and adenosine A3 receptors[J].J Neurosci,2011,31(33):11941-11952.
[17] Vieira M,Fernandes J,Burgeiro,et al.Excitotoxicity through Ca2+-permeable NMDA receptors requires Ca2+-dependent JNK activation[J].Neurobiol Dis,2010,40(3):645-655.
[18] Bliss RM,Finckbone VL,Trice J,et al.Tumor necrosis factor-α(TNF-α)augments NMDA-induced Purkinje neuron toxicity[J].Brain Res,2011,1386(1):1-14.
[19] Kartalci S,Karabulut AB,Ozcan AC,et al.Acute and chronic effects of electroconvulsive treatment on oxidative parameters in schizophrenia patients[J].Prog Neuropsychopharmacol Biol Psychiatry,2011,35(7):1689-1694.
[20] Kato N.Neurophysiological mechanisms of electroconvulsive therapy for depression[J].Neurosci Res,2009,64(1):3-11.
[21] Yagmurdur H,Ayyildiz A,Karaguzel E,et al.Propofol reduces nitric oxide-induced apoptosis in testicular ischemiareperfusion injury by downregulating the expression of inducible nitric oxide synthase[J].Acta Anaesthesiol Scand,2008,52(3):350-357.
[22] Wang HY,Wang GL,Yu YH,et al.The role of phosphoinositide-3-kinase/Akt pathway in propofol-induced postconditioning against focal cerebral ischemia-reperfusion injury in rats[J].Brain Res,2009,1297(4):177-184.
[23] Kingston S,Mao L,Yang L,et al.Propofol inhibits phosphorylation of N-methyl-D-aspartate receptor NR1 subunits in neurons[J].Anesthesiology,2006,104(4):736-739.
[24] Song XY,Hu JF,Chu SF,et al.Ginsenoside Rg1 attenuates okadaic acid induced spatial memory impairment by the GSK3β/tau signaling pathway and the Aβ formation prevention in rats[J].Eur J Pharmacol,2013,710(1-3):29-38.
[25] Li W,Chu Y,Zhang L,et al.Ginsenoside Rg1 attenuates tau phosphorylation in SK-N-SH induced by Aβ-stimulated THP-1 supernatant and the involvement of p38 pathway activation[J].Life Sci,2012,91(15-16):809-815.
[26] He Y,Zhao H,Su G.Ginsenoside Rg1 decreases neurofibrillary tangles accumulation in retina by regulating activities of neprilysin and PKA in retinal cells of AD mice model[J].J Mol Neurosci,2014,52(1):101-106.
[27] 邬伟,杨景全,何志勇,等.人参皂苷Rg1联合骨髓间充质干细胞移植对痴呆大鼠学习记忆能力的影响[J].中国中西医结合杂志,2011,31(6):799-802.
[28] Xiong Y,Jing XP,Zhou XW,et al.Zinc induces protein phosphatase 2A inactivation and tau hyperphosphorylation through Src dependent PP2A(tyrosine 307)phosphorylation[J].Neurobiol Aging,2013,34(3):745-756.
[29] Liu P,Zou LB,Wang LH,et al.Xanthoceraside attenuates tau hyperphosphorylation and cognitive deficits in intracerebroventricular-streptozotocin injected rats[J].Psychopharmacology(Berl),2014,231(2):345-356.
[30] Bhavsar SK,Merches K,Bobbala D,et al.AKT/SGK-sensitive phosphorylation of GSK3 in the regulation of L-selectin and perforin expression as well as activation induced cell death of T-lymphocytes[J].Biochem Biophys Res Commun,2012,425(1):6-12.
[31] Liu RJ,Fuchikami M,Dwyer JM,et al.GSK-3 inhibition potentiates the synaptogenic and antidepressant-like effects of subthreshold doses of ketamine[J].Neuropsychopharmacology,2013,38(11):2268-2277.
Effects of Propofol,Ginsenoside Rg-1,Protein Phosphatae-2A,and Lithium on the Learning and Memory in Rats and the Content of Glutamic Acid in Hippocampus after the Electmconrulsive Therapy
LIU Chao1,ZHANG Xue-ning1,LIU Dong2,MIN Su3
1Department of Radiology,2Department of Neurosurgery,the Second Hospital of Tianjin Medical University,Tianjin 300211,China3Department of Anesthesiology,the First Affiliated Hospital of Chongqing Medical University,Chongqing 400016,China
ZHANG Xue-ning Tel:022-28331788,E-mail:luckyxn@126.com
Objective To explore and compare the effects of propofol,ginsenoside Rg-1,protein phosphatae-2A,and lithium on the learning and memory and the concentration of glutamic acid in hippocampus after the electmconrulsive therapy(ECT)in the model of depressed rats induced after the removal of olfactory bulb.Methods The depressed rats were randomized into ECT intervention(two levels:no disposition and a course of e-lectroconvulsive shock)and drug intervention(five levels:microinjection of saline injection,propofol,ginsenoside Rg-1,protein phosphatae-2A,and lithium,20 g/L).Learning and memory were evaluated using the Morris water maze test within 24 h after the course of ECT.Glutamate contents in the hippocampus of rats were examined using high-performance liquid chromatography.Results Both propofol alone and ECT alone induced the impairment of learning and memory in depressed rats,but their combination alleviated the such impairment caused by ECT.Ginsenoside Rg-1,protein phosphatae-2A,and lithium had no obvious effect on the leaning and improved the learning and memory when in combination with ECT.There was a synergic effect between ECT intervention and drug intervention.ECT remarkably increased the glutamate content in the hippocampus of depressed rats,which could be reduced by both propofol and ginsenoside Rg-1.Protein phosphatae-2A and lithium did not affect glutamate content in the hippocampus of depressed rats before and after ECT.Conclusions ECT can increase the content of glutamate in hippocampus and thus cause the impairment of learning and memory in depressed rats.Propofol and ginsenoside Rg-1 can ameliorate the impairment by reducing the content of glutamate in hippocampus.Protein phosphatae-2A and lithium may also improve the learning and memory in depressed rats.
propofol;ginsenoside Rg-1;protein phosphatae-2A;lithium;electroconvulsive therapy;learning and memory ability;glutamic acid
张雪宁 电话:022-28331788,电子邮件:luckyxn@126.com
R395.1
A
1000-503X(2014)03-0234-07
10.3881/j.issn.1000-503X.2014.03.002
国家自然科学基金 (30972831)和国家博士后科学基金 (2013M530880)Supported by the National Natural Sciences Foundation of China (30972831)and China Postdoctoral Science Foundation(2013M530880)
2013-12-02)
·论 着·



