张 博,刘 娜,顾 斌,吴 昊,高羽萱,王东胜,刘洪臣
中国人民解放军总医院口腔医学研究所,北京100853
颌骨质量是口腔种植成功的关键。糖尿病患者由于其成骨质量不佳影响口腔种植的效果[1-2]。在骨愈合过程中间充质干细胞的募集和增殖发挥着重要的作用[3-4]。已有研究证实高糖环境抑制成骨样细胞MG-63和 MT373的增殖[5-6],对于骨髓基质细胞,Gopalakrishnan等[7]证实高糖环境干预骨髓基质细胞的增殖。这些都表明高糖环境是影响骨髓基质细胞增殖的重要原因,但其机制却并不明确。Wnt/β-链蛋白信号通路是一条与细胞增殖密切相关的信号通路[8],其下游的靶基因细胞周期蛋白D1可以促使细胞在增殖过程中从G1期向S期过度[9],因此细胞周期蛋白D1的表达可以影响到细胞的增殖[10-11]。但高糖微环境影响细胞增殖的过程中是否有Wnt/β-链蛋白信号通路的参与,目前相关报道较少。本研究采用大鼠下颌骨来源的骨髓基质细胞,观察高糖对骨髓基质细胞增殖的影响,并检测高糖环境下Wnt/β-链蛋白信号通路中关键因子β-链蛋白、淋巴增强因子-1(lymphoid enhancer factor-1,LEF-1)以及下游靶基因细胞周期蛋白D1的变化,从而结合Wnt/β-链蛋白信号通路探讨高糖微环境对骨髓基质细胞增殖的影响。
材料和方法
材料 雄性Wistar大鼠10只,4周龄,由中国人民解放军总医院动物实验中心提供;L-DMEM培养基(美国 Gibico公司),胎牛血清 (美国 Invitrogen公司),葡萄糖粉 (美国Sigma公司),LEF-1、细胞周期蛋白D1、GAPDH引物 (深圳华大基因公司合成),Anti-β-链蛋白、Anti-β-actin、Anti-细胞周期蛋白 D1、羊抗兔IgG(美国Abcam公司),PrimeScriptTM实时定量多聚酶链反应试剂盒、Premix Ex TaqTM试剂盒 (日本Takara公司);细胞培养瓶、培养板 (美国Corning公司),CO2恒温培养箱 (美国 ThermoForma公司),超净工作台 (北京长城空气净化设备工程公司),纯水机 (美国Millipore公司),倒置相差显微镜 (德国Leica公司),Centrifuge 5810R低温离心机 (德国Eppendorf公司),UsingiMarkTM酶联免疫检测仪 (美国Bio-Rad公司),流式细胞仪 (美国Beckman-Coulter公司),Bio-Rad IQ5 Real-Time PCR检测系统 (美国Bio-Rad公司),全自动生化分析仪 (日本Hitachi公司)。
骨髓基质细胞的体外培养 骨髓基质细胞的体外培养遵循本实验室前期的实验步骤[12],取3~5代细胞进行实验。
噻唑蓝法检测细胞增殖 将细胞密度调整为2×104个/ml接种于96孔板中,培养基分别为含生理葡萄糖浓度培养基 (5.5 mmol/L)和含高糖浓度培养基(16.5 mmol/L)。每组设3个重复孔,每隔2天换液。于1、3、5、7 d进行测试。测试时100 μl 5 g/L噻唑蓝溶液被加到每孔中,5%CO2孵育4 h。然后,吸净孔内液体,加入500 μl二甲基亚砜溶解在细胞中形成晶体,振荡器中震荡15 min。酶联免疫检测仪在波长490 nm检测吸光值。本实验重复进行3次。
细胞周期检测 将细胞常规培养5 d后消化,PBS冲洗两遍,制备细胞悬浊液,将细胞浓度调整为5×105个/ml,PBS重悬细胞后加入预冷的70%的乙醇1.5 ml吹打均匀,4℃过夜,离心去乙醇,PBS冲洗两遍,加入5 mol/L的碘化丙锭1 ml,4℃避光染色30 min,过200目尼龙筛网,流式细胞仪测定DNA含量,根据不同的DNA含量判断细胞周期。计算细胞增殖指数 (proliferation index,PI):PI=(S+G2/M)/(G0/G1+S+G2/M)×100%。
Western blot法检测β-链蛋白表达 将骨髓基质细胞以1×105个/ml接种于25 cm2培养瓶中,以不同糖浓度培养基 (5.5、16.5 mmol/L)继续培养5 d。弃去培养液,裂解细胞,提取蛋白,取等量蛋白经8%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳后,将凝胶转移到硝酸纤维素膜上,脱脂奶粉封闭过夜。加入兔抗大鼠β-链蛋白 (1∶1 000稀释)、抗细胞周期蛋白 D1(1∶1 000稀释)和β-actin(1∶2 000稀释),37 ℃孵育2 h,洗膜后,利用羊抗兔IgG(1∶4 000稀释)孵育50 min,化学发光法显示抗原抗体复合物,X线片显影并定影,利用image J对条带的相对灰度进行分析。以上实验重复3次。
实时定量PCR检测 将骨髓基质细胞以1×105个/ml接种于25 cm2培养瓶中,以不同糖浓度培养基(5.5、16.5 mmol/L)继续培养5 d。利用Trizol提取RNA,紫外分光光度计定量RNA浓度 [RNA浓度(μg/μl)=A260×40×稀释倍数/1 000)],A260/A280值判断其纯度,正常值在1.6~2.0。采用PrimeScriptTMRT-PCR Kit(Perfect Real Time)试剂盒合成cDNA,合成引物见表1,定量PCR采用Takara公司的SYBR Premix Ex TaqTM试剂盒,各组体系配置好后置于Bio-Rad IQ5荧光检测仪上进行检测。反应条件如下:95℃预变性10 s,1个循环,95℃变性5 s和60℃退火和延伸20 s,40个循环。mRNA的表达采用相对表达量进行比较,即目的基因相对于管家基因GAPDH的表达量所增加的倍数进行比较;采用2-ΔCt法计算各mRNA 的相对表达量[13]。
统计学处理 采用SPSS 11.0统计软件,实验数据以均数±标准差表示。两样本均数比较采用独立样本t检验,多样本均数比较采用单因素方差分析,其中两两间比较采用LSD法。P<0.05为差异有统计学意义。
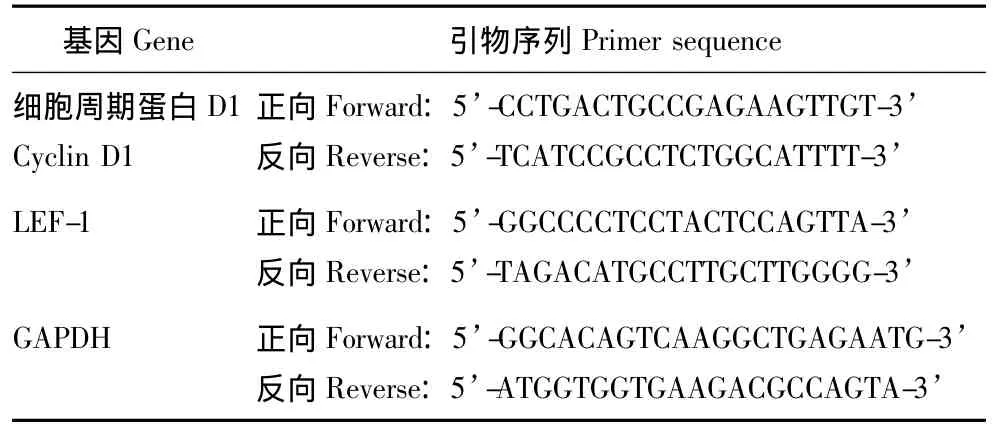
表1 引物序列Table 1 Primer sequences
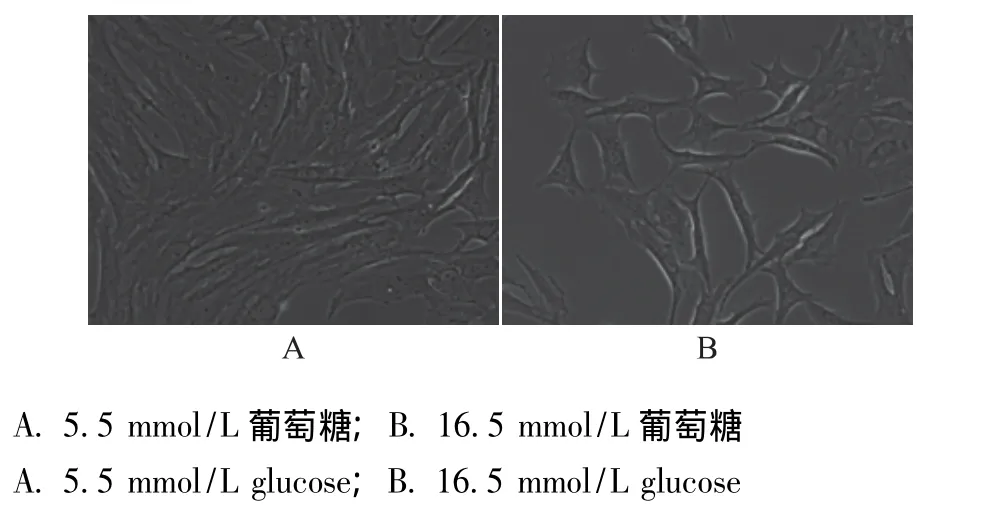
图1 不同糖浓度下骨髓基质细胞的形态学变化 (×400)Fig 1 Morphological changes of bone marrow stromal stem cells on the different concentrations of glucose(×400)
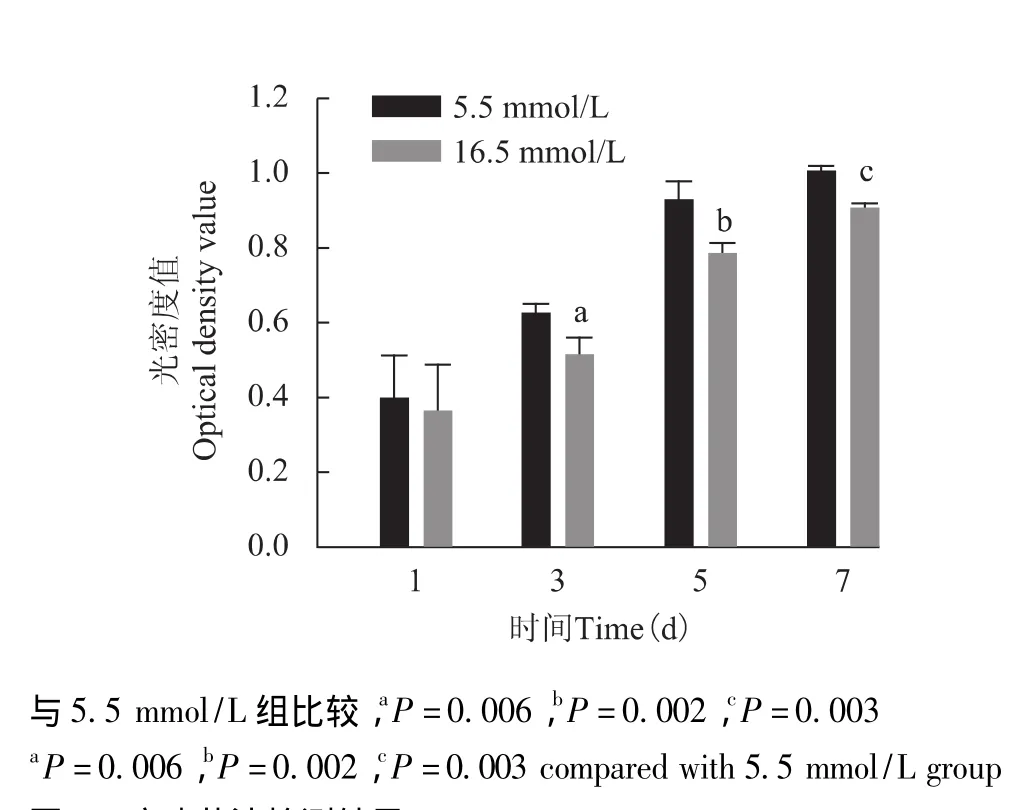
图2 噻唑蓝法检测结果Fig 2 Results of methyl thiazolyl tetrazolium assay
结 果
高糖干预后骨髓基质细胞的形态学变化 取第4代细胞采用不同糖浓度培养基进行细胞培养,正常糖浓度 (5.5 mmol/L)培养细胞呈纺锤形,分布均匀,培养5 d后可覆盖瓶底80%以上,而在高糖浓度下(16.5 mmol/L)细胞呈现多极性生长,边缘常呈钝角状或瘤状突起,且培养5 d后细胞密度低于正常糖浓度 (图1)。
高糖环境对骨髓基质细胞增殖的影响 噻唑蓝法结果显示在不同糖浓度 (5.5、16.5 mmol/L)的培养条件下,培养1 d时细胞的光密度 (optical density,OD)值差异无统计学意义 (P=0.700),培养3、5、7 d时16.5 mmol/L组细胞的OD值显着低于5.5 mmol/L组(P=0.006,P=0.002,P=0.003)(图2)。细胞周期检测结果显示不同糖浓度培养5 d后,16.5 mmol/L组细胞的增殖指数显着低于5.5 mmol/L组 (P=0.014)(表2),同时高糖环境可以抑制细胞从G1期向S期转化。
高糖环境对骨髓基质细胞β-链蛋白的影响 与5.5 mmol/L组细胞相比,16.5 mmol/L组细胞在培养5 d后β-链蛋白的分泌显着降低 (P=0.001)(图3)。
高糖环境对骨髓基质细胞LEF-1、细胞周期蛋白D1 mRNA及细胞周期蛋白D1蛋白表达的影响 细胞在培养5 d后,16.5 mmol/L组细胞的LEF-1、细胞周期蛋白D1的mRNA的表达水平以及蛋白表达水平均显着低于5.5 mmol/L组细胞 (P=0.000)(图4、5)。
讨 论
本研究利用高糖环境对从大鼠颌骨提取的骨髓基质细胞进行干预,观察高糖对骨髓基质细胞增殖的影响,同时为确定高糖抑制细胞增殖的过程中是否有Wnt/β-链蛋白信号通路的参与,检测了高糖环境下通路中关键因子β-链蛋白、LEF-1以及通路下游因子细胞周期蛋白D1的表达。
表2 流式细胞仪检测细胞周期及增殖指数 ( ± s,%)Table 2 Cell cycle and proliferation index by flow cytometry ± s,%)
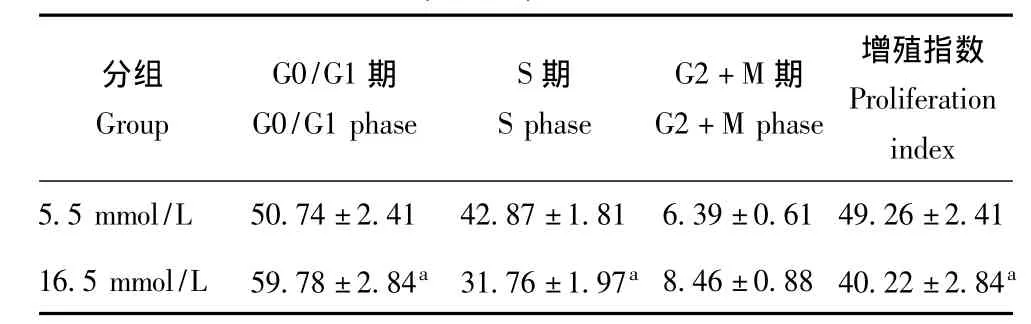
表2 流式细胞仪检测细胞周期及增殖指数 ( ± s,%)Table 2 Cell cycle and proliferation index by flow cytometry ± s,%)
与5.5 mmol/L组比较,aP<0.05aP<0.05 compared with the 5.5 mmol/L group
分组G r o u p G 0/G 1期G 0/G 1 p h a s e S期S p h a s e G 2+M期G 2+M p h a s e增殖指数P r o l i f e r a t i o n i n d e x 5.5 m m o l/L 5 0.7 4±2.4 1 4 2.8 7±1.8 1 6.3 9±0.6 1 4 9.2 6±2.4 1 1 6.5 m m o l/L 5 9.7 8±2.8 4 a 3 1.7 6±1.9 7 a 8.4 6±0.8 8 4 0.2 2±2.8 4 a
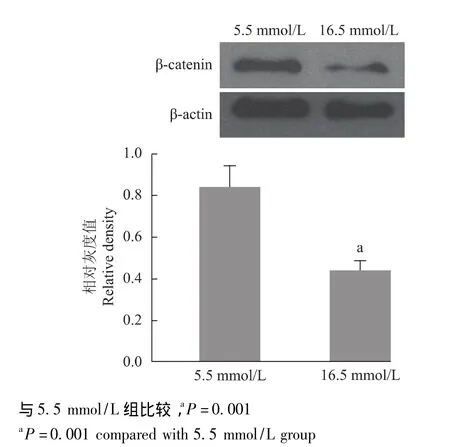
图3 不同糖浓度β-链蛋白的表达Fig 3 Expression of β-catenin on different concentrations of glucose
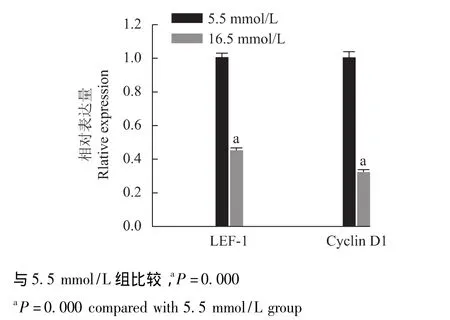
图4 不同糖浓度LEF-1和细胞周期蛋白D1的mRNA表达Fig 4 mRNA expression of cyclin D1 and LEF-1 on different concentrations of glucose
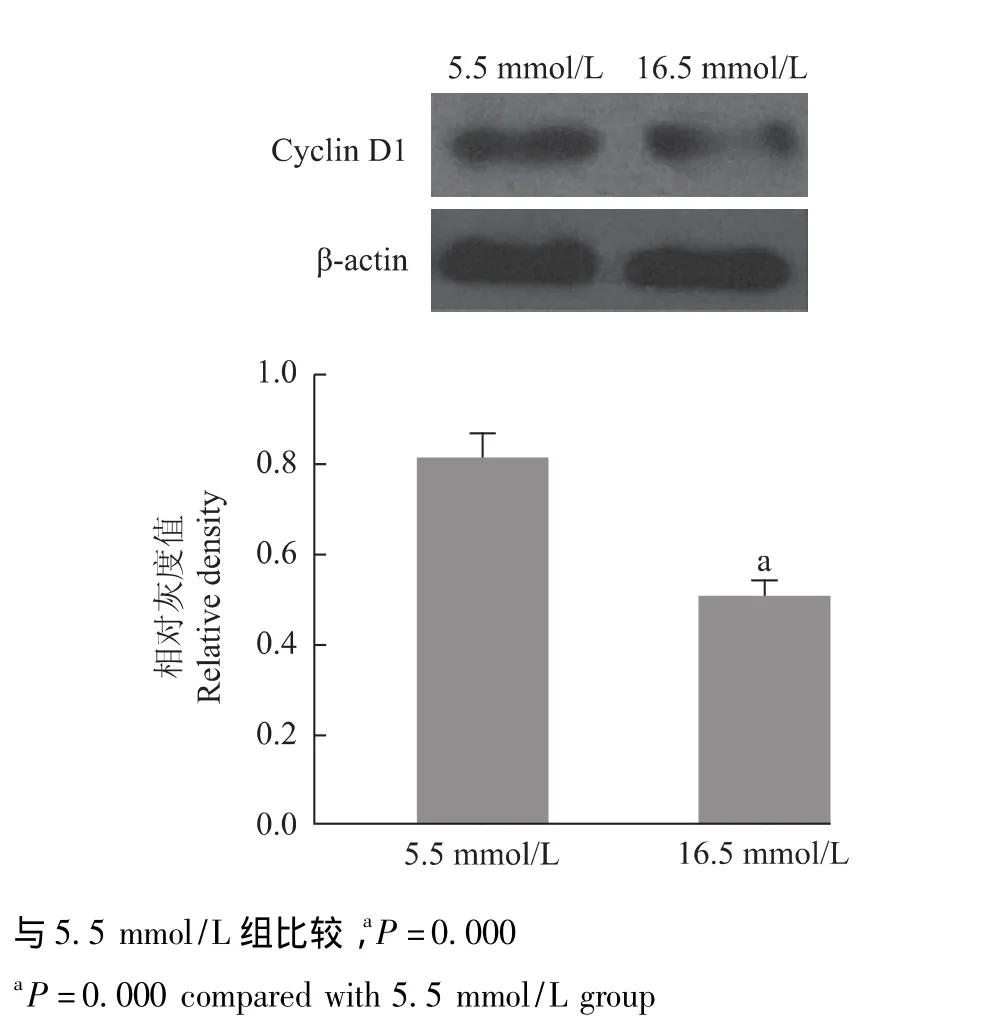
图5 不同糖浓度细胞周期蛋白D1的蛋白表达Fig 5 Protein expression of cyclin D1 on different concentrations of glucose
本研究噻唑蓝法结果与细胞周期检测结果均显示高糖环境抑制了骨髓基质细胞的增殖,这与前期学者实验得出的结果[5-7]一致。细胞周期蛋白D1核编码区通过细胞周期蛋白与CDK4结合,形成细胞周期蛋白D1/CDK4复合体,作用于其底物Rb蛋白,使得Rb蛋白磷酸化,导致细胞由G1向S期转化。因此细胞周期D是细胞由G1期向S期转换的重要限速因素,其表达可以直接影响到细胞的增殖[9-11]。本研究结果表明,高糖环境可以抑制细胞周期蛋白D1的表达,同时细胞周期的检测结果表明高糖环境下可以影响骨髓基质细胞由G1期向S期转换,这与细胞周期蛋白D1已经证实的生理功能相符。
Wnt/β-链蛋白信号通路可以影响细胞的增殖、分化、迁移等多种生理功能[14]。细胞周期蛋白 D1是Wnt/β-链蛋白信号通路下游的一个靶基因[15],已经证实高糖环境可以抑制细胞周期蛋白D1的表达,那么高糖环境是否会抑制Wnt/β-链蛋白信号通路?在经典Wnt通路中,β-链蛋白发挥重要的作用,其可以与T细胞因子/LEF-1家族成员形成转录复合物,从而促进下游目的基因的表达[16]。为了观察高糖环境对Wnt/β-链蛋白信号通路的影响,本研究检测高糖环境下β-链蛋白蛋白的表达以及LEF-1 mRNA的表达,结果表明在高糖的环境下,无论是β-链蛋白蛋白的表达还是LEF-1的mRNA的表达均受到了抑制,这与Wnt/β-链蛋白通路下游目的基因细胞周期蛋白D1的表达趋势一致。因此本研究证实高糖环境可以影响Wnt/β-链蛋白通路,从而使其下游因子细胞周期蛋白D1下调。
综上,高糖对细胞增殖的影响是一个复杂的过程,本研究初步证实高糖环境可以通过影响Wnt/β-链蛋白信号通路以及下游因子细胞周期蛋白D1的表达,从而抑制大鼠骨髓基质细胞的增殖。
[1] von Wilmowsky C,Stockmann P,Harsch I,et al.Diabetes mellitus negatively affects peri-implant bone formation in the diabetic domestic pig [J].J Clin Periodontol,2011,38(8):771-779.
[2] Dowell S,Oates TW,Robinson M.Implant success in people with type 2 diabetes mellitus with varying glycemic control[J].J Am Dent Assoc,2007,138(3):355-361.
[3] Song G,Habibovic P,Bao C,et al.The homing of bone marrow MSCs to non-osseous sites for ectopic bone formation induced by osteoinductive calcium phosphate[J].Biomaterials,2013,34(9):2167-2176.
[4] Wang X,Wang Y,Gou W,et al.Role of mesenchymal stem cells in bone regenerationand fracture repair:a review [J].Int Orthop,2013,37(12):2491-2498.
[5] Terada M,Inaba M,Yano Y,et al.Growth-inhibitory effect of a high glucose concentration on osteoblast-like cells[J].Bone,1998,22(1):17-23.
[6] Botolin S,McCabe LR.Chronic hyperglycemia modulatesosteoblast gene expression through osmotic and non-osmoticpathways[J].J Cell Biochem,2006,99(2):411-424.
[7] Gopalakrishnan V,Vignesh RC,Arunakaran J,et al.Effects of glucose and its modulation by insulin and estradiol on BMSC differentiation into osteoblastic lineages[J].Biochem Cell Biol,2006,84(1):93-101.
[8] Chang G,Zhang H,Wang J,et al.CD44 targets Wnt/βcatenin pathway to mediate the proliferation of K562 cells [J].Cancer Cell Int,2013,13(1):117.
[9] Fukumoto S,Nishizawa Y,Hosoi M,et al.Protein kinase C delta inhibits the proliferation of vascular smooth muscle cells by suppressing G1 cyclin expression[J].J Biol Chem,1997,272(21):13816-13822.
[10] Fukumoto S,Koyama H,Hosoi M,et al.Distinct role of cAMP and cGMP in the cell cycle control of vascular smooth muscle cells:cGMP delays cell cycle transition through suppression of cyclin D1 and cyclin-dependent kinase 4 activation[J].Circ Res,1999,85(11):985-991.
[11] Fukumoto S,Koyama H,Hosoi M,et al.Distinct role of cAMP and cGMP in the cell cycle control of vascular smooth muscle cells:cGMP delays cell cycle transition through suppression of cyclin D1 and cyclin-dependent kinase 4 activation[J].Circ Res,1999,85(11):985-991.
[12] 李颖,刘洪臣,鄂玲玲,等.胰岛素对高糖环境下大鼠下颌骨骨髓基质细胞成骨分化过程中Prohibitin表达的影响 [J].上海口腔医学杂志,2012,1(5):526-530.
[13] Livak KJ,Schmittgen TD.Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T))Method [J].Methods,2001,25(4):402-408.
[14] Larue L,Delmas V.The WNT/beta-catenin pathway in melanoma [J].Front Biosci,2006,11:733-742.
[15] Shtutman M,Zhurinsky J,Simcha I,et al.Thecyclin D1 gene is a target of the beta-catenin/LEF-1 pathway[J].Proc Natl Acad Sci USA,1999,96(10):5522-5527.
[16] Porfiri E,Rubinfeld B,Albert I,et al.Induction of a betacatenin-LEF-1 complex by Wnt-1 and transforming mutants of beta-catenin [J].Oncogene,1997,15(23):2833-2839.



