刘 毅,宁尚磊,陈雨信,徐克森,寿楠海
山东大学 齐鲁医院肝胆外科,济南250012
原发性肝癌是我国最常见的恶性肿瘤之一[1]。肝部分切除是目前治疗肝癌最有效的局部治疗手段之一。虽然肝脏外科技术取得较大进展,但接受肝部分切除的患者术后5年内仍有50%~60%死于肿瘤复发转移,这已成为影响肝癌患者术后疗效和获得长期生存的关键因素之一。在肝切除手术中,术中出血几乎不可避免,而出血量的多少被认为是术后恢复和预测预后的重要指标,因此控制切肝过程中出血的各种方法在世界范围内广泛应用[2],但这又会导致整个或部分肝脏缺血再灌注的发生。Ku等[3]及Yoshimoto等[4]报道手术相关缺血再灌注损伤会对大鼠肝脏肿瘤门静脉转移产生影响。van der Bilt等[5]观察到再灌注后期肝实质的坏死而非早期的肝实质损伤是造成肝癌复发转移的重要因素。目前缺血再灌注影响肝癌转移的机制尚不清楚,Lenglet等[6]、Tamagawa 等[7]及 van der Bilt等[8]认为这种现象可能与缺血再灌注导致再灌注的肝组织内某些分子表达上调有关。有研究表明肝移植时肝脏缺血再灌注损伤会诱导血管细胞黏附因子-1(vascular cell adhesion molecule-1,VCAM-1)过表达[9-10]。VCAM-1作为一种促进异种细胞间黏附的黏附因子,在肿瘤生长和转移中发挥重要作用[9]。在体外实验中,VCAM-1介导的黑色素瘤细胞黏附于小鼠的血管内皮细胞的效率被认为与这些癌细胞的转移潜能有关[9]。而这种黏附效率是建立肿瘤转移最关键的因素之一。本研究采用部分肝蒂阻断法诱导70%肝脏出现缺血再灌注损伤,后经门静脉注射H22肝癌细胞后不同时间段,观察缺血再灌注损伤对肝癌细胞门静脉转移的影响,同时在再灌注2和8 h检测各组缺血肝组织的肝酶、VCAM-1表达情况及组织病理学检查,为临床进一步探讨肝脏血流阻断对肿瘤门静脉转移的影响及改进手术方式提供初步的理论基础。
材料和方法
材料 H22-H8D8肝癌细胞株购自中国医学科学院肿瘤医院细胞中心,VCAM-1为Santa Crus(USA)产品,免疫组织化学染色试剂盒Histostain-Plus Rabbit Primary购自Invitrogen公司 (USA)。
肝脏缺血再灌注并肝癌门静脉转移模型的制作 120
只6~7周龄雄性Balb/C小鼠 (25~30 g),购自中国军事医学科学院,水合氯醛300 mg/kg腹腔内注射麻醉,参照van der Bilt等[5]的方法并做适当改进,建立小鼠肝脏部分缺血再灌注模型:取正中切口,剪开尾状叶与左肝叶之间的韧带,显露左肝和中肝的肝蒂,用无创微血管夹阻断中肝叶及左肝叶血流,造成70%肝脏缺血,不阻断右肝及尾状叶血流,缺血再灌注一定时间 (30或45 min)后,1 ml针管 (29G针头)将H22小鼠肝癌细胞株5×105细胞 (50μl)注入门静脉主干后关腹。
分组 将Balb/C小鼠按照完全随机分组的方法分为3组,每组小鼠40只,分别为假手术组:解剖出供应左肝和中肝的肝蒂但不阻断,60 min后将肝癌细胞注入门静脉;缺血30 min组:肝蒂阻断30 min再灌注30 min后将肝癌细胞注入门静脉;缺血45 min组:肝蒂阻断45 min再灌注30 min后将肝癌细胞注入门静脉。各组小鼠分别于再灌注后2 h、8 h、7 d、14 d后处死 (每个时间点分别处死10只)。肝叶分别放入10%中性甲醛或液氮中进行速冻,贮存于-80℃深低温冰箱中备测。
肝脏酶学的检测 再灌注后2和8 h取各组左肝叶应用诊断用酶试剂盒 (北京绿源博德生物科技有限公司)检测各组肝叶匀浆中谷丙转氨酶和谷草转氨酶水平。
HE染色 术后7 d处死动物,标本脱水、透明、浸蜡、包埋、切片、HE染色,观察组织病理学变化。
免疫组织化学染色 再灌注后2和8 h,取各组左肝叶 (缺血肝),采用免疫组织化学加强型链霉菌抗生物素蛋白过氧化物酶法,检测肝组织中VCAM-1蛋白的表达情况。
实时荧光定量PCR检测VCAM-1 mRNA 再灌注后2和8 h,取各组左肝叶 (缺血肝),提取总RNA,按逆转录试剂盒说明书合成cDNA,引物设计软件5.0,北京赛百盛公司合成。引物序列如下:βactin(93bp)上游引物:5’-CAGAAGGAGATTACTGCTCTGGCT-3’,下游引物:5’-GGAGCCACCGATCCACACA-3’;VCAM-1(387bp)上游引物:5’-TCGCGGTCTTGGGAGCCTCA-3’,下游引物:5’-CCGTGACCGGCTTCCCAACC-3’。扩增在GeneAmp 5700荧光定量PCR仪进行,反应条件:95.0℃ 10 min,95.0℃ 25 s,55.0℃ 25 s,72.0℃ 50 s,72.0℃ 5 min,扩增40个循环,电脑自动记录反应管中的荧光信号值,反应结束由PE 5700软件分析结果。
肝脏受侵犯面积测定 根据预实验结果,肝脏转移灶形式各异,单纯用肿瘤的数目或体积很难对肿瘤负荷情况进行准确的评估,故采用肝脏受侵犯面积 (hepatic replacement area,HRA)作为肝脏肿瘤负荷的评价指标[5]。随机选取各组HE切片,在低倍显微镜下计算该视野下肿瘤所侵犯的面积占视野中肝脏面积的百分比。
统计学处理 采用GraphPad.Prism.v5.0统计软件,数据以珋x±s表示,两组之间比较采用独立样本非参数Mann-Whitney U检验。生存分析采用Kaplan-Meier法,两个变量之间相关性用Spearman非参数相关分析,P<0.05为差异有统计学意义。
结 果
缺血再灌注对肝功能的影响 肝脏缺血再灌注2 h后,缺血45 min组和缺血30 min组的谷丙转氨酶、谷草转氨酶水平显着高于假手术组 (P均<0.05),且缺血45 min组较缺血30 min组谷丙转氨酶、谷草转氨酶水平变化更加明显 (P均<0.05)。假手术组术后谷丙转氨酶和谷草转氨酶均一过性轻度升高,缺血45 min组和缺血30 min组谷丙转氨酶和谷草转氨酶水平在8 h表达均较2 h时高 (P均<0.05)(图1)。
缺血再灌注对荷瘤小鼠生存时间的影响 缺血30 min组中2/10小鼠在术后14 d存活,假手术组中6/10小鼠术后14 d存活。中位生存时间:假手术组16.3 d,缺血30 min组12.1 d,缺血45 min组9.6 d,假手术组与缺血30 min组比较,差异有统计学意义(P=0.041),缺血30 min组与缺血45 min组比较,差异无统计学意义 (P=0.055)(图2)。
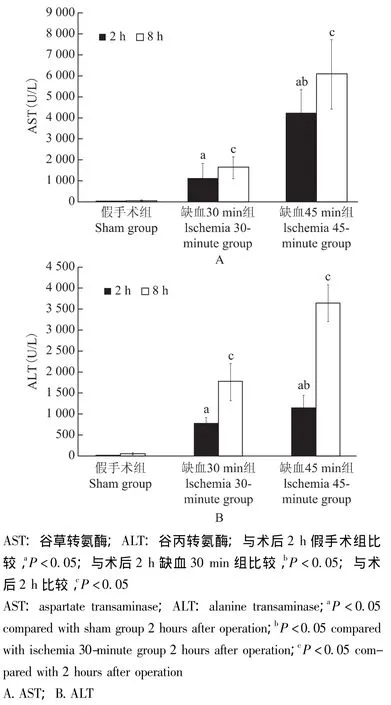
图1 不同处理方式对肝功能的影响Fig 1 Influence of different treatment modes on the liver function
缺血再灌注对小鼠肝癌细胞门静脉侵袭转移的影响 大体标本观察显示缺血30 min组术后14 d几乎均存在肝脏转移 (9/10),肝脏普遍增大,肿瘤面积较假手术组大,多数呈结节型,灰白色,质硬、脆,浸润性或膨胀性生长;假手术组3/10存在肝肿瘤转移,肝叶较缺血30 min组小,肿瘤面积较小,多成点状或小结节状。组织学检查显示肝细胞坏死存在于几乎所有荷瘤小鼠的肝叶中,假手术组为点状或小片状坏死占整个肝面积的5%~7%,缺血30 min组坏死灶多为团状或大片状,占整个肝面积的15%~25%,坏死灶通常出现在肿瘤周围伴较多的炎症细胞浸润 (图3)。假手术组左肝叶的HRA较缺血30 min组显着减少 (P=0.032),但假手术组右肝叶的HRA与缺血30 min组右肝叶比较,差异无统计学意义 (P=0.089);缺血45 min组左肝叶的肿瘤负荷较缺血30 min组和假手术组高 (P=0.013,P=0.007)(图4)。
缺血再灌注时间对小鼠肝癌细胞门静脉侵袭转移的影响 缺血45 min组中位生存时间9.6 d与缺血30 min组12.1 d比较,差异无统计学意义 (P=0.055),仅有1只小鼠生存期超过14 d(图2);HE染色显示缺血45 min组的肝叶被侵犯面积最多 (29.7±13.3)%,坏死面积更大 (25% ~35%)(图3)。
缺血再灌注对肝组织VCAM-1表达的影响 免疫组织化学染色结果显示,胞膜和胞浆呈黄褐色为VCAM-1阳性细胞,主要见于肝窦内皮细胞、少部分白细胞和肝细胞 (图5)。缺血45 min组VCAM-1蛋白水平在再灌注8 h时明显高于缺血30 min组和假手术组(P均<0.05)(图6)。对VCAM-1蛋白和HRA进行Spearman分析显示两者呈正相关 (r=0.491,P=0.045)。再灌注8 h时,缺血30 min组中VCAM-1 mRNA的表达水平是假手术组的4倍以上,缺血45 min组在再灌注2和8 h时,VCAM-1的表达水平均明显高于缺血30 min组和假手术组 (P均<0.05)(图7)。
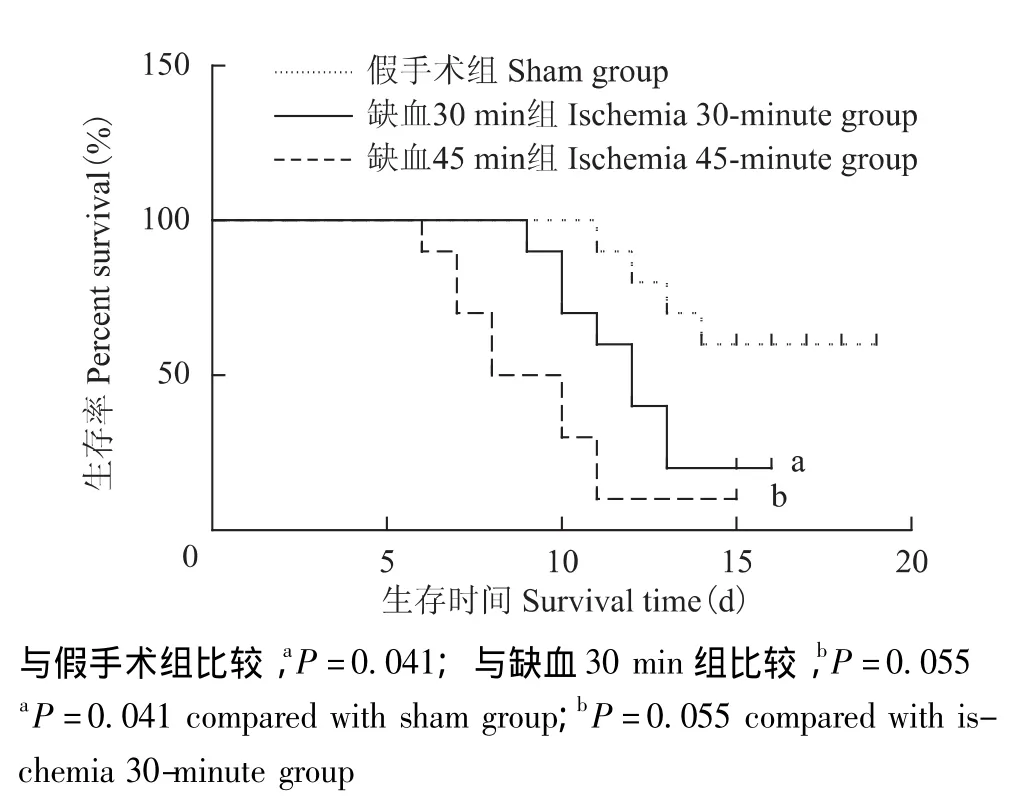
图2 不同处理组小鼠生存时间比较Fig 2 Survival time in different groups
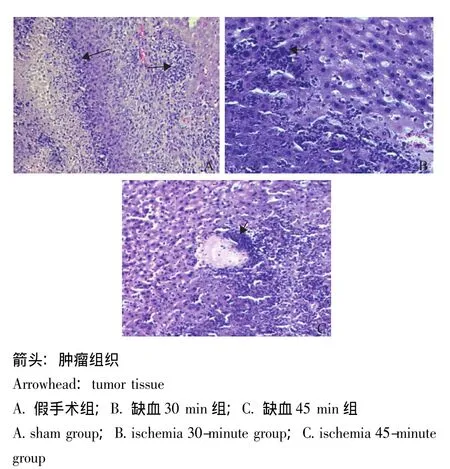
图3 不同处理方式对小鼠肝癌门静脉转移的影响 (术后第7天)(HE染色,×100)Fig 3 Tumor growth and metastasis on the portal vein metastasis in mice with different treatment modes(7 days after operation)(HE×100)

图4 术后7 d各组HRA比较Fig 4 HRA on different groups 7 d after operation

图5 不同处理组再灌注8 h时,VCAM-1免疫组织化学染色结果 (×200)Fig 5 VCAM-1 immunostaining 8 hours after hepatic ischemia/reperfusion with different treatment modes(×200)
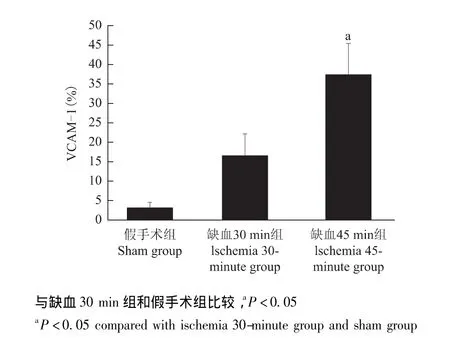
图6 不同处理方式在术后8 h对各组VCAM-1阳性细胞数定量分析结果Fig 6 Quantitative analysis on the VCAM-1-positive cells in different groups by different treatment modes 8 h after operation
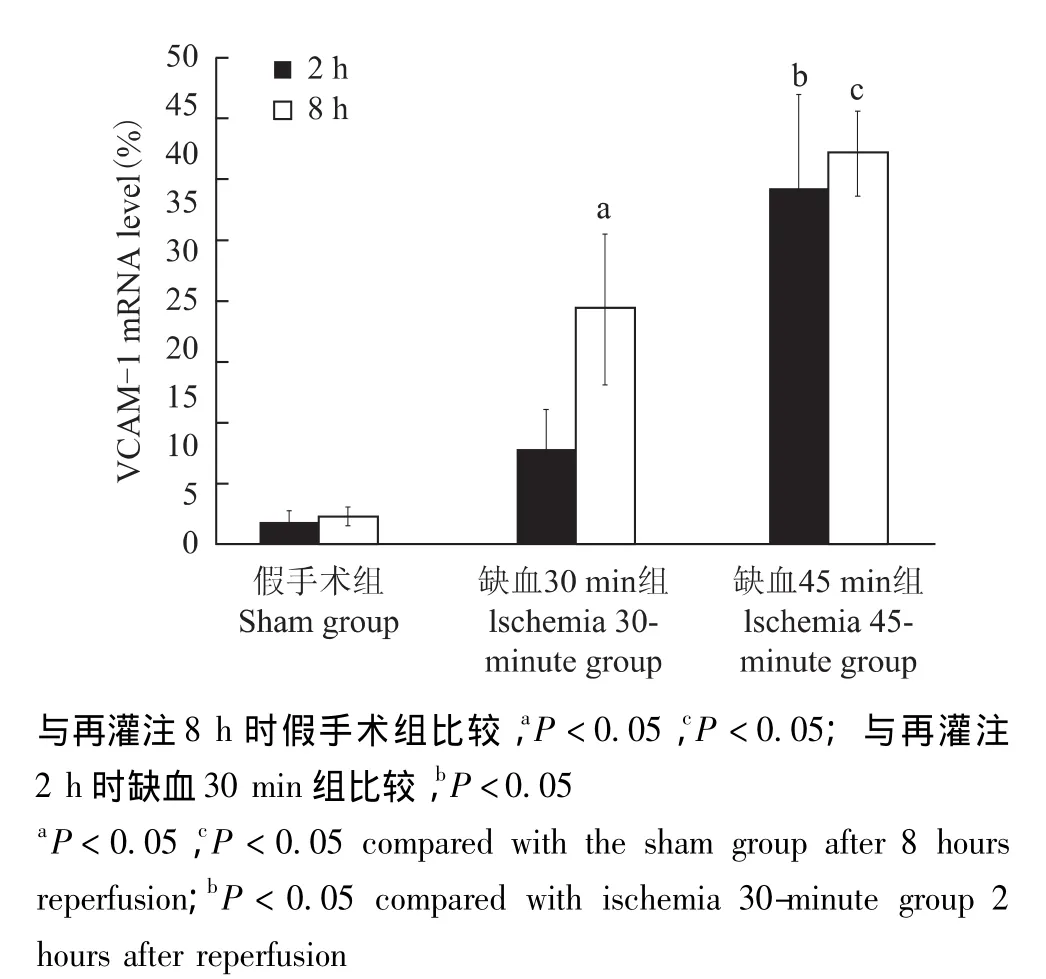
图7 不同处理方式在术后2、8 h各组小鼠VCAM-1 mRNA表达情况Fig 7 VCAM-1 mRNA expression in different groups by different treatment modes 2 and 8 hours after operation
讨 论
近年来,虽然各种新的治疗肝癌的手段不断涌现,肝切除术仍然在根治性肝癌局部治疗方法中占据主导地位[1-2]。然而目前肝癌术后5年内复发率达50% ~60%[2],肝癌切除术后的复发转移是目前导致肝癌患者术后死亡的主要因素[1]。肝癌切除不彻底、术后残留肿瘤继续生长,是肝癌早期复发转移的最直接原因。但临床实践发现很多实现根治性切除的肝癌患者术后大多会发生复发转移,提示存在其他因素诱导肿瘤转移复发。
本研究证实肝脏缺血再灌注能够促进H22细胞肝脏门静脉转移。首先缺血30 min组肿瘤侵犯面积远较假手术组多,缺血45 min组与缺血30 min组在肿瘤负荷方面差异有统计学意义,即缺血再灌注能够促进肿瘤细胞门静脉转移且与缺血时间呈正相关;其次研究显示肿瘤一般最先出现在缺血肝叶脏面的边缘处,后期遍布整个肝脏。笔者认为这是由于缺血肝叶边缘处相对于肝脏其他部位对缺血再灌注更为敏感的缘故,还可能因该处微血管管径细小,由于机械原因肿瘤细胞在此处滞留时间较长。另外本研究显示缺血组的右肝 (非缺血肝叶)和假手术组的右肝相比,肿瘤负荷差异无统计学意义,这与van der Bilt等[8]研究结果不一致,van der Bilt等[8]将RCH-H4结肠癌细胞注射入大鼠脾实质,3 d后进行缺血再灌注,结果显示缺血组的非缺血肝叶较假手术组的肝叶肿瘤门静脉转移率高,他们认为可能与肝缺血再灌注产生的某些诱导因子被释放入血,到达非缺血肝叶,加速了肿瘤转移,而本研究结果提示肝脏缺血再灌注对于循环中肿瘤细胞的跨膜转移内在机制局限于缺血组织的局部与系统释放因子无关。这种差异笔者认为可能与选择的模型及动物品种的不同有关。
VCAM-1是一种细胞表面跨膜糖蛋白,在内皮细胞等多种类型细胞表面表达,主要介导异型细胞黏附等作用[9]。本研究在基因和蛋白两个水平上检测VCAM-1随肝脏缺血时间的变化情况。VCAM-1的表达活性在再灌注2 h时开始升高,到8 h达到高峰,缺血时间越长,VCAM-1表达量越高,对VCAM-1蛋白和HRA进行Spearman分析,提示两者存在正相关。肝窦内皮细胞、Kupffer细胞等受缺血再灌注刺激后上调VCAM-1表达,能够增加肿瘤细胞在肝窦和血管内皮细胞表面滚动时的黏附,引起内皮细胞回缩,暴露细胞外基质,促进肿瘤细胞实现跨膜转移[9]。VCAM-1随缺血时间延长而表达升高,部分解释了缺血再灌注能够促进肿瘤门静脉转移的原因。
综上,本研究证实肝脏缺血再灌注可以促进小鼠肿瘤细胞门静脉转移的发生。VCAM-1表达升高与肿瘤细胞门静脉转移呈正相关。因为转移的肿瘤负荷和VCAM-1的表达随缺血时间的延长而增高,故缩短肝门阻断时间可能有利于减少肝外科手术中肿瘤的门静脉转移。
[1] Lu W,Dong J,Huang Z,et al.Comparison of four current staging systems for Chinese patients with hepatocellular carcinoma undergoing curative resection:Okuda,CLIP,TNM and CUPI[J].J Gastroen Hepatol,2008,23(12):1874-1878.
[2] Makuuchi M,Takayama T,Kubota K,et al.Hepatic resection for hepatocellular carcinoma:Japanese experience [J].Hepatogastroenterology,1998,45(3):1267-1274.
[3] Ku Y,Kusunoki N,Shiotani M,et al.Stimulation of haematogenou liver metastases by ischaemia-reperfusion in rats [J].Eur J Surg,1999,165(8):801-807.
[4] Yoshimoto K,Tajima H,Ohata T,et al.Increased E-selectin in hepatic ischemia-reperfusion injury mediates liver metastasis of pancreatic cancer[J].Oncol Rep,2012,28(3):791-796.
[5] van der Bilt JD,Kranenburg O,Nijkamp MW,et al.Ischemia/reperfusion accelerates the outgrowth of hepatic micrometastases in a highly standardized murine model[J].Hepatology,2005,42(1):165-175.
[6] Lenglet S,Mach F,Montecucco F.Matrix metalloproteinase-9:a deleterious link between hepatic ischemia-reperfusion and colorectal cancer [J].World J Gastroenterol,2012,18(48):7131-7133.
[7] Tamagawa K,Horiuchi T,Uchinami M,et al.Hepatic ischemia-reperfusion increases vascular endothelial growth factor and cancer growth in rats[J].J Surg Res,2008,148(2):158-163.
[8] van der Bilt JD,Soeters ME,Duyverman AM,et al.Perinecrotic hypoxia contributes to ischemia/reperfusion-accelerated outgrowth of colorectal micrometastases [J].Am J Pathol,2007,170(4):1379-1388.
[9] Mendoza L,Carrascal T,De Luca M,et al.Hydrogen peroxide mediates vascular cell adhesion molecule-1 expression from interleukin-18-activated hepatic sinusoidal endothelium:implications for circulating cancer cell arrest in the murine liver[J].Hepatology,2001,34(2):298-310.
[10] Vidal-Vanaclocha F,Fantuzzi G,Mendoza L,et al.Anasagast,IL-18 regulates IL-1b-dependent hepatic melanoma metastasis via vascular cell adhesion molecule-1 [J].PNAS,2000,97(2):734-739.



