竟晓慧,李凌雪,韩涛涛,史 娟
中国医学科学院基础医学研究所 北京协和医学院基础学院 医学分子生物学国家重点实验室,北京 100005
胃癌仍然是全球癌症死亡的重要原因之一[1],幽门螺旋杆菌(helicobacterpylori,HP)感染以及环境和遗传因素通常与胃癌的致癌作用有关。1994年,世界卫生组织正式将HP列为胃癌的I类致癌因子。2005年Marshall和Warren教授因发现HP和慢性胃炎以及消化性溃疡的关系获得诺贝尔生理和医学奖[2]。HP感染胃黏膜后,能够在胃酸中存活,免疫反应无法将其清除,并发展成慢性炎症[3],炎症反应越强烈,组织损伤越大,例如导致胃黏膜细胞萎缩,更大的萎缩导致化生和异常增生,增加胃癌风险[4]。研究显示HP感染可以促进许多促炎细胞因子的表达,如肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素(interleukin,IL)-1β、IL-6和IL-8等,这些炎性因子可能在胃癌的发展中发挥关键作用[5]。研究表明,长链非编码RNA(long non-coding RNA,lncRNA)通过与DNA、RNA和蛋白质相互作用,在不同水平调节基因表达,调控细胞增殖、细胞周期、细胞凋亡、侵袭、迁移、转移等,在癌症发生发展中发挥重要作用[6-8]。长链非编码RNA浆细胞瘤多样异位基因1(plasmacytoma variant translocation 1,PVT1)在消化系统癌症中表达升高并且与预后不良相关,被视为消化系统癌症的新兴生物标志物[9]。本研究主要探讨 PVT1在HP感染中引起的炎性反应及其在胃癌细胞迁移中发挥的作用。
材料和方法
材料胎牛血清(Gibco公司),RPMI1640培养基和DMEM培养基(Hyclone公司),Hieff TransTM脂质体转染试剂(上海翊圣生物科技有限公司),Trizol(美国英杰生命技术有限公司),RNA酶抑制剂和实时荧光定量PCR预混物(北京全式金生物技术有限公司),逆转录(美国普洛麦格公司),小干扰RNA(small interfering RNA,siRNA)(上海吉玛制药技术有限公司),无菌脱纤维羊血(北京索莱宝科技有限公司),选择性添加剂(SR0147E),哥伦比亚血琼脂基础培养基(CM0331B),脑心浸液琼脂干粉(英国Oxoid公司),幽门螺旋杆菌(国际标准株NCTC 11637,本室保存),人胃癌细胞系SGC-7901、MGC-803(中国医学科学院基础医学研究所细胞资源中心),人胃黏膜正常细胞系GES1(本室保存)。
HP的培养取-80 ℃冻存的HP菌株,37 ℃水浴复苏后,用脑心浸液重悬,涂布于哥伦比亚血琼脂平板上,倒置放于密封培养罐中,加入微需氧产气袋,37 ℃恒温培养箱潮湿培养,培养72 h后收菌。用无双抗无血清的RPMI1640培养基重悬HP,然后紫外分光光度计下测量波长为600 nm时的吸光值(A600),A600=1表示1×108cfu/ml。
细胞转染以6孔板为例,用无血清无双抗的培养基饥饿细胞2 h,PVT1小干扰RNA(PVT1 small interfering RNA,siPVT1)及对照小干扰RNA(negative control small interfering RNA,siNC)各100 pmol分别与无血清无双抗的培养基混合终体积为250 μl,同时将5 μl脂质体核酸转染试剂与245 μl无血清无双抗的培养基轻柔混合均匀,充分混匀后室温静置5 min,然后将含有脂质体核酸转染试剂的培养基与含有siRNA的培养基混合均匀,室温静置20 min,将混合物加至含有1500 μl无血清无双抗培养基的6孔板中,在37 ℃的细胞培养箱中继续培养,然后在不同时间点提取细胞的总RNA,进行后续实验。
实时定量PCR检测PVT1及相关炎性细胞因子TNF-α、IL-1β、IL-6和IL-8的表达,以GAPDH作为内参进行相对定量:用Trizol法提取细胞总RNA。Nanodrop紫外分光光度计测定RNA的浓度以及纯度,用2 μg总RNA进行逆转录,逆转录产物用于进行PCR反应,PCR反应过程严格按试剂盒说明书(Transgen公司,货号:AQ141)进行,数据以2-ΔΔCt法计算基因表达的倍数改变。所用引物由上海生工生物工程有限公司合成,引物序列见表1。
划痕愈合实验检测细胞的迁移率提前在6孔板的底部(外侧)画3条平行线,6孔板内接种的细胞量以12 h后细胞的汇合度达到80%为最佳,然后进行转染,对转染24 h后的细胞进行细胞划痕并将此刻定为划痕实验的0 h,镜下观察以获取6 、24 和48 h同一位置细胞的迁移情况,细胞迁移率以迁移距离的相对百分率为依据。
RNA下拉实验联合质谱分析用培养72 h、新鲜收获的HP菌,以感染复数200∶1的比例感染SGC-7901细胞6 h,提取细胞的总蛋白。体外转录合成3种探针,即无生物素标记的正义PVT1、生物素标记的反义PVT1和生物素标记的正义PVT1。探针将与总蛋白中能与之结合的特定蛋白进行结合,利用能够与生物素结合的链霉素珠子对RNA-蛋白复合物进行富集。经过十二烷基硫酸钠聚丙烯酰胺凝胶电泳和银染实验分析后,找出差异蛋白条带,对其进行液相色谱(liquid chromatography,LC)-质谱(mass spectrum,MS)/MS检测。
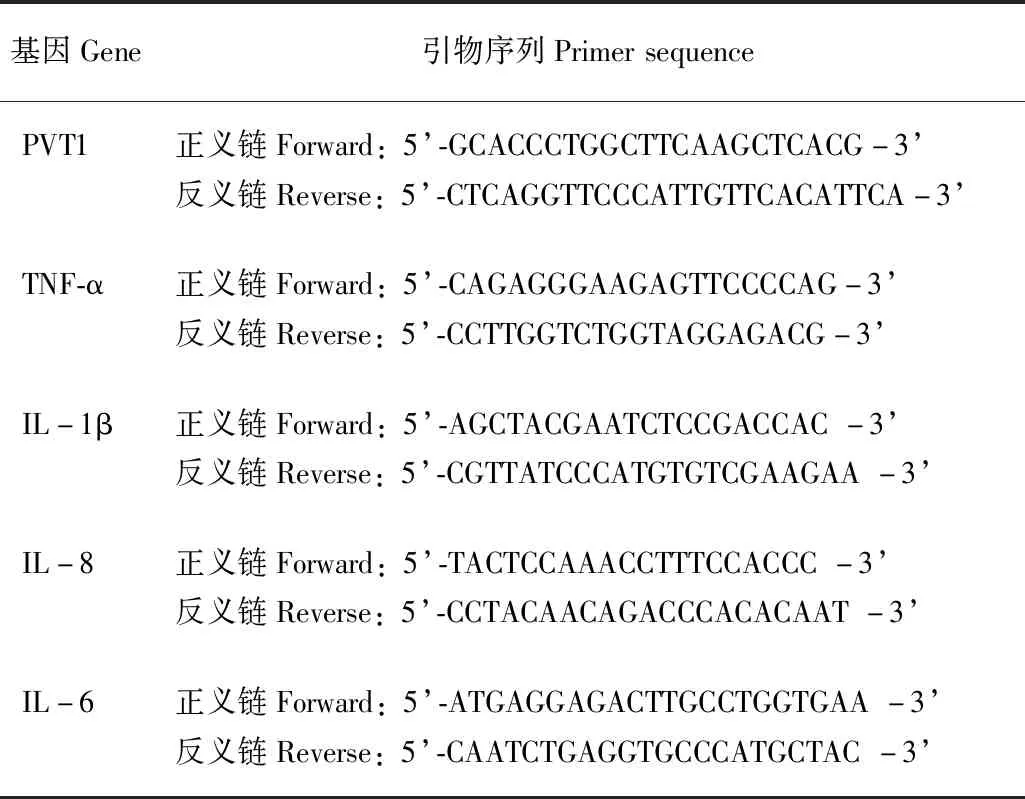
表1 定量PCR引物序列Table 1 Primer sequences used in PCR
PVT1:浆细胞瘤多样异位基因1;TNF-α:肿瘤坏死因子-α;IL:白介素
PVT1:plasmacytoma variant translocation 1;TNF-α:tumor necrosis factor-α;IL:interleukin
统计学处理所有实验重复3次,实验数据用均数±标准差表示,用SPSS 20.0进行统计分析,Graph Pad prism软件进行作图[10]。P<0.05为差异有统计学意义。
结 果
PVT1在HP感染的GES-1细胞中的表达实时荧光定量PCR结果显示,PVT1在HP感染72 h的GES-1细胞中上调9.9500倍,差异有统计学意义(t=7.160,P=0.019)。
敲低胃癌细胞中的PVT1对HP感染引起的炎性反应的影响用siPVT1转染胃癌细胞SGC-7901,通过实时荧光定量PCR的方法检测siRNA的抑制效率,与对照组siNC相比,PVT1敲低了35%(t=3.446,P=0.026)(图1A)。敲低PVT1后,SGC-7901与HP共培养6 h,实时定量PCR检测显示TNF-α、IL-1β、IL-8的表达受到明显抑制,TNF-α的表达下调0.3748倍(t=3.899,P=0.011),IL-1β的表达下调0.5910倍(t=14.610,P=0.000),IL-8的表达下调0.4386倍(t=6.557,P=0.001)(图1B)。
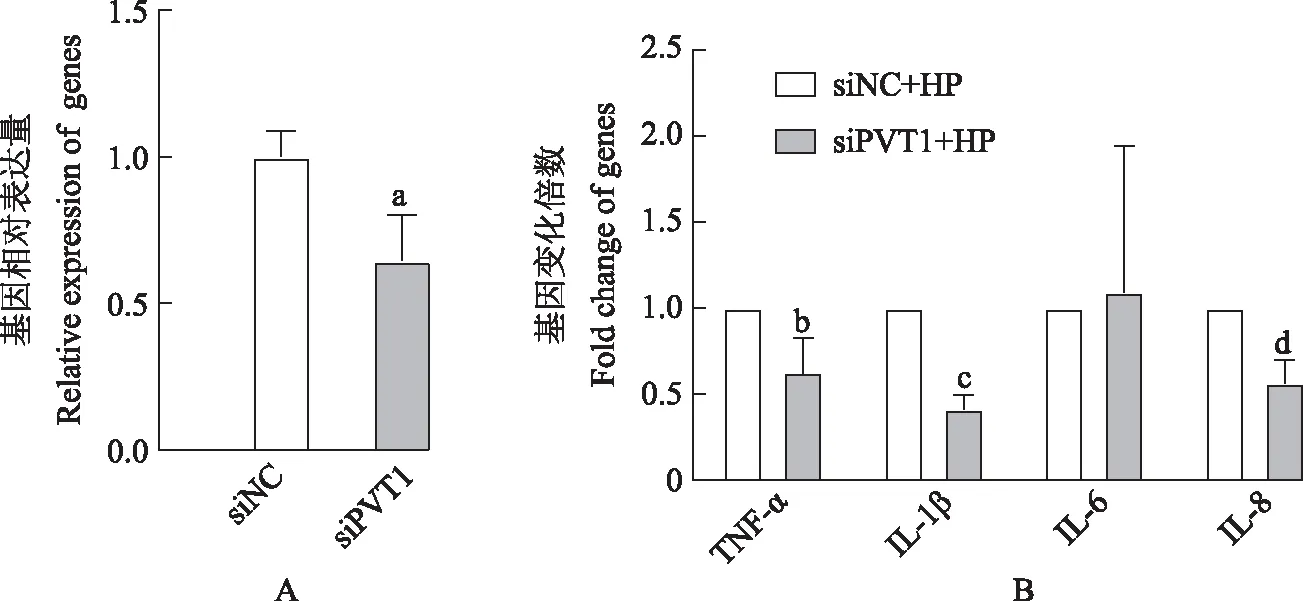
敲低PVT1对胃癌细胞迁移能力的影响在GES-1、SGC-7901和AGS细胞中,瞬时转染siRNA以敲低PVT1,在不同时间点拍照检验其细胞迁移能力,结果显示细胞迁移能力受到不同程度的抑制(图2)。
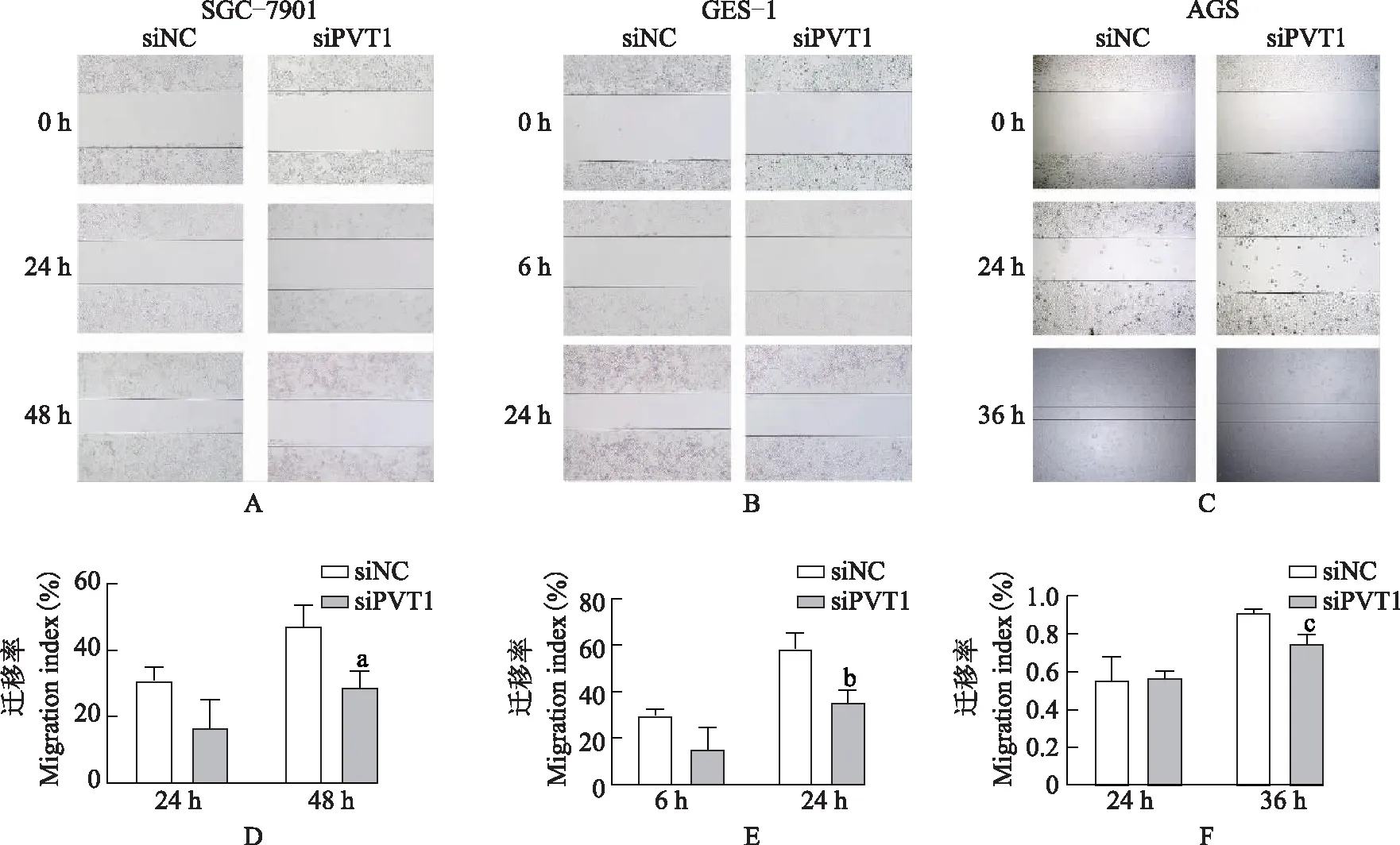
稳定低表达PVT1的MGC-803细胞迁移能力的变化用表达PVT1 短发夹RNA的慢病毒感染MGC-803细胞,构建PVT1稳定低表达的细胞株,命名为MGC-803-shPVT1,PVT1的表达在MGC-803中的抑制率约为29%(t=30.880,P=0.001)(图3A、3B)。对MGC-803-shPVT1细胞进行划痕愈合实验,当细胞在6孔板中达到90%汇合度时,用200 μl枪头进行划痕,并将细胞培养0、24、48 h,检测细胞愈合能力,结果显示培养48 h后,抑制PVT1的内源性表达后,细胞的迁移能力降低(t=6.103,P=0.009)(图3C、3D)。
HP:幽门螺旋杆菌;siNC:对照组小干扰RNA;siPVT1:PVT1 小干扰RNA;与siNC比较,at=3.446,aP=0.026;与siNC+HP比较,bt=3.899,bP=0.011;ct=14.610,cP=0.000;dt=6.557,dP=0.001
HP:helicobacterpylori;siNC:negative control small interfering RNA;siPVT1:PVT1 small interfering RNA;at=3.446,aP=0.026 compared with siNC;bt=3.899,bP=0.011;ct=14.610,cP=0.000;dt=6.557,dP=0.001 compared with siNC+HP
A. 实时定量PCR检测转染小干扰RNA后胃癌细胞SGC-7901中PVT1的表达;B. 实时定量PCR检测PVT1敲低的胃癌细胞中HP感染6 h后炎症因子的表达
A. expressions of PVT1 genes detected by quantitative real-time polymerase chain reaction in SGC-7901 cells with small interfering RNA transfection;B. expressions of inflammatory cytokines detected by quantitative real-time polymerase chain reaction in PVT1 knockdown SGC-7901 cells with HP infection for 6 hours
图1敲低胃癌细胞SGC-7901中的PVT1对HP感染引起的炎性反应的影响
Fig1Expressions of inflammatory cytokines were influenced in PVT1 knockdown SGC-7901 cells with HP infection
与siNC比较,at=4.033,aP=0.016;bt=4.092,bP=0.026;ct=4.541,cP=0.045
at=4.033,aP=0.016;bt=4.092,bP=0.026,ct=4.541,cP=0.045 compared with siNC
A. PVT1敲低后,SGC-7901细胞的划痕愈合实验(×5);B. PVT1敲低后,GES-1细胞的划痕愈合实验(×5);C. PVT1敲低后,AGS细胞的划痕愈合实验(×5);D. PVT1敲低后,SGC-7901细胞的迁移率;E. PVT1敲低后,GES-1细胞的迁移率;F. PVT1敲低后,AGS细胞的迁移率
A. wound healing assay in SGC-7901 cells with PVT1 knockdown (×5);B. wound healing assay in GES-1 cells with PVT1 knockdown (×5);C. wound healing assay in AGS cells with PVT1 knockdown (×5);D. migration index of SGC-7901 cells with knockdown of PVT1;E. migration index of GES-1 cells with knockdown of PVT1;F. migration index of AGS cells with knockdown of PVT1
图2敲低PVT1表达对细胞迁移能力的影响
Fig2Knockdown of PVT1 influences migration of cells
shNC:对照组短发夹RNA;shPVT1:PVT1短发夹RNA;与shNC比较,at=30.880,aP=0.001;与siNC比较,bt=6.103,bP=0.009
shNC:negative control short hairpin RNA;shPVT1:PVT1 short hairpin RNA;at=30.880,aP=0.001 compared with shNC;bt=6.103,bP=0.009 compared with siNC
A. 流式细胞仪筛选具有绿色荧光蛋白的PVT1敲低细胞;B. 实时定量PCR检测PVT1的表达;C. 稳定低表达PVT1的MGC-803细胞的划痕愈合实验;D. PVT1敲低后,MGC-803细胞的迁移率
A. screening PVT1 knockdown cells with green fluorescent protein through flow cytometry;B. relative expression of PVT1 was quantitied by quantitative real-time polymerase chain reaction;C. wound healing assay of MGC-803 cells with PVT1 stable low expression;D. migration index of MGC-803 cells with knockdown of PVT1
图3稳定低表达PVT1的MGC-803细胞的迁移能力
Fig3The migration index of MGC-803 cells with PVT1 knockdown
PVT1相互作用蛋白的鉴定结果利用RNA下拉实验联合质谱分析技术鉴定与PVT1相结合的蛋白。RNA下拉实验联合蛋白银染寻找差异蛋白条带(图4)。将差异蛋白切下,进行LC-MS/MS质谱检测,共鉴定出41个可能与PVT1结合的蛋白(表2)。
RNA下拉实验联合Western blot对PVT1结合蛋白的验证结果根据质谱分析结果,在59个蛋白中,选取评分最高的RPS8蛋白进行RNA下拉实验联合Western blot 验证,结果显示RPS8蛋白能够与PVT1相互作用(图5)。
讨 论
胃癌是常见的严重影响人类健康的消化道肿瘤之一,lncRNA是一类相对知之甚少的RNA,正在成为生物调节中潜在的重要参与者。有研究表明lncRNA通过在细胞核和细胞质中的多种分子机制调节许多不同水平的基因表达介导其功能作用[11]。

表2 质谱分析结果中可能与PVT1结合的蛋白Table 2 Proteins that may bind to PVT1 in mass spectrometry
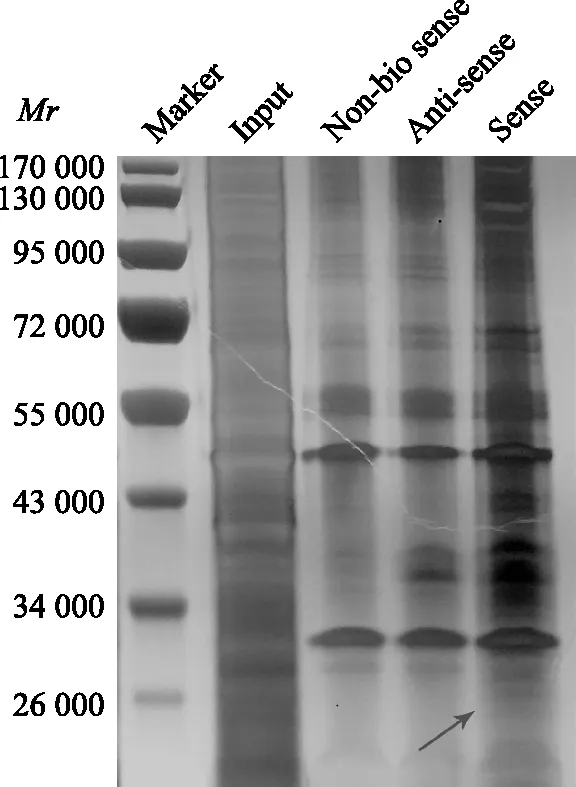
Mr:相对分子质量;Marker:预染蛋白Marker;Input:细胞总蛋白;Non-bio sense:无生物素标记的正义PVT1;Anti-sense:生物素标记的反义PVT1;Sense:生物素标记的正义PVT1
Mr:relative molecular mass;Marker:prestained protein Marker;Input:total protein;Non-bio sense:biotin-free sense PVT1;Anti-sense:biotinylated antisense PVT1;Sense:biotinylated sense PVT1
图4RNA下拉实验联合银染检测PVT1可能结合的蛋白(箭头)
Fig4RNA-pulldown and silver staining was performed to screen the protein (arrow) might interact with PVT1

Mr:相对分子质量;Input:细胞总蛋白;Non-bio sense:无生物素标记的正义PVT1;Anti-sense:生物素标记的反义PVT1;Sense:生物素标记的正义PVT1
Mr:relative molecular mass;Input:total protein;Non-bio sense:biotin-free sense PVT1;Anti-sense:biotinylated antisense PVT1;Sense:biotinylated sense PVT1
图5RNA下拉实验联合Western blot验证PVT1与RPS8蛋白的相互作用
Fig5PVT1 may interact with RPS8 protein,as validated by RNA-pulldown and Western blot
本研究前期从HP感染胃黏膜正常上皮细胞(GES-l)的lncRNA表达谱芯片中挑选到差异表达明显的lncRNA:PVT1。在HP感染细胞后,HP引起胃黏膜正常细胞的炎性反应,TNF-α、IL-1β、IL-6和IL-8等相关炎性细胞因子均表达上调,而在敲低 PVT1后再与HP共培养,则会引起炎性相关因子TNF-α、IL-1β、IL-6和IL-8的表达明显下调。同时,通过划痕愈合实验,在敲低PVT1后,细胞的迁移能力受到明显的抑制,因此,笔者推测PVT1可能通过负反馈调节炎性细胞因子的表达,并对胃癌细胞迁移发挥作用,其具体的机制还有待于进一步深入研究。另外,通过RNA下拉实验联合质谱分析技术以及RNA下拉实验联合Western blot推测核糖体蛋白S8(ribosomal protein S8,RPS8)蛋白能够与PVT1相互作用,RPS8蛋白属于S8E核糖体蛋白家族,在多个肿瘤中都发现RPS8基因过表达[12-14],但是,RPS8蛋白与PVT1相互作用的机制和功能还需要进一步探究。
随着高通量筛选和测序技术的发展,已发现数千种癌症相关的lncRNA,其中许多有可能用于诊断或预后评估。虽然lncRNA在肿瘤发生发展中的作用机制尚不完全清楚,但为肿瘤的预防、诊断及靶向治疗提供了新思路。



