耿志军 黄菊 李晴晴 周芷萱 李静 张小凤 王炼 王月月 宋雪 左芦根
基金项目:安徽省高校自然科学研究项目(KJ2020A0563)、安徽省卫生健康科研项目(AHWJ2022a019)和癌症转化医学安徽省重点实验室开放课题(KFDX202202)
摘要:目的 分析丝氨酸/苏氨酸磷酸蛋白磷酸酶4C(PPP4C)在胃癌中的表达水平及与预后的相关性,并探究其可能的作用途径和机制。方法 收集2012年1月至2016年8月蚌埠医学院第一附属医院收治的104例胃癌患者的临床资料,采用免疫组织化学染色技术检测胃癌组织中PPP4C和Ki-67的表达水平。培养BGC823和HGC27胃癌细胞,分别转染PPP4C敲减、过表达和对照慢病毒载体,分析PPP4C对细胞周期和增殖的影响及可能的调控机制。结果 PPP4C在胃癌组织中呈高表达(P<0.001),且与肿瘤的恶性进展呈正相关(P均<0.01)。单因素和Cox回归模型分析显示,PPP4C高表达是影响胃癌患者术后5年生存率的独立危险因素(P=0.003)。基因功能注释和京都基因与基因组组百科全书富集分析提示PPP4C生物学功能可能与细胞周期有关。相关性分析显示胃癌组织中PPP4C与Ki-67的表达量呈正相关(P<0.001)。上调PPP4C增加S期胃癌细胞比例和减缓G2/M期阻滞,并促进细胞增殖以及Cyclin D1和细胞分裂蛋白激酶6(CDK6)、p53的表达(P均<0.05);下调PPP4C减少S期胃癌细胞比例和促进G2/M期阻滞,抑制细胞增殖以及Cyclin D1、CDK6和p53的表达(P均<0.05)。p53抑制剂促进PPP4C敲减组BGC823和HGC27胃癌细胞的增殖(P<0.001,P<0.001),p53激活剂抑制PPP4C过表达组BGC823和HGC27胃癌细胞的增殖(P<0.001,P=0.002)。结论 PPP4C在胃癌中高表达且影响患者预后,其可能通过抑制p53信号通路增加S期胃癌细胞比例和减缓G2/M期阻滞,进而促进细胞增殖。
关键词:胃癌;丝氨酸/苏氨酸磷酸蛋白磷酸酶4C;预后;细胞周期;p53
中图分类号: R735.2 文献标志码: A 文章编号:1000-503X(2023)05-0721-09
DOI:10.3881/j.issn.1000-503X.15568
Association of Serine/Threonine Phosphoprotein Phosphatase 4C Expression With Prognosis of Gastric Cancer
GENG Zhijun1,2,HUANG Ju3,LI Qingqing3,ZHOU Zhixuan2,LI Jing1,3,ZHANG Xiaofeng1,2,WANG Lian1,4,WANG Yueyue1,3,SONG Xue1,2,ZUO Lugen1,4
1Anhui Province Key Laboratory of Basic and Translational Research of Inflammation-Related Diseases,2Central Laboratory,3Department of Clinical Laboratory,4Department of Gastrointestinal Surgery,The First Affiliated Hospital of Bengbu Medical College,Bengbu,Anhui 233000,China
Corresponding author:ZUO Lugen Tel:0552-3086267,E-mail:zuolugen@bbmc.edu.cn
ABSTRACT:Objective To investigate the expression level of serine/threonine phosphoprotein phosphatase 4C(PPP4C)in gastric cancer,and analyze its relationship with prognosis and the underlying regulatory mechanism.Methods The clinical data of 104 gastric cancer patients admitted to the First Affiliated Hospital of Bengbu Medical College between January 2012 and August 2016 were collected.Immunohistochemical staining was employed to determine the expression levels of PPP4C and Ki-67 in the gastric cancer tissue.The gastric cancer cell lines BGC823 and HGC27 were cultured and transfected with the vector for PPP4C knockdown,the vector for PPP4C overexpression,and the lentiviral vector(control),respectively.The effects of PPP4C on the cell cycle and proliferation were analyzed and the possible regulatory mechanisms were explored.Results PPP4C was highly expressed in gastric cancer(P<0.001),and its expression promoted malignant progression of the tumor(all P<0.01).Univariate and Cox multivariate analysis clarified that high expression of PPP4C was an independent risk factor affecting the 5-year survival rate of gastric cancer patients(P=0.003).Gene ontology and Kyoto encyclopedia of genes and genomes enrichment analysis suggested that PPP4C may be involved in the cell cycle.The correlation analysis showed that the expression of PPP4C was positively correlated with that of Ki-67 in gastric cancer(P<0.001).The up-regulation of PPP4C expression increased the proportion of tumor cells in the S phase,alleviated the G2/M phase arrest,and promoted the proliferation of gastric cancer cells and the expression of cyclin D1 and cyclin-dependent kinase 6(CDK6)(all P<0.05).The down-regulation of PPP4C decreased the proportion of gastric cancer cells in the S phase,promoted G2/M phase arrest,and inhibited cell proliferation and the expression of cyclin D1,CDK6,and p53(all P<0.05).p53 inhibitors promoted the proliferation of BGC823 and HGC27 cells in the PPP4C knockdown group(P<0.001,P<0.001),while p53 activators inhibited the proliferation of BGC823 and HGC27 cells in the PPP4C overexpression group(P<0.001,P=0.002).Conclusions PPP4C is highly expressed in gastric cancer and affects the prognosis of the patients.It may increase the proportion of gastric cancer cells in the S phase and alleviate the G2/M phase arrest by inhibiting p53 signaling,thereby promoting cell proliferation.
Key words:gastric cancer;serine/threonine phosphoprotein phosphatase 4C;prognosis;cell cycle;p53
Acta Acad Med Sin,2023,45(5):721-729
2022年全球癌症报告显示,胃癌的发病率和死亡率分别位居恶性肿瘤的第3位和第5位[1],而发病机制不明是阻碍胃癌治疗和预防的根本性因素之一[1-2]。肿瘤细胞增殖失控是肿瘤恶性进展和患者预后不良的重要因素,相关机制研究有望为临床治疗提供新的分子靶标[3-4]。最新研究发现,丝氨酸/苏氨酸磷酸蛋白磷酸酶4C(serine/threonine phosphoprotein phosphatase 4C,PPP4C)在乳腺癌等多种肿瘤组织中呈高表达,通过促进细胞增殖影响肿瘤的进展和预后[5-6]。但PPP4C在胃癌组织中的表达与患者预后和肿瘤细胞恶性行为之间的关系尚不清楚。本研究纳入接受胃癌根治术治疗患者的临床数据和病理标本,分析胃癌组织中PPP4C的表达情况及其对预后的影响,并通过基因本体(gene ontology,GO)和京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)富集预测和细胞学验证分析PPP4C可能的作用途径和分子机制,以期为胃癌预后的评估提供新的参考。
资料和方法
资料来源和分组 2012年1月至2016年8月蚌埠医学院第一附属医院收治的104例胃癌患者,纳入标准:病理诊断为胃癌,且接受根治性R0切除手术。排除标准:合并其他器官的恶性肿瘤;术前接受其他抗肿瘤治疗;术后死于除胃癌外的其他原因。采用免疫组织化学(immunohistochemistry,IHC)染色技术检测胃癌组织中PPP4C的表达水平,以其相对表达量的中位数为分界值,将患者分为PPP4C高表达组(n=52)和低表达组(n=52)。
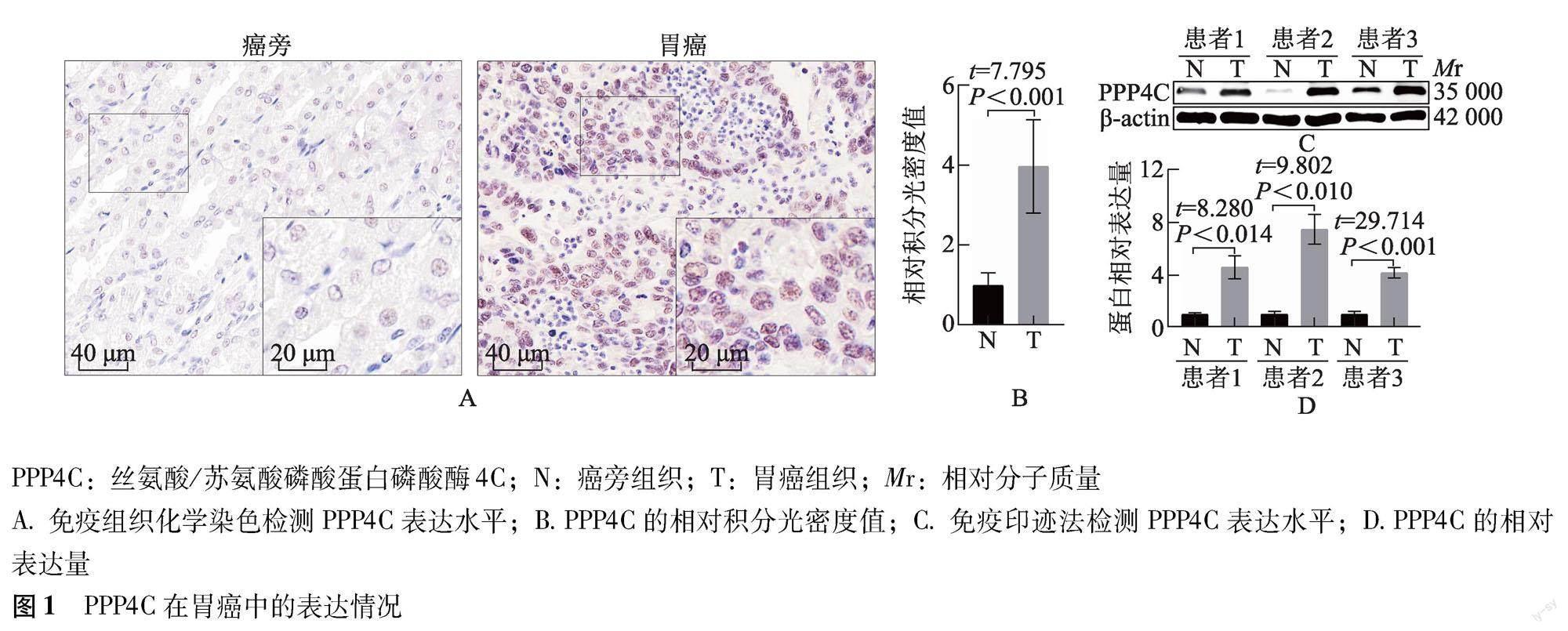
临床数据采集 一般资料:从电子病历系统中收集患者的性别、年龄、手术病理诊断、临床分级以及术前外周血癌胚抗原(carcinoembryonic antigen,CEA)和糖类抗原19-9(carbohydrate antigen 19-9,CA19-9)水平等资料。生存资料:电话随访截止日期为2021年8月,收集患者死亡原因和时间。病理资料:病理科调取104例胃癌患者的手术标本病理蜡块,采用IHC染色检测胃癌和癌旁组织中PPP4C和肿瘤增殖标志分子Ki-67的表达水平;从104例胃癌患者的冰冻组织中随机选取3例,采用免疫印迹法分析PPP4C蛋白水平。
IHC染色检测PPP4C和Ki-67的表达 将蜡块制成4 μm厚度切片,依次经烤片、常规脱蜡水化、抗原修复、H2O2处理、封闭后,分别加入一抗1∶200 PPP4C(中国武汉博士德生物工程有限公司)、1∶400 Ki-67(英国Abcam公司)4 ℃孵育过夜,PBS洗涤后加入过氧化物酶标山羊抗兔IgG室温孵育30 min,PBS洗涤,DAB显色,苏木素复染细胞核,于倒置荧光显微镜下采集图片,采用Image J软件分析PPP4C和Ki-67的相对积分光密度(integral optical density,IOD)值。阴性对照实验设置:使用抗体稀释缓冲液代替一抗进行孵育,其余操作步骤同前。
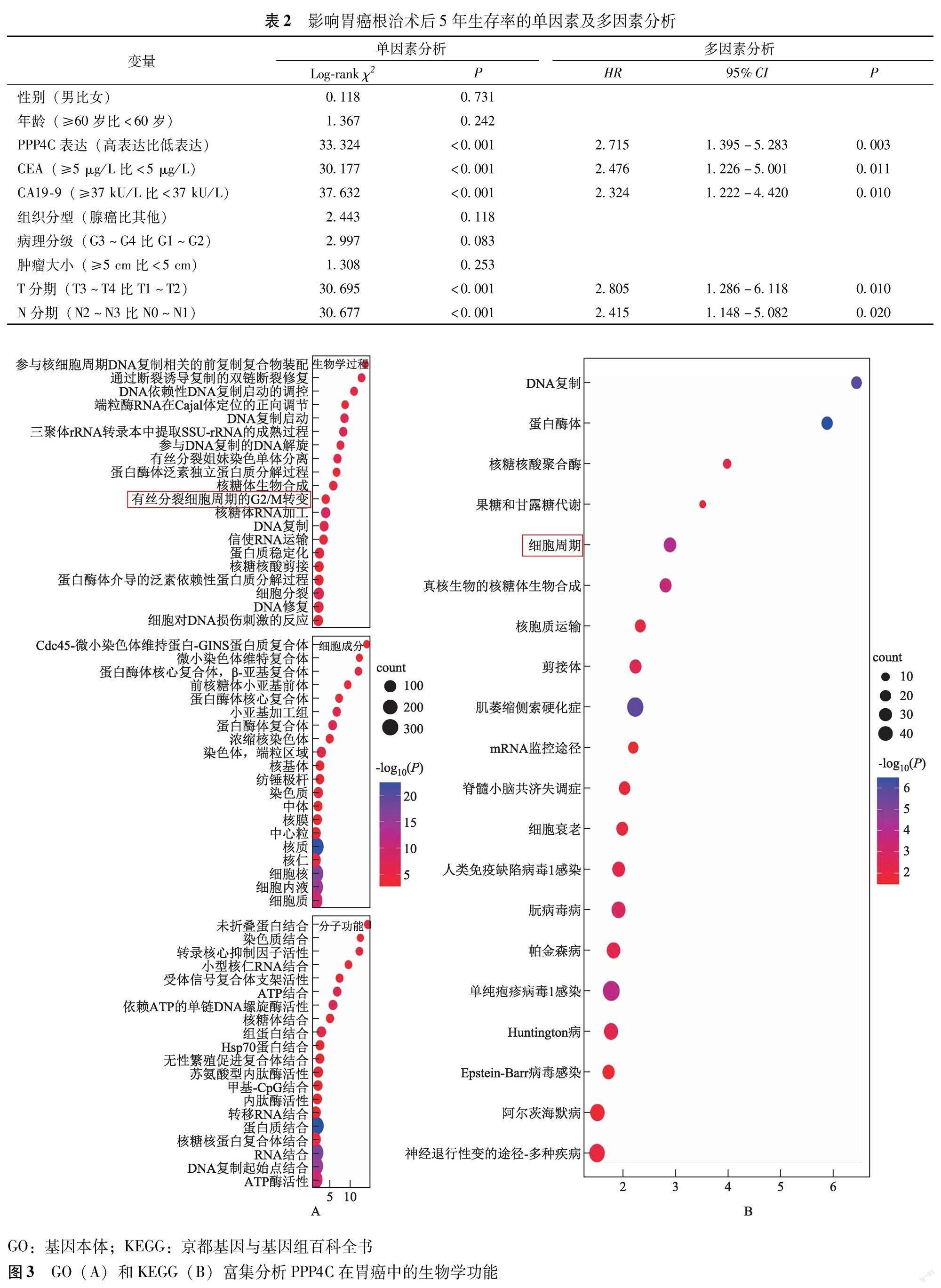
GO和KEGG富集预测分析PPP4C的生物学功能和机制 经cBioPortal数据库获得PPP4C与胃癌的相关基因,再将相关基因导入DAVID数据库进行KEGG和GO的预测富集分析。
细胞转染及处理 胃癌细胞BGC823和HGC27用含10%胎牛血清的RPMI-1640培养基培养,取对数生长期细胞以4×105个/孔的密度接种于6孔板中,待其生长至60%~70%时,更换新鲜培养基,分别转染PPP4C特异性敲减(siRNA:GGCUUCUAUAGCGUCG-AAATTUUUCGACGCUAUAGAAGCCTT)[5]、过表达和对照慢病毒载体,培养3 d后,使用含0.5 μg/ml和0.1 μg/ml嘌呤霉素的RPMI-1640培养基分别筛选转染表达稳定的BGC823和HGC27细胞株,采用免疫印迹法验证其干预效果。敲减和过表达PPP4C的BGC823和HGC27细胞使用无血清RPMI-1640培养基培养24 h,分别加入p53激活剂(20mol/L SLMP53-1)和抑制剂(10mol/L,PFT-α)培养24 h后,收集细胞用于后续实验。
CCK-8检测细胞增殖 BGC823和HGC27细胞以1×103个/孔的密度接种于96孔板中,培养24 h后,每孔加入10 μl CCK-8溶液,37 ℃孵育4 h,置于酶标仪中测定450 nm处吸光度值。
流式细胞术检测细胞周期 收集BGC823和HGC27细胞,70%乙醇固定,参照细胞周期检测试剂盒(北京索莱宝科技有限公司)说明书进行染色和上机检测,分析其细胞周期分布情况。
免疫印迹法检测蛋白表达 BGC823和HGC27细胞经RIPA裂解后提取总蛋白,BCA蛋白检测试剂盒测定蛋白浓度,吸取40g蛋白样品进行SDS-PAGE电泳,PVDF转膜,封闭后分别加入PPP4C、Cyclin D1、细胞分裂蛋白激酶6(cyclin-dependent kinase 6,CDK6)、p53和β-actin抗体(1∶1000)4 ℃孵育过夜,然后加入辣根过氧化物酶标记的山羊抗兔/小鼠IgG,TBST洗涤后,滴加ECL发光液,使用美国BioRad多功能凝胶成像系统采集图片,Image J软件量化分析。
统计学处理 采用SPSS 26.0软件,计量资料以均数±标准差表示,两组间比较采用t检验,多组间比较采用单因素方差分析和Tukey多重检验法;计数资料以构成比表示,组间比较采用χ2检验,当期望频数<5采用Fisher精确检验法。采用Spearman法计算相关系数。生存率采用Kaplan-Meier曲线进行分析,组间比较采用Log-rank χ2检验。影响胃癌患者术后生存期的危险因素采用Cox回归模型(Enter法)分析;诊断价值分析采用二分类模型受试者工作特征(receiver operating characteristic,ROC)曲线。P<0.05为差异有统计学意义。
结果
基本情况 104例胃癌患者中,男82例,女22例;<60岁43例,≥60岁61例;CEA<5 μg/L 52例,≥5 μg/L 52例;CA19-9<37 kU/L 58例,≥37 kU/L 46例;肿瘤大小<5 cm 59例,≥5 cm 45例;腺癌79例,其他类型25例;病理G1~G2级59例,G3~G4级45例,T1~T2期47例,T3~T4期57例,N0~N1期50例,N2~N3期54例。IHC染色和免疫印迹法结果显示,PPP4C在胃癌组织中呈高表达(P<0.001),且主要定位于癌细胞的细胞核中(图1)。
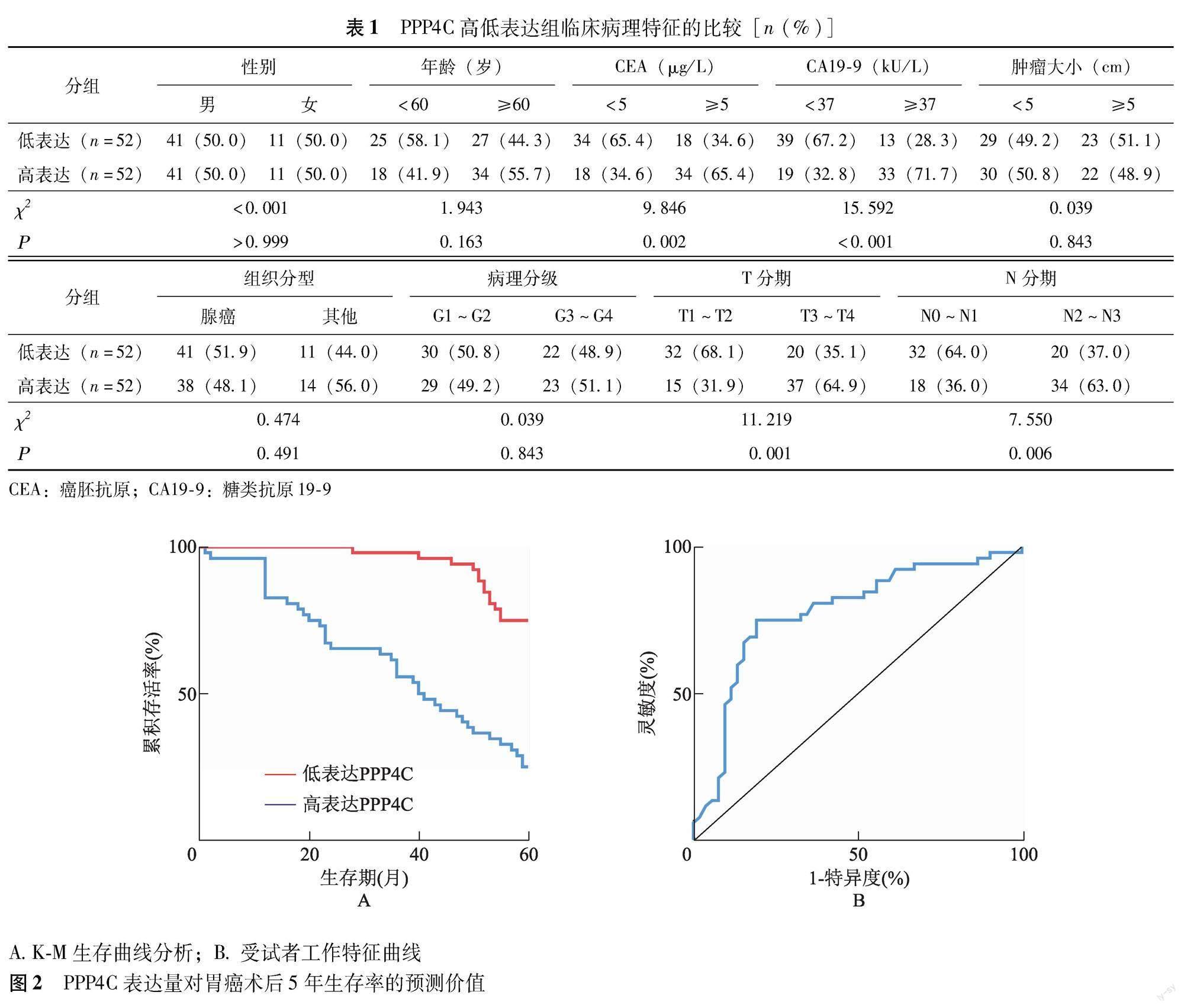
胃癌组织PPP4C表达量与预后的相关性 PPP4C高表达组(IOD值≥2.837)患者外周血CA19-9≥37 kU/L(P=0.002)、CEA≥5 μg/L(P<0.001)和病理分期N2~N3(P=0.006)、T3~T4(P=0.001)的比例显着高于低表达组(IOD值<2.837),而年龄(P>0.999)、性别(P=0.163)、肿瘤大小(P=0.843)、组织分型(P=0.491)及病理G分级(P=0.843)方面两组间差异无统计学意义(表1)。与低表达组比较,高表达组胃癌患者术后5年生存率显着降低(P<0.001)(图2A)。ROC分析结果显示,以PPP4C相对表达量2.815为截点值,PPP4C预测胃癌患者术后5年生存率的敏感度、特异度和曲线下面积分别为75.00%、80.77%和77.64%(P<0.001)(图2B)。Cox回归模型分析显示,PPP4C高表达(P=0.003)、CEA≥5 μg/L(P=0.011)、CA19-9≥37 kU/L(P=0.010)、T3~T4期(P=0.010)及N2~N3期(P=0.020)是影响胃癌患者术后5年生存率的独立危险因素(表2)。
网络信息学富集分析 GO和KEGG富集分析显示,PPP4C在胃癌中的生物学功能可能与细胞周期有关(图3)。
PPP4C表达对细胞周期的影响 免疫印迹法结果显示,与对照组比较,胃癌BGC823和HGC27细胞敲减组PPP4C表达水平降低(P=0.031,P=0.003),过表达组PPP4C表达水平显着升高(P=0.001,P=0.003)(图4A、4B)。流式细胞术结果显示,与对照组比较,胃癌BGC823和HGC27细胞PPP4C过表达组S期细胞比例增多(P=0.001,P=0.012),而G2/M期细胞比例下降(P=0.028,P=0.022);而敲减组S期细胞比例下降(P=0.017,P=0.010)而G2/M期细胞比例增多(P=0.029,P=0.001)(图4C、4D)。此外,免疫印迹结果显示,胃癌BGC823和HGC27细胞PPP4C过表达可促进Cyclin D1(P=0.002,P=0.011)和CDK6(P=0.001,P<0.001)表达,敲减则抑制Cyclin D1(P=0.008,P=0.006)和CDK6表达(P=0.002,P=0.012)(图4E、4F)。
PPP4C对胃癌细胞增殖的影响 CCK-8法检测结果显示,过表达PPP4C可促进BGC823和HGC27细胞的增殖(P<0.001,P<0.001),而敲减则抑制细胞增殖(P=0.014,P=0.010)(图5A)。Ki67在胃癌组织中呈高表达(P<0.001),且与PPP4C的表达呈正相关(r=0.672,P<0.001)(图5B~5D)。
PPP4C对p53通路的调控作用 免疫印迹法结果显示,PPP4C过表达组中p53的表达下调(P=0.019,P=0.030),而敲减组表达上调(P=0.001,P<0.001)(图6A、6B)。p53抑制剂PFT-α促进PPP4C敲减组BGC823和HGC27细胞的增殖(P<0.001,P<0.001),p53激活剂SLMP53-1抑制PPP4C过表达组BGC823和HGC27细胞的增殖(P<0.001,P=0.002)(图6C)。
讨论
胃癌患者的预后不良与肿瘤细胞恶性增殖密切相关[1]。本研究结果显示,PPP4C在胃癌组织中高表达,与胃癌恶性进展相关,并影响患者术后生存期,体外细胞研究发现其可能通过抑制p53通路增加S期胃癌细胞比例和减缓G2/M期阻滞,进而促进胃癌细胞恶性增殖。
既往研究证实,PPP4C在乳腺癌、卵巢癌等恶性肿瘤中高表达,且与癌细胞增殖等恶性行为密切相关[5-6]。为探索PPP4C在胃癌发生发展中的作用,本研究通过对胃癌患者的临床资料和病理标本分析发现,PPP4C在胃癌组织中呈高表达,且其表达水平与外周血CEA、CA19-9、T和N分期等胃癌临床进展指标呈正相关。为进一步阐明PPP4C高表达是否为影响胃癌患者术后5年生存率的独立危险因素,本研究采用单因素和多因素分析,结果显示PPP4C高表达、CEA≥5 μg/L、CA19-9≥37 kU/L、T3~T4期及N2~N3期是影响胃癌患者术后5年生存率的独立危险因素。尽管本研究结果证实了胃癌组织中PPP4C表达水平与肿瘤恶性进展和患者预后不良相关,但其作用途径和调控机制尚不清楚。
PPP4C是一种普遍存在的蛋白磷酸酶亚基,在进化过程中高度保守,但是其在恶性肿瘤中的生物学功能至今尚未完全阐明[7]。有研究表明,PPP4C可促进乳腺癌和肺癌细胞的增殖,且沉默人胚胎肾细胞中PPP4C的表达可导致M期阻滞,但关于PPP4C参与胃癌细胞增殖和细胞周期的研究报道较少[5-6,8]。本研究通过GO和KEGG富集分析发现,PPP4C的生物学功能主要与细胞周期进程和增殖的调控密切相关,包括细胞周期G2/M转变、DNA复制和修复、细胞分裂、有丝分裂姐妹染色单体分离及核糖体合成等。本研究中为了验证PPP4C是否可以调控胃癌细胞的周期变化和增殖能力,采用慢病毒干预PPP4C的表达,通过流式细胞术和免疫印迹法发现,过表达PPP4C增加S期细胞比例和细胞周期蛋白Cyclin D1和CDK6的表达,以及减缓G2/M期阻滞,而敲减PPP4C则减少S期细胞比例和增强G2/M期阻滞。此外,通过人体组织学研究发现,胃癌组织中PPP4C与肿瘤增殖标志物Ki-67的表达呈正相关,并且体外实验证实PPP4C促进胃癌细胞的增殖。本研究结果提示PPP4C具有增加S期细胞比例和减缓G2/M期阻滞,进而促进细胞增殖的作用。
既往研究显示肿瘤抑制蛋白p53作为细胞增殖和凋亡的关键调节因子,在细胞周期检查点中起到关键作用,且其可通过降低Cyclin D1的表达水平参与细胞G1/S期转变[9-12]。为探究PPP4C促进胃癌细胞增殖是否与p53信号通路有关,本研究通过体外实验发现,过表达PPP4C可抑制p53信号的激活,而p53激活剂可以减弱过表达PPP4C对胃癌细胞增殖的促进作用;敲减PPP4C可促进p53信号的活化,而p53抑制剂可以减弱敲减PPP4C对胃癌细胞增殖的抑制作用。提示PPP4C促进胃癌细胞增殖和S期细胞比例增多以及减缓G2/M期阻滞可能与抑制p53信号有关。
本研究存在以下不足:(1)本研究为回顾性研究,由于样本量有限,关于PPP4C表达与肿瘤恶性进展和预后相关的结论仍需要前瞻性研究加以验证。(2)尽管本研究通过细胞学实验证实PPP4C促进胃癌细胞的增殖与负向调控p53有关,但是由于PPP4C生物学功能的多样性和分子调控机制的复杂性,不能排除其通过其他生物学途径或分子机制影响胃癌细胞恶性增殖的可能。
综上,本研究结果表明,PPP4C在胃癌组织中呈高表达,并影响疾病恶性进展和患者预后,其可能通过抑制p53信号通路促进胃癌细胞的S期细胞比例增多和减缓G2/M期阻滞,进而促进胃癌细胞的增殖。
参考文献
[1]Smyth EC,Nilsson M,Grabsch HI,et al.Gastric cancer[J].Lancet,2020,396(10251):635-648.DOI:10.1016/S0140-6736(20)31288-5.
[2]Ford AC,Yuan Y,Moayyedi P.Helicobacter pylori eradication therapy to prevent gastric cancer:systematic review and meta-analysis[J].Gut,2020,69(12):2113-2121.DOI:10.1136/gutjnl-2020-320839.
[3]Thrift AP,El-Serag HB.Burden of gastric cancer[J].Clin Gastroenterol Hepatol,2020,18(3):534-542.DOI:10.1016/j.cgh.2019.07.045.
[4]Li GZ,Doherty GM,Wang J.Surgical management of gastric cancer:a review[J].JAMA Surg,2022,157(5):446-454.DOI:10.1001/jamasurg.2022.0182.
[5]Xie W,Sun Y,Zeng Y,et al.Comprehensive analysis of PPPCs family reveals the clinical significance of PPP1CA and PPP4C in breast cancer[J].Bioengineered,2022,13(1):190-205.DOI:10.1080/21655979.2021.2012316.
[6]Raja R,Wu C,Bassoy EY,et al.PP4 inhibition sensitizes ovarian cancer to NK cell-mediated cytotoxicity via STAT1 activation and inflammatory signaling[J].J Immunother Cancer,2022,10(12):e005026.DOI:10.1136/jitc-2022-005026.
[7]Dong MZ,Ouyang YC,Gao SC,et al.PPP4C facilitates homologous recombination DNA repair by dephosphorylating PLK1 during early embryo development[J].Development,2022,149(10):dev200351.DOI:10.1242/dev.200351.
[8]Gao G,Zhang L,Villarreal OD,et al.PRMT1 loss sensitizes cells to PRMT5 inhibition[J].Nucleic Acids Res,2019,47(10):5038-5048.DOI:10.1093/nar/gkz200.
[9]Taylor WR,Stark GR.Regulation of the G2/M transition by p53[J].Oncogene,2001,20(15):1803-1815.DOI:10.1038/sj.onc.1204252.
[10]OConnor MJ,Thakar T,Nicolae CM,et al.PARP14 regulates cyclin D1 expression to promote cell-cycle progression[J].Oncogene,2021,40(30):4872-4883.DOI:10.1038/s41388-021-01881-8.
[11]Yockteng-Melgar J,Shire K,Cheng AZ,et al.G(1)/S cell cycle induction by epstein-barr virus BORF2 is mediated by P53 and APOBEC3B[J].J Virol,2022,96(18):e0066022.DOI:10.1128/jvi.00660-22.
[12]La T,Chen S,Zhao XH,et al.LncRNA LIMp27 regulates the DNA damage response through p27 in p53-defective cancer cells[J].Adv Sci (Weinh),2023,10(7):e2204599.DOI:10.1002/advs.202204599.
(收稿日期:2023-03-08)



