李伊铭 阎琳 肖静 张明博 罗渝昆
摘要:目的 探讨钙化对甲状腺乳头状癌(PTC)超声引导射频消融疗效的影响。方法 回顾性分析2018年1月1日至2021年12月31日在中国人民解放军总医院第一医学中心超声诊断科首次行射频消融(RFA)治疗的164例PTC患者(182个结节)的术前及随访资料,以RFA术后12个月消融灶未完全消失为终点事件,采用单因素Logistic回归筛选消融灶未完全消失的影响因素,并纳入多因素Logistic回归,分析消融灶未完全消失的独立危险因素。结果 PTC结节最大径(OR=1.16,95%CI=1.04~1.29,P=0.009)、钙化占比>2/3(OR=19.27,95%CI=4.02~92.28,P<0.001)是RFA术后12个月消融灶是否消失的影响因素。结论 伴有钙化的PTC可行超声引导下RFA治疗,当钙化占比≤2/3时与无钙化结节消融疗效相当。
关键词:甲状腺乳头状癌;超声;射频消融;钙化
中图分类号: R445.1;R736.1 文献标志码: A 文章编号:1000-503X(2023)05-0803-06
DOI:10.3881/j.issn.1000-503X.15504
Effect of Calcification on the Ultrasound-Guided Radiofrequency Ablation of Papillary Thyroid Carcinoma
LI Yiming,YAN Lin,XIAO Jing,ZHANG Mingbo,LUO Yukun
Department of Ultrasound,The First Medical Center of Chinese PLA General Hospital,Beijing 100853,China
Corresponding author:LUO Yukun Tel:010-66939533,E-mail:lyk301@163.com
ABSTRACT:Objective To investigate the effect of calcification on the ultrasound-guided radiofrequency ablation(RFA)of papillary thyroid carcinoma(PTC).Methods We retrospectively analyzed the preoperative and follow-up data of 164 patients(182 nodules)with PTC treated by percutaneous ultrasound-guided RFA in the First Medical Center of Chinese PLA General Hospital from January 1,2018 to December 31,2021.The tumor status 12 months after RFA was taken as the endpoint event.The univariate Logistic regression analysis was employed to predict the influencing factors of incomplete ablation.The factors were then included in the multivariate Logistic regression analysis for prediction of the independent risk factors of incomplete ablation.Results The maximum nodule diameter(OR=1.16,95%CI=1.04-1.29,P=0.009)and calcification ratio >2/3(OR=19.27,95%CI=4.02-92.28,P<0.001)were the factors influencing the disappearance of lesion 12 months after RFA.Conclusions PTC with calcification can be treated with ultrasound-guided RFA.In the case of calcification ratio ≤ 2/3,this therapy demonstrates the effect equivalent to that of no calcification.
Key words:papillary thyroid carcinoma;ultrasound;radiofrequency ablation;calcification
Acta Acad Med Sin,2023,45(5):803-808
甲状腺癌是一种常见的内分泌肿瘤[1],在过去几十年中,其发病率呈现快速上升趋势,已位居全球恶性肿瘤发病率的第9位[2-4]。研究显示约80%的甲状腺癌为甲状腺乳头状癌(papillary thyroid carcinoma,PTC)[1],其传统治疗方式为手术治疗[5]。近年来,射频消融(radiofrequency ablation,RFA)等热消融疗法开始逐渐应用到PTC的治疗中[6-9],并取得了较好的疗效,但对于伴有钙化的PTC的疗效仍存在一定的争议。有学者认为钙化是RFA治疗PTC的禁忌证[10],可能会存在不完全消融的风险;然而,也有指南并未将伴有钙化的PTC排除在RFA的适应证之外。目前尚缺乏足够的临床研究来证实RFA治疗伴有钙化的PTC的可行性[11-12]。因此,本研究旨在探讨钙化对PTC超声引导RFA疗效的影响,为进一步明确伴有钙化的PTC是否可行RFA及其临床疗效提供依据。
资料和方法
资料来源 回顾性分析2018年1月1日至2021年12月31日在中国人民解放军总医院第一医学中心超声诊断科行RFA治疗的PTC患者的临床资料。纳入标准:(1)超声引导下细针穿刺细胞学病理结果为经典型PTC;(2)年龄>18岁。排除标准:(1)有严重心肺疾病、凝血功能障碍及严重多器官功能衰竭;(2)治疗依从性差,预计不能长期配合随访;(3)影像学显示甲状腺被膜侵犯、存在淋巴结及远处转移;(4)术前接受过其他治疗。最终纳入164例患者,共182个结节,其中,男39例,女125例,年龄22~54岁,平均(43.4±9.5)岁。本研究经中国人民解放军总医院医学伦理委员会批准(伦理审批编号:S-2019-211-01),所有患者均签署知情同意书。
超声检查 采用西门子Sequoia 512超声诊断仪,线阵探头L8~15,中心频率为7 MHz(7.5~10.0 MHz);西门子S2000超声诊断仪,线阵探头9L4,中心频率为8 MHz(5.0~14.0 MHz);迈瑞Resona 7超声诊断仪,线阵探头L11~3U,中心频率为7.5 MHz(5.6~10.0 MHz)。将超声造影剂SonoVue(Bracco公司,意大利)冻干粉剂与生理盐水5 ml溶液配置成微泡混悬液。钙化占比定义:根据美国放射学会指南,将钙化分为粗大钙化、边缘钙化及点状钙化。对所有类型的钙化采用保加利亚MicroDicom DICOM Viewer软件对钙化面积进行勾画,并计算钙化占结节面积的比例,其中粗大钙化后方的声影也勾画在钙化范围之内。
RFA治疗过程 采用德国Olympus公司生产的Celon AG型RFA系统,双极射频针100~T15,电极裸区长度为15 mm。消融过程采用西门子Sequoia 512超声诊断仪,患者取仰卧位,颈部后伸,常规消毒铺巾,1%盐酸利多卡因局部麻醉。当肿瘤与气管、食管、喉返神经等重要结构之间的距离<5 mm时,将生理盐水和1%盐酸利多卡因的混合液注入甲状腺被膜周围以形成至少1 cm的隔离带,从而防止邻近重要结构受到热损伤。RFA经甲状腺峡部入路,在超声引导下将18G射频针置入结节深部,采用多点逐步消融,直至累积整个病灶,设定每点输出功率为3 W,如果5~10 s内射频针尖端未瞬间产生气化,则提高输出功率为5 W。对于无钙化结节,将病灶分为数个小消融单元,通过移动热源对各个单元逐一进行热消融处理[12]。对于钙化结节,根据钙化质地采用不同的消融方式,如钙化质地较疏松,则先穿透钙化,在深方进行消融,逐步向结节浅层进行移动消融;如钙化质地较硬,无法穿透钙化,则调整针道对钙化周边及其他结节组织进行完全消融。为防止肿瘤的残留或复发,采用扩大消融法,即气化强回声的覆盖范围超过肿瘤边界至少3 mm。所有患者消融后即刻行超声造影检查,如消融区出现强化需及时补充RFA,如消融区无增强且超过病灶范围则终止消融。密切观察1~2 h,未出现声音嘶哑、局部出血等并发症时允许患者离开。
随访 术后1、3、6、12个月行超声复查,评估消融灶的吸收情况。术后1年行超声引导下细针穿刺细胞学活检,评估消融灶的灭活情况。
统计学处理 采用SPSS 26.0统计软件,连续变量采用Kolmogorov-Smirnov检验进行正态性检验,符合正态分布的计量资料以均数±标准差表示,组间比较采用t检验;不符合正态分布的计量资料以M(Q1,Q3)表示,组间比较采用Mann-Whitney检验。计数资料以频数和百分数表示,组间比较采用卡方检验或Fisher精确概率法。将单因素检验中P<0.05的变量纳入多因素Logistic回归进行分析。P<0.05为差异有统计学意义。
结果
一般情况 182个结节中,钙化组75个(41.2%),非钙化组107个(58.8%),两组患者在年龄(P=0.853)、性别(P=0.551)、最大径(P=0.334)、体积(P=0.562)、低回声(P=0.488)、纵横比<1(P=0.948)、消融功率(P=0.887)、消融时间(P=0.372)和消融能量(P=0.104)方面差异均无统计学意义。
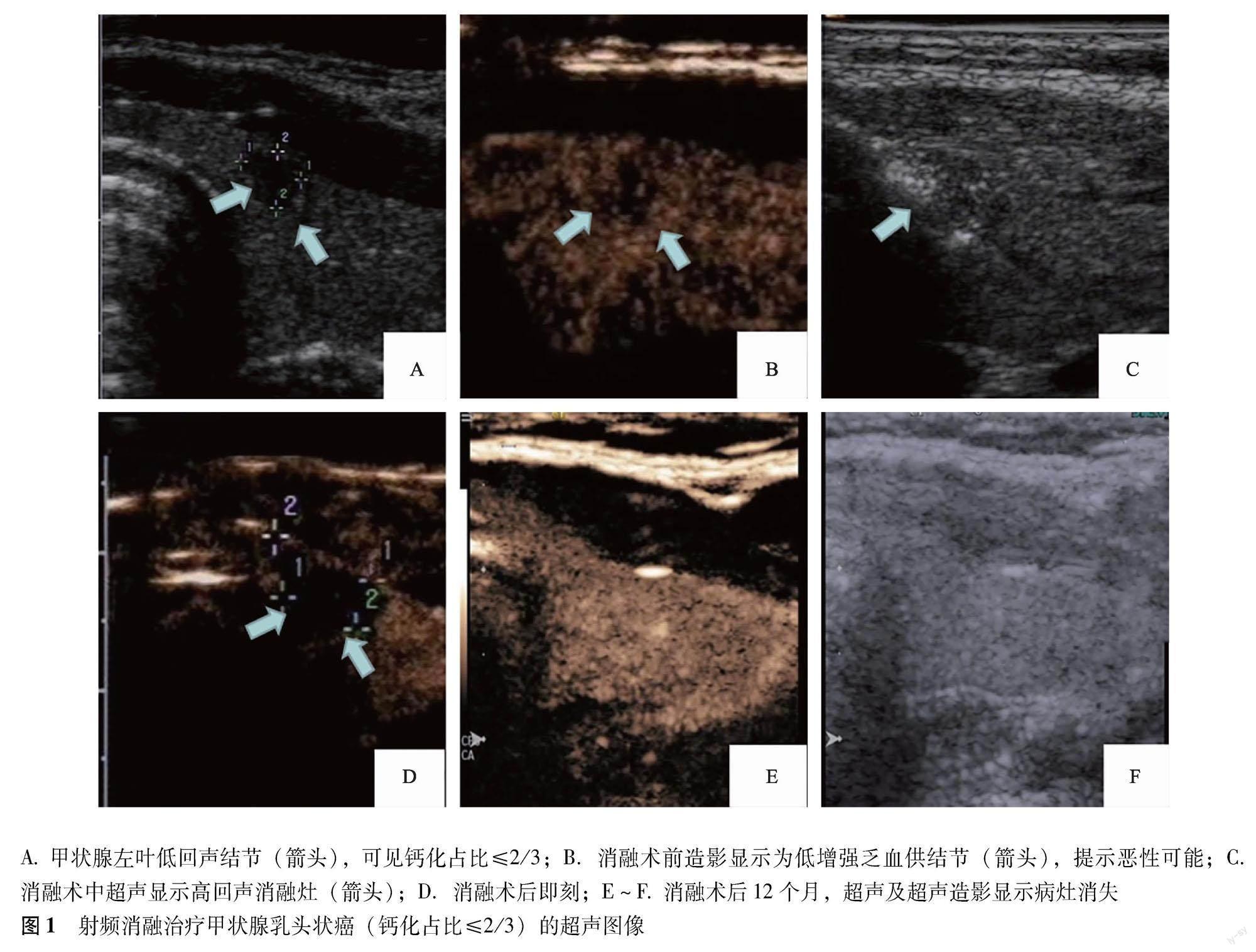
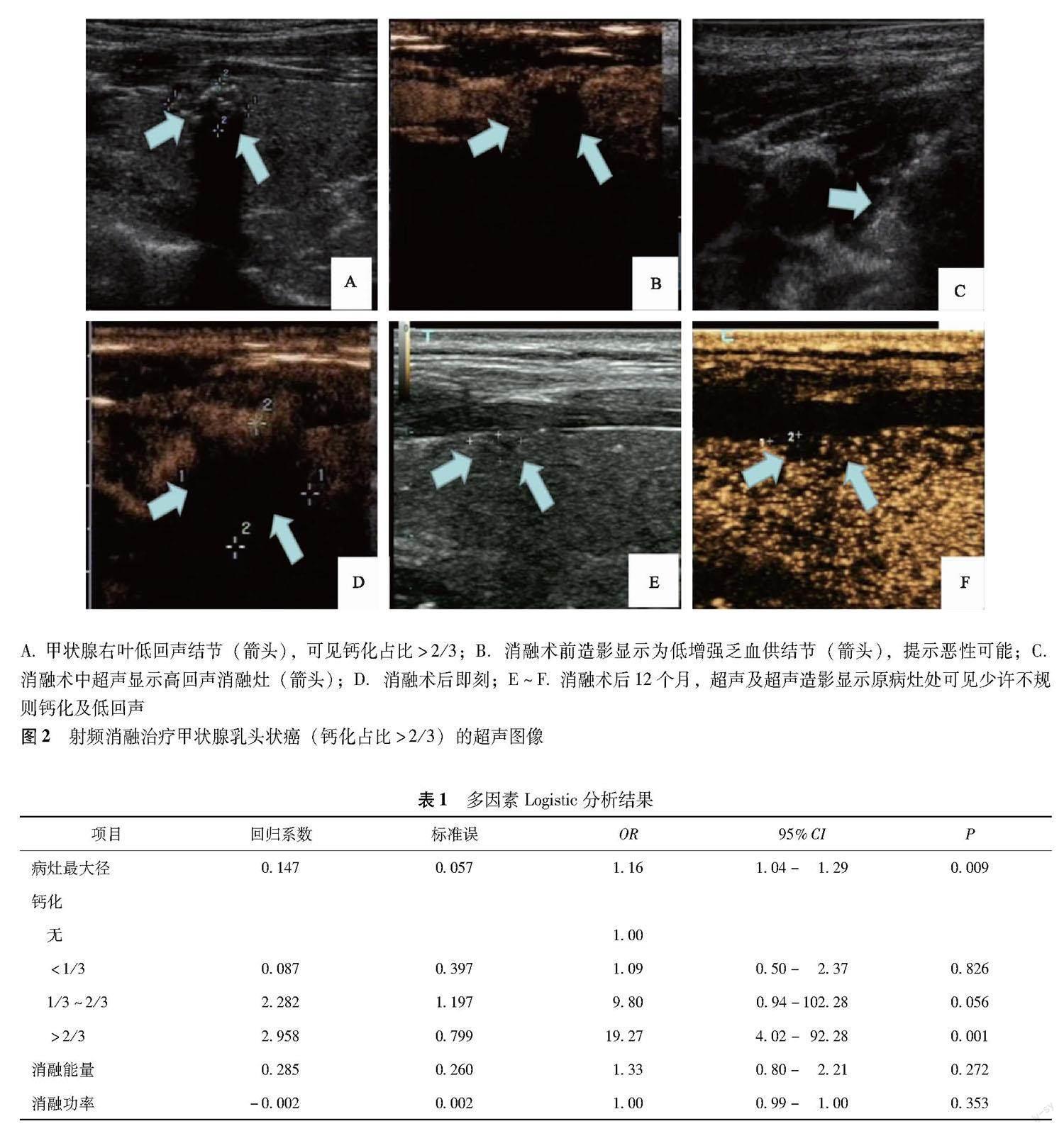
单因素分析结果 182个结节中,112个(61.5%)结节在RFA术后12个月内肿瘤完全消失(图1),70个(38.5%)结节未完全消失(图2),穿刺病理结果显示为纤维组织增生伴玻璃样变性、扩张小血管或炎性细胞。RFA术后12个月肿瘤完全消失组和未完全消失组在最大径(OR=1.17,95%CI=1.07~1.28,P=0.001)、消融前体积(OR=1.00,95%CI=1.00~1.00,P=0.037)和钙化占比>2/3(OR=20.18,95%CI=4.43~92.04,P<0.001)、消融功率(OR=1.37,95%CI=1.11~1.68,P=0.003)、消融能量(OR=2.13,95%CI=1.40~3.24,P<0.001)方面差异有统计学意义;而在年龄(OR=1.00,95%CI=0.97~1.04,P=0.830)、性别(OR=1.14,95%CI=0.57~2.29,P=0.702)、回声(OR=0.45,95%CI=0.10~2.09,P=0.311)、形态(OR=0.55,95%CI=0.27~1.12,P=0.098)和消融时间(OR=1.00,95%CI=1.00~1.00,P=0.205)方面差异无统计学意义。
多因素分析结果 RFA术后12个月肿瘤完全消失组和未完全消失组在病灶最大径(OR=1.16,95%CI=1.04~1.29,P=0.009)、钙化占比>2/3结节(OR=19.27,95%CI=4.02~92.28,P=0.001)方面差异有统计学意义,在消融功率(OR=1.00,95%CI=0.99~1.00,P=0.353)和消融能量(OR=1.33,95%CI=0.80~2.21,P=0.272)方面差异无统计学意义。
无钙化结节107个,RFA术后12个月完全消失的结节有74个,消失率为69.2%;钙化占比≤2/3的结节55个,RFA术后12个月完全消失的结节有36个,消失率为65.5%;钙化占比>2/3的结节20个,RFA术后12个月完全消失的结节有2个,消失率为10%。钙化占比<1/3和1/3<钙化占比≤2/3的甲状腺结节消融术后消失率与无钙化结节比较差异均无统计学意义(P=0.826,P=0.056)(表1)。
讨论
近年来,随着PTC患病率和检出率的提高,其治疗也倍受关注。目前,外科手术切除是PTC患者的传统治疗方法[5],但随着热消融技术的兴起,RFA作为一种替代治疗方法[6-9],由于其并发症少、创伤小、可重复性强等优点已应用于不耐受手术或拒绝手术的患者中[10-12]。然而,对于RFA治疗伴有钙化的PTC仍存在一些争议,有些学者认为,钙化是RFA治疗PTC的禁忌证[13],主要原因可能包括:首先,对于伴有粗大及密集钙化的结节,钙化后方受到钙化遮挡的实性部分,可能出现因热能传递障碍导致消融不完全的情况,易造成术后残留及短期内复发;其次,若钙化质地过硬,穿刺针不易穿透钙化到达钙化后方残余结节,不能进行全结节的充分消融;最后,钙化结节相对于无钙化结节消融需消耗更多能量,过高的能量易损害周围其他组织,造成周围组织黏连或重要脏器大血管损伤等并发症。但是,由于大部分甲状腺肿瘤中都伴有钙化[14-15],如果直接进行外科手术切除,则终身需要服用优甲乐等补充甲状腺激素类药物,丧失了保留甲状腺及二次手术的机会。通过技术改善,采用多角度多切面的移动消融方法,可避免消融不完全等情况,最终可达到充分消融[16-17]。本研究结果显示,伴有钙化的PTC可进行超声引导下REA,这为甲状腺RFA提供了可靠的支持,同时拓宽了该治疗方法的适应证范围。
本研究根据RFA术后12个月病灶消融情况分为完全消失组和未完全消失组,结果发现病灶最大径和钙化占比是影响术后12个月内肿瘤消失与否的重要因素。当钙化占比≤2/3时,与无钙化结节消融疗效相当,远期随访(术后12个月)可达到完全消融,治疗效果良好。分析其原因可能为钙化占比较少,能量未受到钙化遮挡,在RFA作用下,局部组织温度升高,肿瘤组织发生凝固性坏死,被巨噬细胞吞噬直至消失[18]。术后1年,消融灶超声表现为钙化+少许实性成分、纯钙化,穿刺活检病理结果显示纤维组织增生伴玻璃样变性、扩张小血管或炎性细胞,病灶在组织学意义上均完全灭活。分析其机制可能为RFA产生的能量不仅对钙化周边实性成分起到热消融作用,同时也可将热能传递至钙化内部,使钙化自身吸收热能,失去活性,达到灭活效果。
为彻底消融钙化结节,需采用相应的技术方案。本研究术前对病灶行多角度、多切面超声检查,明确病灶的位置及与周围组织的解剖关系,根据病灶大小、位置更好地制订治疗方案和热消融模式[12]。术中使用移动消融技术:(1)对于无钙化或钙化质地较为疏松的结节,先行穿透钙化,由深至浅逐层进行移动消融。此穿透钙化的操作手法,不仅避免了稀疏钙化遮挡热量传递,同时降低短时间内大范围消融可能对周围组织及重要脏器造成损伤等风险,体现了RFA的安全性及有效性[19-21]。(2)若钙化质地较硬,无法穿透钙化则侧移穿刺针,在整体结节周边以3 mm边界为半径扩大消融[22],使热量包裹整个瘤体,以阻断结节内血供,即使有因钙化遮挡所致的残余病灶,也可因无营养供给自然凋亡,进而解决钙化周围消融灶残留的问题。术后再次行超声造影检查评估热消融情况,确保钙化结节的完全消融。
本研究存在以下不足:(1)仅分析RFA术后的PTC患者短期肿瘤状态的影响因素;(2)纳入病例数偏少,需要进一步扩大样本量,研究钙化对PTC超声引导RFA疗效的影响;(3)少部分术后未完全消失病灶需进一步通过穿刺病理明确性质。
综上,本研究结果表明,伴有钙化的PTC可行超声引导下RFA治疗,钙化占比≤2/3的结节可达到完全吸收,治疗效果良好。
参考文献
[1]Lopes NMD,Lens HHM,da Silva Brito WA,et al.Role of papillary thyroid carcinoma patients with Hashimoto thyroiditis:evaluation of oxidative stress and inflammatory markers[J].Clin Transl Oncol,2022,24(12):2366-2378.DOI:10.1007/s12094-022-02891-y.
[2]阎琳,宋青,肖静,等.粗针穿刺活检在射频消融治疗甲状腺微小乳头状癌中的临床应用[J].,2021,43(4):584-589.DOI:10.3881/j.issn.1000-503X.13277.
[3]Chmielik E,Rusinek D,Oczko-Wojciechowska M,et al.Heterogeneity of thyroid cancer[J].Pathobiology,2018,85(1-2):117-129.DOI:10.1159/000486422.
[4]Bray F,Ferlay J,Soerjomataram I,et al.Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J].CA Cancer J Clin,2018,68(6):394-424.DOI:10.3322/caac.21492.
[5]邝焕杰,董刚.超声引导下射频消融对甲状腺微小乳头状癌结节体积的影响[J].河南医学研究,2022,31(3):440-443.DOI:10.3969/j.issn.1004-437X.2022.03.014.
[6]肖静,兰雨,阎琳,等.超声引导下射频消融治疗T1bN0M0期甲状腺乳头状癌的短期疗效分析[J].,2020,42(6):771-775.DOI:10.3881/j.issn.1000-503X.12731.
[7]Zhang M,Luo Y,Zhang Y,et al.Efficacy and safety of ultrasound-guided radiofrequency ablation for treating low-risk papillary thyroid microcarcinoma:a prospective study[J].Thyroid,2016,26(11):1581-1587.DOI:10.1089/thy.2015.0471.
[8]Yue W,Wang S,Yu S,et al.Ultrasound-guided percutaneous microwave ablation of solitary T1N0M0 papillary thyroid microcarcinoma:initial experience[J].Int J Hyperthermia,2014,30(2):150-157.DOI:10.1016/j.ejrad.2012.07.020.
[9]Teng D,Li H,Sui G,et al.Preliminary report of microwave ablation for the primary papillary thyroid microcarcinoma:a large-cohort of 185 patients feasibility study[J].Endocrine,2019,64(1):109-117.DOI:10.1007/s12020-019-01868-2.
[10]Xiao J,Zhang M,Zhang Y,et al.Efficacy and safety of ultrasonography-guided radiofrequency ablation for the treatment of T1bN0M0 papillary thyroid carcinoma:a retrospective study[J].Int J Hyperthermia,2020,37(1):392-398.DOI:10.1080/02656736.2020.1752945.
[11]Cao XJ,Liu J,Zhu YL,et al.Efficacy and safety of thermal ablation for solitary T1bN0M0 papillary thyroid carcinoma:a multicenter study[J].J Clin Endocrinol Metab,2021,106(2):e573-e581.DOI:10.1210/clinem/dgab143.
[12]Chen J,Cao J,Qiu F,et al.The efficacy and the safety of ultrasound-guided ablation therapy for treating papillary thyroid microcarcinoma[J].J Cancer,2019,10(21):5272-5282.DOI:10.7150/jca.36289.
[13]葛明华,徐栋.甲状腺良性结节、微小癌及颈部转移性淋巴结热消融治疗浙江省专家共识(2015版)[J].中国普通外科杂志,2016,25(7):944-946.DOI:10.3978/j.issn.1005-6947.2016.07.002.
[14]毕腾云,白文坤,胡兵.甲状腺超声钙化形态与甲状腺癌的关系[J].中国超声医学杂志,2016,32(6):481-483.DOI:10.3969/j.issn.1002-0101.2016.06.001.
[15]Tessler FN,Middleton WD,Grant EG,et al.ACR thyroid imaging,reporting and data system(TI-RADS):White Paper of the ACR TI-RADS Committee[J].J Am Coll Radiol,2017,14(5):587-595.DOI:10.1016/j.jacr.2017.01.046.
[16]葛明华,徐栋,杨安奎,等.甲状腺良性结节、微小癌及颈部转移性淋巴结热消融治疗专家共识(2018版)[J].中国肿瘤,2018,27(10):768-773.DOI:10.11735/j.issn.1004-0242.2018.10.A006.
[17]朱乔丹,王立平,徐栋.对《甲状腺良性结节、微小癌及颈部转移性淋巴结热消融治疗专家共识(2018版)》的解读[J].中华医学超声杂志(电子版),2020,17(3):251-254.DOI:10.3877/cma.j.issn.1672-6448.2020.03.008.
[18]Chu KF,Dupuy DE.Thermal ablation of tumours:biological mechanisms and advances in therapy[J].Nat Rev Cancer,2014,14(3):199-208.DOI:10.1038/nrc3672.
[19]Jeon YW,Gwak HG,Lim ST,et al.Long-term prognosis of unilateral and multifocal papillary thyroid microcarcinoma after unilateral lobectomy versus total thyroidectomy[J].Ann Surg Oncol,2019,26(9):2952-2958.DOI:10.1245/s10434-019-07482-w.
[20]张明博,阎琳,李盈盈,等.甲状腺微小乳头状癌射频消融治疗的临床价值与展望[J].中华医学超声杂志(电子版),2022,19(1):78-81.DOI:10.3877/cma.j.issn.1672-6448.2022.01.015.
[21]Suh CH,Baek JH,Choi YJ,et al.Efficacy and safety of radiofrequency and ethanol ablation for treating locally recurrent thyroid cancer:a systematic review and meta-analysis[J].Thyroid,2016,26(3):420-428.DOI:10.1089/thy.2015.0545.
[22]Zhang M,Tufano RP,Russell JO,et al.Ultrasound-guided radiofrequency ablation versus surgery for low-risk papillary thyroid microcarcinoma:results of over 5 Years follow-up[J].Thyroid,2020,30(3):408-417.DOI:10.1089/thy.2019.0147.
(收稿日期:2023-01-20)



