(青岛大学国家生理学重点(培育)学科,山东 青岛 266071)
帕金森病(PD)是一种发病率仅次于阿尔茨海默病(AD)的第2大神经系统退行性疾病。许多研究表明,遗传、环境、老龄化和氧化应激等因素均参与了PD的发病的过程[1-2]。目前,临床上用于治疗PD的药物只能在一定程度上改善疾病的相关症状,而不能阻止PD病情的发展[3-5]。因此,阐明PD的发病原因及可能机制成为现代医学研究亟需解决的难题。
FAM3基因家族(FAM3)是2002年新发现的一个细胞因子样基因家族,目前已知包括FAM3A、FAM3B、FAM3C和FAM3D 4个成员[5]。FAM3基因家族成员的蛋白序列由224~235个氨基酸残基组成,具有高度的同源性,而与其他已知的蛋白均没有发现同源性[6-7]。目前的研究已初步揭示FAM3基因家族成员有可能在包括糖尿病、肿瘤及神经退行性疾病等在内的多种重大疾病的发生、发展过程中发挥重要作用[8-10]。FAM3C是FAM3基因家族的第3个成员,研究发现FAM3C在人与小鼠的全身组织中均有表达[11]。目前越来越多的研究表明,FAM3C是葡萄糖和脂质代谢的重要调节剂[12],而且FAM3C的异常表达参与了多种肿瘤的形成及转移过程[13-14]。HASEGAWA等[15]研究显示,AD的发生和大脑中淀粉样斑块的形成密切相关,FAM3C通过破坏淀粉样β前体的稳定来改善阿尔茨海默病。然而,FAM3C在PD发病中的作用尚不明确。本研究选用携带人突变型α-突触核蛋白A53T纯合子(α-SynA53T+/+)小鼠,通过检测不同月龄的α-SynA53T+/+小鼠黑质(SN)区FAM3C蛋白的表达水平,探究FAM3C在PD发生、发展中的作用,为阐明PD发生和发展的分子机制提供实验基础。现将结果报告如下。
1 材料和方法
1.1 实验动物
健康α-SynA53T+/+小鼠购于南京大学模式动物研究所,按SPF级别饲养,置于室温(22±2)℃下,12-12 h昼夜循环光照下生活,自由饮水取食。鉴定基因型后,选取3、6月龄雄性α-SynA53T+/+小鼠和同窝野生型(WT)小鼠各4只。所有关于实验动物的操作均符合青岛大学实验动物操作规则中的要求。
1.2 仪器与试剂
大鼠源FAM3C抗体购买于美国R&D SYSTEMS公司,小鼠源Alpha-Synuclein抗体购买于英国Abcam公司,HRP标记山羊抗大鼠IgG购买于MDBio.Inc公司,HRP标记山羊抗小鼠IgG购买于Absin公司,RIPA裂解液、分离胶缓冲液和浓缩胶缓冲液购于康为公司,ECL发光试剂盒购买于美国Millipore公司。
1.3 实验仪器
电泳槽Mini-VE、电转仪(湿转)Trans-Blot和电泳仪Power-Pac200购买于美国BIO-RAD公司。
1.4 Western Blot方法鉴定小鼠基因型及检测小鼠SN区FAM3C蛋白表达水平
以水合氯醛深度麻醉小鼠,迅速断头,完整取出包括中脑SN区的脑组织,置于冰盒内,迅速准确取出SN部分,放入预冷的EP管中,准确称质量后,在冰上用加入蛋白酶抑制剂和磷酸酶抑制剂的RIPA蛋白裂解液充分研磨、裂解30 min以后,4 ℃下以12 000 r/min离心20 min,取上清液于新的EP管中,应用酶标仪以BCA法测定波长562 nm处的吸光度值,进行蛋白浓度测定。按每孔25 μg蛋白上样,通过SDS-聚丙烯酰胺凝胶电泳将不同分子质量的蛋白分开,然后电转移到PVDF膜上,于室温下以100 g/L的脱脂奶粉封闭2 h;分别加入大鼠源FAM3C一抗(1∶300)和小鼠源Alpha-Synuclein 一抗(1∶1 000),4 ℃孵育过夜,在PBST中洗3次后,分别与辣根过氧化物酶标记的山羊抗大鼠IgG(1∶5 000)和山羊抗小鼠IgG(1∶10 000)在室温下孵育1 h,在PBST中洗涤3次,ECL发光液显影,UVP凝胶成像系统成像后用Image J软件对蛋白条带进行半定量分析。
1.5 统计学方法
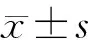
2 结 果
2.1 α-SynA53T+/+小鼠的鉴定
Western Blot方法检测结果显示,3月龄α-SynA53T+/+小鼠SN区Human-α-Syn蛋白表达水平显着升高,差异有统计学意义(t=9.884,P<0.05)。6月龄α-SynA53T+/+小鼠SN区Human-α-Syn蛋白的表达水平显着升高,差异具有统计学意义(t=3.779,P<0.05)。见图1。
2.2 不同月龄α-SynA53T+/+小鼠SN区FAM3C蛋白表达变化
Western Blot方法检测结果显示,3月龄α-SynA53T+/+小鼠SN区FAM3C蛋白水平与WT小鼠相比,差异无统计学意义(t=1.245,P>0.05);而6月龄α-SynA53T+/+小鼠SN区FAM3C蛋白表达水平与WT小鼠相比明显升高,差异有统计学意义(t=8.865,P<0.05)。见图2。
3 讨 论
PD的主要病理特征是中脑黑质多巴胺能神经元的退行性变性死亡,黑质多巴胺能神经元渐进性死亡与氧化应激和炎症反应有关。前期研究发现,多种细胞因子参与了PD的发生及发展过程,PD病人脑脊液中的肿瘤坏死因子-α、白细胞介素1β和白细胞介素6的含量出现了上升[16-18]。自FAM3家族被发现以来,国内外研究者对FAM3基因家族成员的生物学功能展开了深入的研究,目前的研究已经初步揭示FAM 3基因家族在代谢、肿瘤以及蛋白质相互作用等方面具有重要的生理作用[6,7,10,19]。FAM3A是FAM3细胞因子样基因家族的第1个成员,体外研究表明,FAM3A主要定位在培养肝细胞的线粒体之中,具有促进ATP生成以及分泌的作用[20-21]。FAM3B是FAM3基因家族的第2个成员,主要表达于胰腺,具有与炎症因子白细胞介素6相似的致细胞凋亡的作用[22-23],在胰岛素抵抗和2型糖尿病发展过程中起重要作用,其可能成为2型糖尿病的新干预靶点[24-25]。FAM3D被发现可能介入了机体能量代谢异常、结肠癌及嗜睡等的发生发展过程[18,24,26-27]。FAM3C是FAM3基因家族的第3个成员,已被发现在胚胎发育和视网膜功能调控、上皮细胞间质转化以及胰腺癌发生过程中起着重要作用,在肿瘤组织中发现了高水平的FAM3C蛋白表达[15,28-30]。在唾液腺、胰腺、结肠、十二指肠和乳腺中的分泌性上皮细胞中也有FAM3C的表达[13]。近年来FAM3C的功能和表达也在哺乳动物大脑中进行了研究,结果显示FAM3C水平降低与AD的发病有关,脑内FAM3C的表达水平在出生后达到峰值,随着年龄的增长而下降,与年龄匹配的正常脑相比,AD脑中FAM3C免疫反应神经元的阳性数量减少[15,30]。

A:3月龄,B:6月龄。
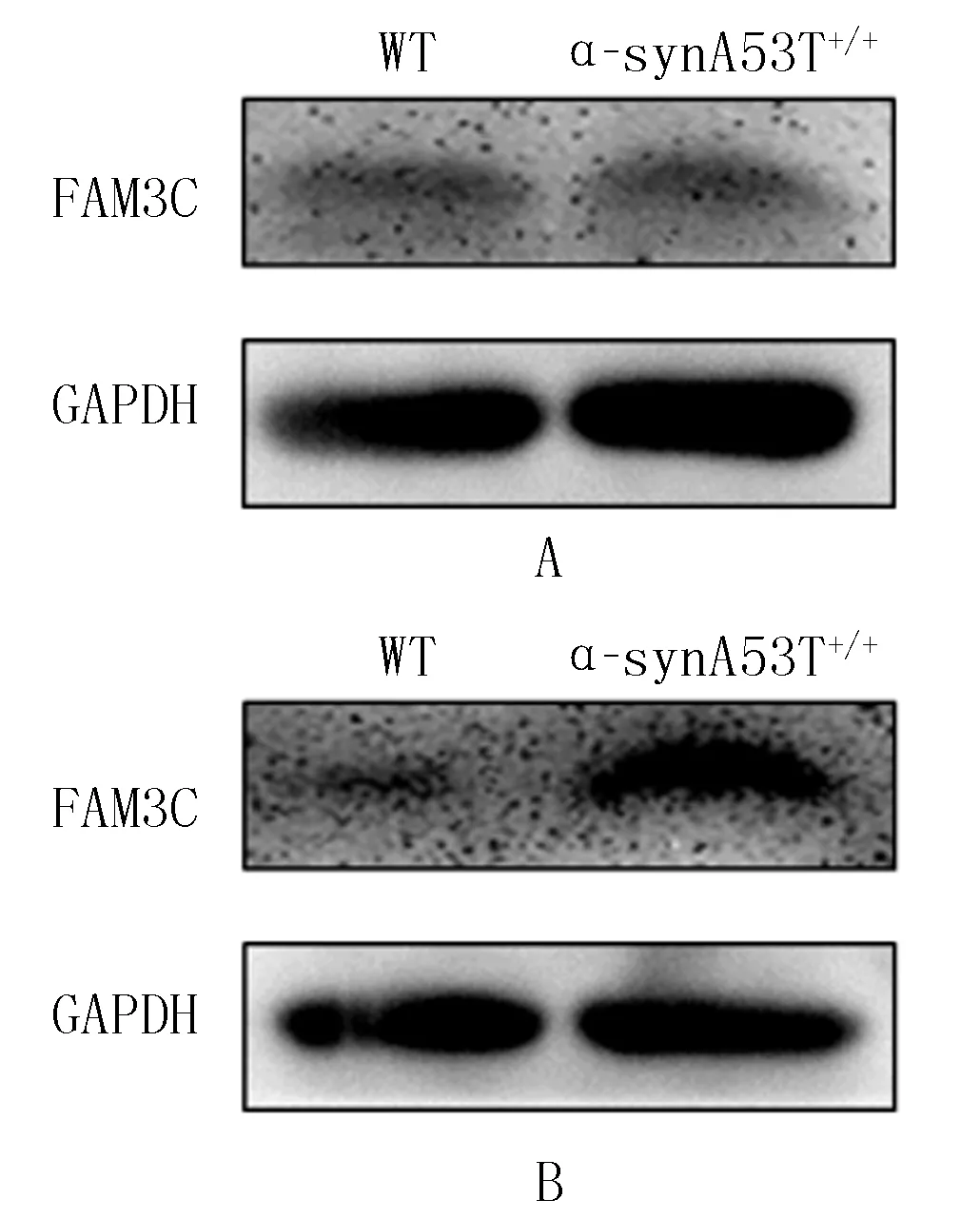
A:3月龄,B:6月龄。
本实验研究显示,PD模型小鼠在6月龄时SN区FAM3C蛋白表达水平出现增高,提示FAM3C异常表达参与了PD的发生及发展过程,为进一步阐述PD的发病机制提供了实验依据。
综上所述,在PD的发病过程中出现了SN区FAM3C的异常表达,但其对PD发病机制的作用还需要进一步的研究探讨。



