李敏
【摘要】 目的 分析严重药品不良反应(ADR),提供给临床用药方面重要讯息。方法 对东阿县人民医院2017年—2020年严重ADR报告中重点列项进行回顾性统计分析。结果 51岁以上人群(79.94%)为严重ADR高发人群;用药到出现严重ADR的时间以超过7 d(35.28%)居多;抗肿瘤药物(45.5%)和抗感染药物(14.32%)是导致严重ADR的前两位药品种类;累及器官损害以血液和造血系统损害为主(21.3%),患者以骨髓抑制表现多见。结论 持续深入、不断强化抗肿瘤药物和抗感染药物管理,提高临床药物使用合理性和安全性;医、药、护多团队、多环节关注临床用药过程,做到临床用药全过程的闭环管理;重视老年群体用药,加强用药监测,减少用药给风险人群带来的伤害。
【关键词】 严重药品不良反应;用药伤害;安全监测;管理策略
中图分类号:R969.3 文献标识码:A
文章编号:1672-1721(2023)10-0120-03
DOI:10.19435/j.1672-1721.2023.10.038
严重药品不良反应(ADR)上报率是评价医院合理用药的一项重要内容,是反映医院重视用药安全的一项关键指标[1]。因严重ADR对患者伤害较大,所以是药品ADR监测的重点内容。ADR监测不能仅仅停留在数据上报层面,而是要定期对数据“回头看”,进行重点统计分析,从而发现临床用药中导致患者伤害的风险药品,探究ADR发生的主要特点、发生和发展规律、可能因素及表现等,以利于制定用药管理策略,为临床提供有价值的用药信息,保障患者用药安全。本文就309例严重ADR报告进行了分析。
1 资料与方法
登录国家ADR监测平台,筛选并导出东阿县人民医院经聊城市和山东省药品不良反应监测中心评价为严重ADR的309例报告,登录电子病历系统对报告中患者信息(包括住院号、年龄、性别、体重、既往用药史、过敏史等)、用药情况(包括药品基本信息、具体用药方法、用药起止时间等)、ADR表现(包括何时出现ADR、累及器官部位及表现、采取干预措施时间及具体措施、患者转归情况等)、病程记录(包括是否将ADR情况如实记录病程)等内容逐一审核,并运用Excel办公软件对报告列项进行统计分析。
2 结果
2.1 合并用药情况 309例报告中,单独用药195例,占63.11%;合并用药114例,占36.89%,其中2药合并105例,3药合并8例,4药合并1例。
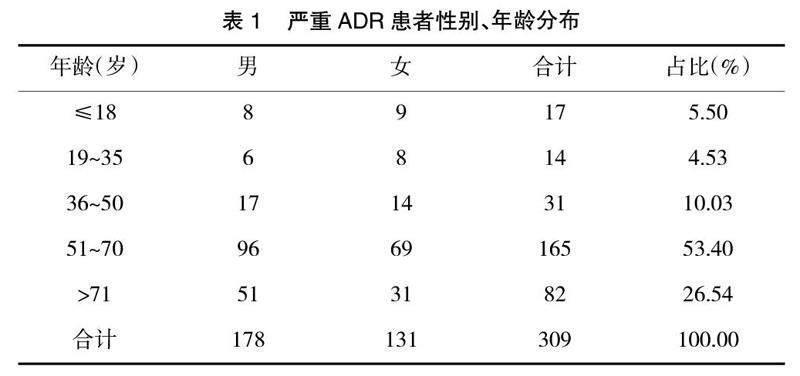
2.2 患者性别、年龄分布 309例报告中,涉及男性178例(57.61%),女性131例(42.39%),男女比为1.36∶1;最小年龄仅19 d,最大年龄94岁,严重ADR集中在51岁以上人群,见表1。
2.3 从用药到出现严重ADR的时间 超过7 d共109例(35.28%),48 h~7 d共104例(33.66%),24 h~48 h共39例(12.62%),24 h以内共57例(18.45%)。
2.4 怀疑药品给药途径 因同一病例存在多个怀疑药品,将所有药品纳入统计。静脉给药308例(71.13%),口服给药101例(23.33%),其他途径24例(5.54%)。
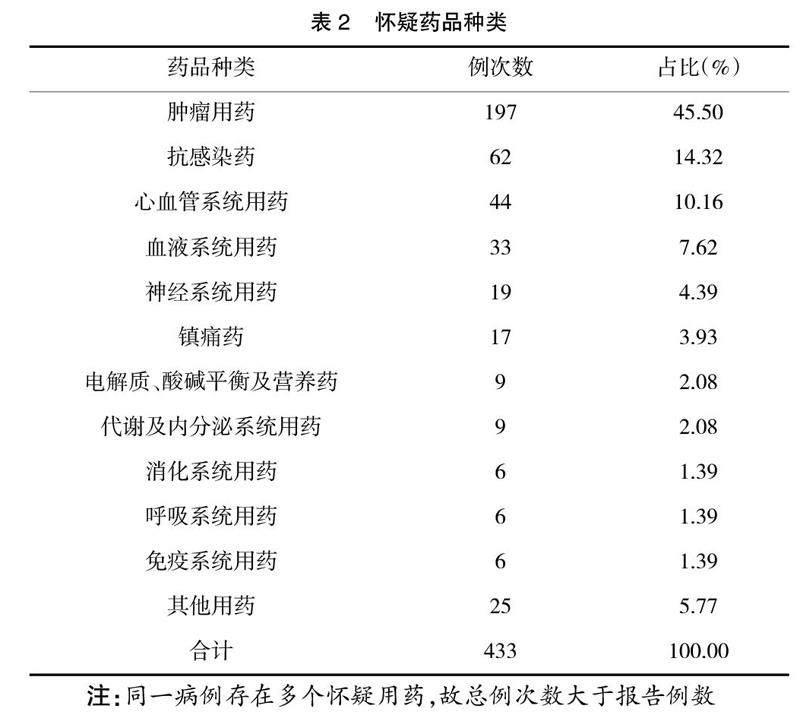
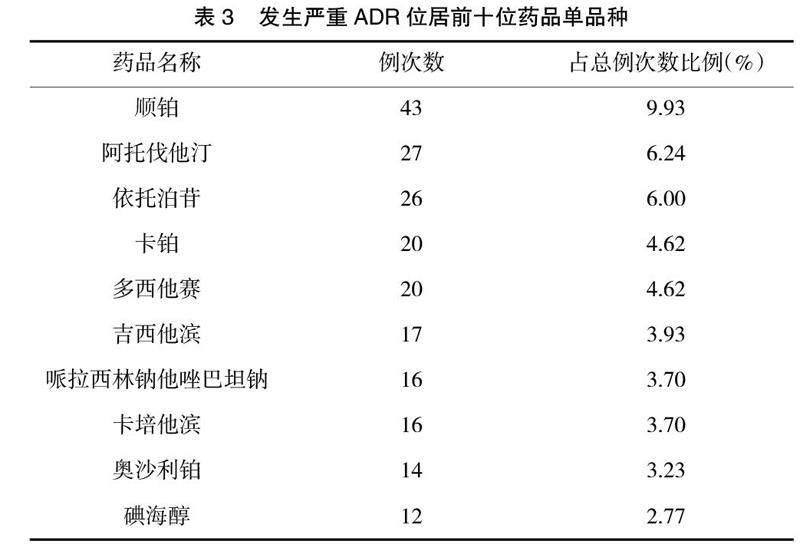
2.5 怀疑药品种类及位居前十位单品种 临床用药种类繁多,报告显示诸多药品种类均能导致严重ADR。其中,居前三位的药品所属种类是肿瘤用药(45.5%)、抗感染药(14.32%)、心血管系统用药(10.16%),见表2。发生严重ADR前三位的药品单品种依次是顺铂(9.93%)、阿托伐他汀(6.24%)、依托泊苷(6.00%),见表3。
2.6 严重ADR所致系统损害及临床表现 严重ADR对诸多系统产生损害,居榜首的是血液和造血系统损害(135例,30.27% ),患者表现以骨髓抑制多见;其次是全身性损害(57例,12.78%),以发热、寒战表现多见;第三位是肝胆系统损害(54例,12.11%),以肝功能指标异常多见,见表4。
3 讨论
3.1 关注严重ADR高风险人群用药 本研究显示,51岁以上人群是该院发生严重ADR高风险人群。原因可能与老年人群器官功能发生退行性改变,药动学和药效学均有所变化有关。除上述原因外,在我国老年人群存在多病共存情况,老年人患有疾病数平均为6种;在药物治疗过程中常有多药并用现象,平均为9.1种,更有甚者合并用药高达30多种[2-3]。多药并用中不免存在药物间的相互作用,尤其是相互作用不明确的药物并用,潜在增加用药伤害的发生。并用药品的种类数和数量越多,药物相互作用的发生概率越大,临床用药风险越大。相对于年轻人,老年人对药物反应的个体化差异更明显,这就要求医师打破常规“药品越贵越好,越多越好”的用药思维,遵循“少而精”的给药原则,凡可以单药治疗的,不多药并用;须多药并用时,需在保证治疗效果的前提下,尽可能减少并用药品种类及数量,且选择明确的、药物间相互作用少的药物并用。同时做好患者用药前评估,制定个体化、适合患者的用药方案。护理人员在日常工作中担负着为患者配制、发放药品的职责,在用药安全管理中起到重要作用,要求护士正确执行医嘱,同时做好用药宣教,留意并及时获取患者用药反应,发现异常情况及时告知主管医师,以便及时采取措施。药师应建立起负责临床药品疗效监测与用药安全的理念和担当,履行好处方审核、用药指导的职责,充分把握、利用医院多学科会诊的平台,积极参与临床会诊和病例讨论;并着重把严重ADR高风险人群列为药学重点监护对象,及时发现潜在的用药风险或用药错误,做到提早干预,减少老年患者用药伤害的发生。
3.2 关注院外用药,建立随访体系 本研究中大部分ADR发生在住院期间,因在院期间患者一旦出现任何不适症状可立即告知医务人员,再者医师会定期评价治疗效果,可及时甄别ADR并采取措施。值得注意的是,仍有超1/3的严重ADR发生在用药后7 d,最长达用药后数年,提示患者出院后仍存在很大的用药风险。医务人员应充分告知、教育患者使用药物所面临的风险及可能出现的不良反应,告知其出院后应定期复查,不能凭个人经验擅自改变用药方案,包括随意改变用药剂量、擅自停药、盲目联用药品等。须对长期用药的高风险患者定期开展有效随访,动态了解患者情况。该院是聊城市批准的定点门诊慢性病患者审批、用药报销单位,获批患者万余名,这些慢性病患者多在家自行服药,用药种类多,用药存在安全隐患,临床药师需要重点加强对这部分患者的药品不良反应监测工作[4]。
3.3 加强抗肿瘤药物管理 抗肿瘤药物是导致该院严重ADR的首位药品种类,共119例,占45.50%。张娟等[5]对887例严重ADR报告进行统计和分析,得出抗感染药物居ADR药品种类首位,占比为43.67%。该院与之不同。原因有:(1)本县域内仅有2所较大型医院,仅该院具备开展肿瘤化疗技术相关条件,故来该院就诊的肿瘤患者较多。(2)医院将ADR上报情况纳入科室合理用药质控指标,实行院、科两级管理,医院质控部门与药学部签订ADR管理相关指标,作为院级药事管理考核指标之一;药学部参考往年各科室ADR上报情况,结合专业收治病种数和药品使用等情况,与各专业科室主管签订科级ADR上报指标。科主任作为科室管理的一把手,将签订的各项指标作为科室管理抓手,所以科室上报积极性高。(3)增设病区ADR监管医师,负责该病区内药品ADR上报监管工作。从单品种看,顺铂、依托泊苷居抗肿瘤药物前两位,肿瘤药物治疗多为联合用药,顺铂与依托泊苷联用导致的ADR最多,使用者原患疾病以肺癌为主,与报道一致[6]。有数据显示肺癌在2016年山东省恶性肿瘤发病数排位中居于首位[7],两药正是治疗肺癌的主要品种,临床使用较为广泛。抗肿瘤药物所致不良反应可累及多个器官系统,各系统损害发生时间不同,胃肠系统多见于用药当天出现,血液系统多集中在用后1~10 d之内。有文献报道,铂类抗肿瘤药物不良反应发生时间在用药后半小时内发生达60%[8]。本次调查发现抗肿瘤药物所累及器官损害以血液和造血细胞系统为主,临床表现以骨髓抑制多见,与报道相符[9]。提示临床在使用该类药物时,应全面评估患者病情,严格掌握化疗指征,化疗前后密切监测血液指标,对常见的、通过人为干预能减少的ADR做到提前干预,对发生严重ADR风险高的药品做好应急处理预案。鉴于此类药物导致严重ADR较多,要求做好抗肿瘤药物的事前审核、事中监管、事后点评的全过程管理。该院制定了以下管控措施:(1)将抗肿瘤药物纳入临床用药重点监控品种,实行指标监测和管理。(2)制定分级管理目录,根据日常监测结果进行动态调整,将抗肿瘤药物的毒副作用作为肿瘤药物分级的重要参考,药品毒副作用大,则管理级别相对较高,临床需谨慎选用,必要时需提请相关专家会诊同意后方可使用。(3)药学部加大对新药临采的监管力度。临床确需使用目录外的抗肿瘤药物时,应遵照该院药品临时采购程序提出申请,并有循证医学证据支持,在使用环节要求科室严密观察ADR,为后期评价药品安全性及是否将其纳入药品供应目录提供参考。(4)加快信息化建设,助力抗肿瘤药物的管理。药师会在信息系统对抗肿瘤药物进行标记,维护药品分类级别和医师使用权限,按照国家相关政策文件要求每月对抗肿瘤药物使用数据进行统计和分析,指标包括:不同级别抗肿瘤药物使用率、金额占比、处方合格率等,以动态监测和评价抗肿瘤药物的临床使用情况。(5)加强药师处方审核能力建设,逐步完善抗肿瘤药物处方审核规则库,在系统自带规则的基础上,结合医院实际情况制定个体化的管理规则,提高审方效率和准确性。审方小组定期评价审方效果,减少审方假阳性与假阴性的产生;同时指定专人进行事后处方点评,针对发现的问题,及时反馈科室,进行持续改进,以进一步提高抗肿瘤药物处方合理率。
3.4 持续强化抗感染药物管理 抗感染药物是导致严重ADR的第二位药物。该院从2000年左右就开始抗菌药物管理,经过20多年管理,逐步完成从指标管理到过程管理,从粗放式管理到精细化管理,从行政管理到技术管理的转变,可以说抗菌药物的管理带动了医院整体的管理水平。不管是医院层面还是科室层面,诸多抗菌药物监测指标均达到国家规定要求。通过管理深切感悟到:指标不是衡量与评价药物临床使用合理与规范的唯一标准,指标仅是管理的一个参考和抓手,使用过程的合理性和患者的良好转归才是关注的重点。通过药学部日常会诊查房、医嘱审核及点评发现,目前抗感染药物使用中仍存在不合理情况,包括选药起点高、未结合抗菌药物PK/PD特点正确给药、未及时动态监测与评估疗效所致疗程长等问题,而不合规、大量使用抗菌药物会加剧ADR的产生[10]。近几年该院哌拉西林钠他唑巴坦钠使用金额在全院药品中稳居第一,临床使用较为广泛 ,带来的问题是其导致的严重ADR居抗感染药物首位。对患者造成的伤害以肝功能异常多见,数据显示肝功能异常出现的时间平均在6 d左右,提示临床使用此药物期间定期监测肝功能指标是非常必要的。而且在感染性疾病得到有效控制后,应及时降阶梯或者停用药物,减少过度治疗带来的药品不良反应。治疗感染性疾病时,提倡抗菌药物选择多元化、精准化,警惕习惯性、固定选用某一抗菌药物品种治疗临床各种感染的集体无意识用药。抗感染治疗须做到有的放矢,到位而不越位。
药品管理是一个系统工程,绝非仅仅是药学部门和临床科室主任的事情,而是需要全员的共同参与。近年来该院不断探索有效的药品管理模式,提出人人参与管理的理念。为加强合理用药管理,在各病区选拔一名用药管理主任,以协助科主任做好科室用药管理的具体工作。病区用药管理主任实行双重管理,服从科室主任和药学部主任的管理,使其在科室用药方面有权威性,每月参加药学部组织的合理用药会议,做好沟通桥梁,并组织实施药事管理相关规定。另外,医院探索将能否发现药品不良反应作为评价医师能力的一项指标,药学部负责从科室、医师不同维度汇总、反馈ADR上报情况,结果与医师绩效挂钩。纵然医院药品种类繁多,但具体划分到每个专业的药品种类相对固定。科室用药管理主任根据科室常用药品目录制定药品培训计划,重点学习说明书内容,并进行考试考核,后期职能部门进行督查,了解医师掌握情况。医师对常用药品有全面了解,与患者交流中有意识、有目的地询问ADR情况,一旦发生ADR,医师能够迅速甄别出来。上述举措的实施,使该院药品不良反应监测与评价工作改善颇多,同时提高了临床用药的安全性。应始终以患者安全为工作中心,充分发挥学科交叉优势,做好药品安全监测工作,切实保障患者用药安全,为实施健康中国战略保驾护航。
参考文献
[1] 国家卫生健康委员会.关于印发药事管理和护理专业医疗质量控制指标的通知[EB/OL].(2020-08)[2021-04-22].http://www.nhc.gov.cn/yzygj/s7657/202008/c39639a79f7d4a6b
935f33f87c57e2dc.shtml.
[2] 龙丽萍,周于禄,阳国平.309例老年人严重药品不良反应报告分析[J].中国药物警戒,2009,6(1):26-30.
[3] 中国老年医学研究会内分泌代谢分会,中国毒理学会临床毒理专业委员会.老年人多重用药安全管理专家共识[J].中国药物警戒,2018,15(10):627-640.
[4] 陈嘉宁,王匀,张慕华,等.某三级综合医院187例严重类药品不良反应的分析与探讨[J].中国处方药,2021,19(1):69-72
[5] 张娟,王登峰,熊永山,等.887例新的和严重的药品不良反应报告分析[J].中国医院药学杂志,2014,4:326-331,336.
[6] 马玉琴,刘叶芳,薛烽.2016—2017年同煤集团总医院铂类药物的不良反应分析[J].现代药物与临床,2018,33(2):427-432.
[7] 山东省卫生健康委员会.山东省居民疾病与健康状况报告[EB/OL].(2020-12)[2021-04-22].http://wsjkw.shandong.gov.cn/zwgk/fdzdgknr/tjgb//202012/t20201216_3489737.html.
[8] 金星,吴文清,伍延婷.127例铂类抗癌药物不良反应报告回顾性分析[J].安徽医药,2017,21(8):957-959.
[9] 崔琪,闫素英.抗肿瘤药物引起的严重不良反应报告分析[J].中国临床药理学杂志,2015(8):654-656.
[10] 陈敏,曾晓燕,陈燕平.2017—2019年云浮市人民医院抗菌药物不良反应分析[J].现代药物与临床,2020,35(11):2278-2282.
(收稿日期:2023-01-22)



