景竹春 罗焕超 陈宁 徐静 王淑红

【摘要】 目的 探讨子宫平滑肌肉瘤的临床病理特征、免疫组化、诊断与鉴别诊断及预后。方法 应用组织活检及免疫组化方法对5例子宫平滑肌肉瘤进行病理特征分析,同时结合临床资料并复习相关文献。结果 5例患者年龄51~77岁,中位年龄63岁,有阴道不规则出血或盆腔肿块,腹痛及压迫症状;行超声检查发现子宫肌瘤,单发多见,肿瘤最大径均>10 cm。巨检,肿瘤最大者直径17 cm,最小者10.5 cm,切面张力小,无隆起,灰白灰红灰褐色,质地中等硬,部分质软,可见出血及坏死区,1例呈胶胨样外观。镜下表现3例为经典型子宫平滑肌肉瘤,1例为上皮样平滑肌肉瘤,1例为黏液样平滑肌肉瘤;组织学表现为肿瘤细胞浸润肌层,其中3例经典型平滑肌肉瘤见凝固性坏死及出血区;多数肿瘤细胞密集丰富,细胞核有中~重度非典型性,核分裂象>10个/10HPF,黏液样子宫平滑肌肉瘤的细胞核异型性不明显,核分裂象稀少。免疫组化:3例P53弥散强阳性表达(TP错义突变),1例表现为全阴模式的阳性表达(TP无义突变),其余1例强弱不等阳性(TP53野生型),1例CD117阳性表达,3例P16弥散强阳性。术后随访,1例由于合并其他脏器疾病而死亡,其余均健在。结论 子宫平滑肌肉瘤是罕见的间叶组织来源肿瘤,呈侵袭性生长,预后差,明确诊断需结合组织病理学形态、影像学特点及免疫组化表达。
【关键词】 子宫平滑肌肉瘤; 组织病理; 影像; 免疫组化
中图分类号:R736.3 文献标识码:A
文章编号:1672-1721(2023)17-0097-03
DOI:10.19435/j.1672-1721.2023.17.032
子宫平滑肌肉瘤的临床症状不典型,患者多数因不规则阴道出血、盆腔包块、下腹疼痛或压迫症状就诊,在术前检查中,超声和核磁共振对确定子宫肿瘤良恶性有一定的帮助,明确诊断多依靠术后病理检查。本文报道5例子宫平滑肌肉瘤,并结合相关文献对术前预判、术后病理大体及组织学镜下检查、辅助免疫组化指标等方面进行探讨。
1 材料与方法
1.1 材料 收集北京市第一中西医结合医院及顺义妇幼保健院2016年1月—2022年5月确诊的子宫平滑肌肉瘤患者5例,年龄51~77岁,中位年龄63岁,病例均有临床不适,部分有不规则阴道出血,部分有腹痛,盆腔包块及压迫症状。超声提示子宫实性包块,收住院并手术治疗。
1.2 方法 主要取材包括肿瘤本身、与子宫肌层交界处、肉眼可见出血坏死区域,标本均经10%福尔马林溶液固定,组织经自动脱水机处理,石蜡包埋并切片,HE染色。免疫组织化学检测采用通用型二步法(PV-6000)进行,BenchMark GX 型号的自动染片机制片。一抗ER、PR、Desmin、CD10、CK、P16、P53、CD117、Ki67、SMA等,二抗使用增强显色为UltraView Universal DAB,以上试剂均购自罗氏公司。
2 结果
2.1 临床资料 肿瘤最大径均>10 cm,超声示4例肿瘤形态欠规则,1例与子宫界限清楚。1例位于黏膜下,其余位于肌壁间,突向浆膜面,见表1。
2.2 巨检 5例子宫平滑肌肉瘤肿瘤最大者直径17 cm,最小者直径10.5 cm,切面不见漩涡状结构,质软到中等硬度,弹性小,所有肿瘤切面张力小,无隆起性改变,呈回缩状。3例切面与子宫肌层界限模糊,灰白灰红,五彩状,见出血坏死区;1例切面呈胶胨样,未见坏死,肉眼观与周围肌层界清;1例因是肿瘤剔除术,与肌层界限不能评估。
2.3 镜检 经典型子宫平滑肌肉瘤的肿瘤细胞密集,大小不一,多种形态,瘤细胞长形、短梭形,瘤巨细胞多(见封三图1)。细胞核增大,核多形性,核膜不规则,核染色质可团块状,粗颗粒状,边集在核膜下,核仁清楚,可见病理核分裂象(见封三图2、图3)。上皮样平滑肌瘤肉的肿瘤细胞上皮样,非典型性明显,胞浆略丰富,核圆形或不规则,核分裂象少(见封三图4)。黏液样子宫平滑肌瘤的肿瘤细胞相对稀疏,松散排列于黏液样基质内,细胞核星芒状或短梭形,核异型性不明显(见封三图5)。经典型子宫平滑肌肉瘤及上皮样平滑肌肉瘤可见坏死,与正常组织无渐近性改变,两者界限清楚。坏死组织中可见肿瘤细胞核碎片和多形性的细胞核。黏液样平滑肌肉瘤末见肿瘤性坏死。3例镜下见肿瘤细胞与正常的子宫平滑肌界限不清,浸润肌层(见封三图6),局灶呈舌状。其中1例见肿瘤细胞浸润血管壁(见封三图7),1例因第一次行肌瘤剔除术,无法镜下评估肿瘤与肌层的界限。
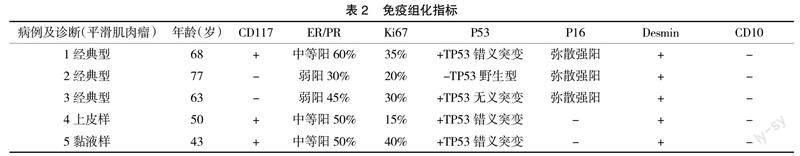
2.4 免疫组化 5例患者的肿瘤细胞30%~60%弱至中强度表达ER/PR,KI67指数阳性,均大于15%,最高达40%(见封三图8)。3例P16弥散强阳性(见封三图9),2例P53弥散强阳性表达(TP错义突变),2例表现为全阴模式的阳性表达(TP无义突变),其余1例强弱不等阳性(TP53野生型)。CD117仅1例阳性表达。Desim均阳性表达,CD10均阴性表达,见表2。
3 讨论
子宫肉瘤罕见,呈侵袭性生长,易发生肺和肝转移,预后差,占所有子宫恶性肿瘤的1%[1]。子宫平滑肌肉瘤多发生于成年妇女,平均年龄为50~55岁,比平滑肌瘤的发病年龄大10岁左右。本研究中发现年龄最大者77岁,最小者43岁,中位年龄68岁。子宫平滑肌肉瘤一直以来都是妇科病理学中最难诊断的病症,原因是对诊断要点的掌握有主观性,不同病理医师之间观点的可复性差,免疫组化的作用也有限,影像学参考价值一般。
3.1 诊断 子宫平滑肌肉瘤大体观可以是界限清楚的肿块,如本文中的黏液性平滑肌瘤;也可以表现与正常肌层分界消失,表现为界限模糊不清的肿块,如经典型平滑肌肉瘤及上皮样平滑肌肉瘤。肿瘤切开处显凹陷,质软,弹性小,不隆起,缺乏张力,切面显同质性。镜下诊断平滑肌肉瘤一般要考虑以下几个方面:核分裂象的多少,细胞核的非典型性,肿瘤性坏死,细胞密度,细胞的多形性,肌层浸润情况,血管受累与否。经典型平滑肌肉瘤镜下细胞丰富,由单形或多形性的梭形细胞构成,可排列成束状,细胞核染色质粗颗粒状,团块状,染色质边集使核膜增厚不规则,一般核仁明显。变异型的上皮样平滑肌肉瘤细胞非典型性明确,细胞圆形多见,也有不规则形,核分裂象不多,可见肿瘤性坏死。变异型黏液样平滑肌肉瘤细胞异型性不明显,核分裂活性低,Ki67指数不高,诊断有一定困难。高福平等[2]报道1例黏液样平滑肌肉瘤,临床表现不特异,组织学上轻度细胞异型性,Ki67仅10%表达,但是观察到了典型的黏液样基质及镜下的不规则肌层和血管浸润,因此诊断为黏液样平滑肌肉瘤。唐云等[3]报告的子宫黏液性平滑肌肉瘤,同样在黏液样基质的背景下,肿瘤细胞轻~中度异型,可见凝固性坏死,镜下浸润肌层可见,符合黏液样平滑肌肉瘤的诊断标准。子宫平滑肌肉瘤的诊断金标准是组织病理学,因此要结合镜下及大体观,但同时要详细询问病史,排除其他能引起肿瘤坏死和核分裂活性增加的因素,多方面综合分析,才能明确诊断。
3.2 辅助检查 子宫肌瘤的术前辅助检查中,超声检查是首选的影像学检查。有学者认为超声对早期诊断有一定的帮助。褚一川等[4]研究了93例子宫平滑肌肉瘤的彩色多普勒超声图,认为子宫平滑肌肉瘤总体特征是肿块体积较大,边界不清,频谱呈低阻改变;肌壁间型最多见,多单发,肿瘤内部回声不均。本文发现的5例也是以肌壁间单发为主,肿瘤最大径为17 cm,最小者直径10.5 cm。工作中会偶然遇到患者并不是以发现子宫肿瘤为首诊原因,而是其他临床不适而就诊。刘蓉辉等[5]报道1例患者,因下肢无力,腰间盘突出,深静脉血栓就诊,因触诊发现下腹部包块,行MRI检查,发现子宫平滑肌肉瘤。放射学研究,核磁共振有提示平滑肌瘤的作用,李晶奕等[6]对术后明确为子宫平滑肌肉瘤患者的MRI 及 DWI 检查和分析ADC 值后认为,子宫肉瘤的 ADC 值低于退行性变子宫肌瘤,可用于鉴别子宫肉瘤和良性子宫平滑肌瘤的退行性变[6]。在术前预判子宫肿瘤良恶性方面,张国瑞等[7]在回顾性分析子宫肌瘤术前良恶性预测研究中指出,综合以下各项指标子宫平滑肌肉瘤术前诊断成为可能:年龄≥42岁,肿瘤大小≥6.7 cm,血小板≥298×109/L,血清乳酸脱氢酶≥185 U/L,中性粒细胞淋巴细胞比值≥2.8[7]。免疫组织化学检查在子宫平肌肿瘤诊断中有一定的参考意义,平滑肌肉瘤中P53和MIB-1表达比平滑肌瘤强,但ER、PR和bcl-2的表达比平滑肌瘤弱。当肿瘤细胞具有明显核异型,且大于15%的肿瘤细胞表达MIB-1和P53时,应该诊断为平滑肌肉瘤而非恶性潜能未定的平滑肌肿瘤或富于细胞性平滑肌瘤。最近研究发现,P16阳性有助于平滑肌肉瘤的诊断和鉴别诊断[8],本研究中的病例P16表达阳性率为60%。CD117对于鉴别子宫平滑肌肿瘤的良性与恶性有参考意义,平滑肌肉瘤63%。本文中的5例CD117表达阳性率为20%,比较低,原因可能是病例数少。子宫平滑肌肉瘤与子宫内膜间质肿瘤的鉴别可选择以下抗体:CD10、Desmin、P16、ER/PR。子宫内膜间质肿瘤中,ER/PR高表达,CD10阳性表达,Desmin 和h-caldesmin阴性表达。本文5例患者,CD10和Desmin均阴性表达,排除了子宫内膜间质肿瘤的诊断。总之,免疫组化辅助检查对明确子宫平滑肌肉瘤的诊断有一定帮助。
3.3 治疗和预后 子宫平滑肌肉瘤复发及转移率高,即使临床分期为Ⅰ期,亦存在较高的复发风险,预后不佳。侯蓉等[9]研究总结了20例子宫平滑肌肉瘤的临床病理资料,并对6例进行了5年随访,发现2年的生存率为75%, 5 年生存率为50%,提示预后不佳。子宫平滑肌肉瘤绝大多数是偶发的,发病风险增高原因包括基因突变年龄,肿瘤大小等。子宫平滑肌肉瘤的治疗以全子宫切除及双侧输卵管卵巢切除为主要手术方式。随着医学技术的不断发展,微创手术由于其手术创伤小,创面愈合时间短,术后并发症小等优势被广泛应用,因此肌瘤粉碎术为巨大子宫肌瘤的微创手术提供了可能。但是,这种微创肌瘤粉碎手术适用于治疗良性子宫平滑肌瘤,不适用于子宫平滑肌肉瘤。研究认为,子宫平滑肌肉瘤的辅助治疗最有效的是化疗,但也有学者认为化疗不能确定是否有效。如Amant等[10]在回顾性综述中总结子宫平滑肌肉瘤化疗的标准一线治疗方案为多柔比星+异环磷酰胺,指出这种联合化疗方案其实并没有证据表明临床获益很大,因此不建议常规应用于肿瘤较局限的患者。目前,靶向药物研究飞猛发展,研究者发现一种靶向药物帕唑帕尼可延长患者的生存时间[11]。我国多采用体外放疗作为术后放疗的主要方式,但有学者提出术后体外照射意义不大,反而可能增加放疗副反应,增加患者痛苦[12]。该院以中西医结合治疗为主要手段,放射治疗的子宫平滑肌肉瘤例数不多,疗效还需进一步研究,需要大量病例数据来证实放疗效果是否可靠。现在仍以手术为主,同时辅以个体化化疗等综合治疗,以延长患者生存期。
综上所述,子宫平滑肌肉瘤病例少见,患者有阴道不规则出血,盆腔疼痛及压迫症状,超声检查发现子宫肿瘤,如果怀疑子宫肉瘤可能性大,则首先选择开腹手术,术后病理评估,如果子宫平滑肌肉瘤诊断成立,则术后辅助以化疗和放疗,以改善患者预后。
参考文献
[1] FRIED RICH M,VILLENA-HEINSEN C,MINK D,et al.Leiomyosarcomas of the female genital tract:a Clinical and histopathological study[J].Eur J Gynaecol Oncol,1998,19:470-475.
[2] 高福平,魏谨.子宫粘膜下高分化黏液性平滑肌肉瘤1例[J].诊断病理学杂志,2020,27(4):236.
[3] 唐云,张雨涛,李小红,等.子宫粘液样平滑肌肉瘤临床病理分析[J].诊断病理学杂志,2020,27(3):158-161.
[4] 褚一川,邢肖肖,张彦萍.彩色超声在子宫平滑肌肉瘤中的诊断价值[J].影像研究与医学应用,2019,3(9):149-150.
[5] 刘蓉辉,贾秀川,何磊,等.巨大子宫平滑肌肉瘤漏诊一例[J].临床误诊误治,2016,29(10):66-67.
[6] 李晶奕,杨石平.MRI扩散加权成像对子宫平滑肌肉瘤的诊断价值[J].中国现代医药杂志,2020,22(2):32-35.
[7] 张国瑞,于昕,樊庆泊,等.隐匿性子宫平滑肌肉瘤的术前预测因素分析[J].生殖医学杂志,2020,29(5):581-585.
[8] CHEN L,YANG B.Immunohistochemical analysis of P16,P53 and Ki-67 expression in uterine smooth muscle tumors[J].Int J Gynecol Pathol,2008,27(3):326-332.
[9] 侯蓉,李俊杰.子宫平滑肌肉瘤的分析[J].中国医药指南,2012,10(18):510-511.
[10] AMANT F,LORUSSO D,MUSTEA A,et al.Management Strategies in Advanced Uterine Leiomyosarcoma:Focus on Trabectedin[J].Sarcoma,2015(12):704124.
[11] 董虹,吴哲,高慧.子宫平滑肌肉瘤超声与磁共振的诊断[J].中国优生与遗传杂志,2016,5(13):79,119.
[12] 李雪莹,肖丽,黄薇,等.促性腺激素释放激素激动剂治疗子宫内膜异位症反向添加药物疗效比较研究[J].中国实用妇科与产科杂志,2017(6):57-60.
(收稿日期:2023-03-19)



