陈雷 黄智慧 叶荣苹 肖建新
NNMT基因多态性 血清内脂素与非酒精性脂肪肝病的相关性
陈雷 黄智慧 叶荣苹 肖建新
目的 探讨NNMT基因多态性(rs694539) 及血清内脂素(Visfatin)、同型半胱氨酸(Hcy)与非酒精性脂肪肝病(NAFLD)的相关性。方法 收集NAFLD患者与入组患者种族、年龄、性别相匹配健康志愿者为研究对象,利用聚合酶链限制性长度多态性分析(PCRRFLP)技术检测NNMT基因多态性,酶联免疫法测定所有患者的血内脂素水平。结果 NAFLD组内脂素水平较对照组高(P<0.05),两组间NNMT基因型分布差异有统计学意义(P<0.05),Logistic回归分析GG基因型HCy水平为保护因素,ALT及visfatin水平为危险因素。随访期间NNMT基因GG与AA基因型间的累积转归有明显差异Log Rank=5.460,P=0.019。结论 NNMT基因多态性(rs694539)与NAFLD发生具有相关性。NAFLD与血清visfatin水平相关,AA基因型增加NAFLD发生及进展的风险。
NNMT基因多态性 非酒精性脂肪性肝病 内脂素
非酒精性脂肪肝病(NAFLD)由遗传-环境-代谢应激因素及与血脂异常、高胰岛素血症、2型糖尿病等相关因素所致,其发病具体机制尚未明确,研究认为[1],脂肪组织能分泌一系列蛋白,包括瘦素(1eptin)、脂联素(adiponectin)、抵抗素(resistin)、内脏脂肪素(visfatin)等。同型半胱氨酸(Hcy)越高,血脂水平越高[2]。研究[3]显示,非酒精性脂肪性肝炎(NASH)患者血清Hcy水平较低,可以独立预测NASH的存在。研究[4]证实,尼克酰胺N-甲基化酶( NNMT) 基因参与Hcy代谢,NNMT基因多态性与NASH具有一定的相关性。本文探讨NNMT基因多态性(rs694539) 及血清内脂素、同型半胱氨酸与NAFLD的相关性。
1 临床资料
1.1一般资料 选择2007年1月至2010年10月本院NAFLD患者100例(NAFLD组)。男47例,女53例;年龄17~78岁,平均( 44.27±15.79)岁。另选择同期150例健康体检者为对照组,男78例,女72例;年龄18~81岁,平均年龄(46.05±16.97)岁。NAFLD诊断参照2006 年中华医学会肝脏病学分会诊断标准[5]。两组均排除酒精性脂肪肝(ALD)、肝豆状核变性、自身免疫性肝病、慢性丙型肝炎等导致脂肪肝及药物、炎症性肠病、全胃肠外营养、库欣综合征、甲状腺功能减退症等导致脂肪肝;肝脏恶性肿瘤、感染和胆道疾病,以及正在服用或近期曾服用可导致肝脏酶谱升高的中西药物。两组研究对象均为无血缘关系的散发人群,本项目经本院伦理委员会批准,所有受试者知情并签署同意书。
1.2NNMT基因型检测 (1)SNPs 的选择基因多态性的检测:从HapMap 数据库汉族人群群体中选择SNPs,基于Tagger 程序选择标签SNPs,定义参数为r2≥0.80和少见等位基因频率(MAF)≥5%最终选取代表性的SNPs rs694539位点(2)DNA提取:方法延续前期研究方案[3],晨起抽取静脉血3ml,采用DNA试剂盒提取人类白细胞基因组DNA。将提取好的DNA置于-20℃冰箱保存备用。DNA提取试剂盒(上海华舜生物工程有限公司)。(3)NNMT基因PCR反应体系、反应条件及电泳分析:方法延续前期研究方案[3],用聚合酶链限制性长度多态性分析(PCR-RFLP)技术检测NNMT基因多态性。NNMT基因可区分出3种基因型:即GG基因型(终产物为187bp的单一条带),AG基因型(终产物为187 bp、106 bp、81 bp的三条带),AA基因型(终产物为106bp、81bp的两条带)。
1.3统计学分析 采用SPSS17.0软件。经Hardy-Weinberg平衡检验确认样本的群体代表性,基因型及等位基因频率的比较用χ2检验,计量资料以(±s)表示,用t检验。以非条件性Logistic回归模型分析基因型与NAFLD相关性。随访数据采用Kaplan-Meier法,log-rank法进行检验,并绘制生存曲线。P<0.05为差异有统计学意义。
2 结果
2.1NAFLD组与对照组各观察指标比较 两组年龄、性别、超敏C反应蛋白、TG、TC、HDL-C、LDL-C差异无统计学意义(P>0.05)。NAFLD组BMI、FPG、AST、ALT均高于对照组,差异有统计学意义(P<0.05 或P<0.01)。NAFLD组Hcy及visfatin水平较对照组低,差异具有统计学意义(P<0.05)。
表1 NAFLD组与对照组各观察指标比较(±s)
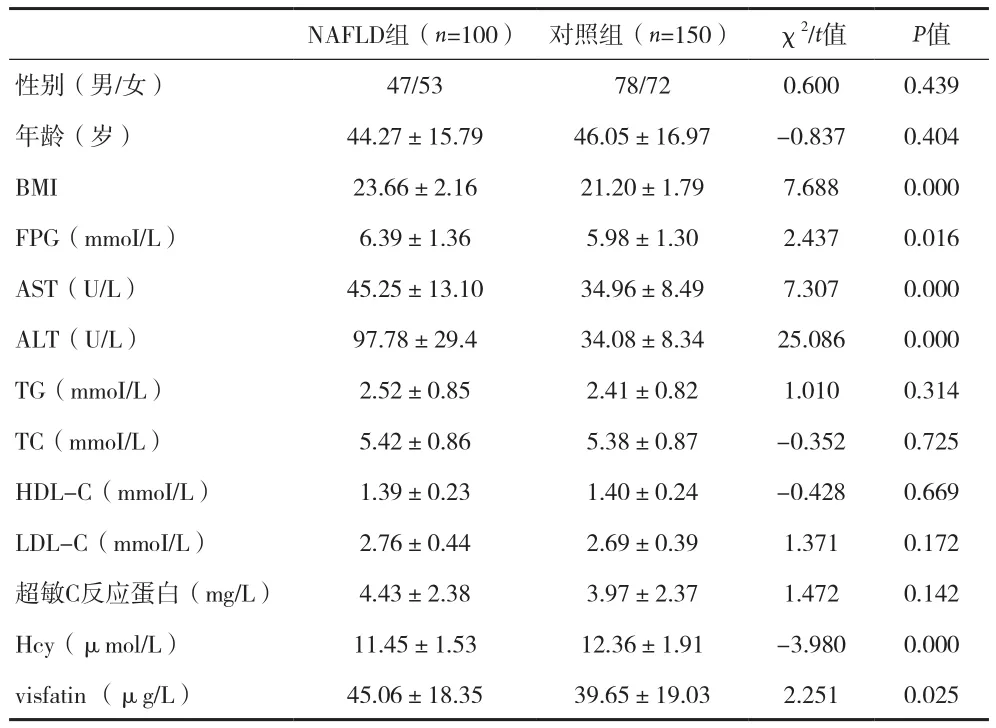
表1 NAFLD组与对照组各观察指标比较(±s)
NAFLD组(n=100) 对照组(n=150) χ2/t值 P值性别(男/女) 47/53 78/72 0.600 0.439年龄(岁) 44.27±15.79 46.05±16.97 -0.837 0.404 BMI 23.66±2.16 21.20±1.79 7.688 0.000 FPG(mmoI/L) 6.39±1.36 5.98±1.30 2.437 0.016 AST(U/L) 45.25±13.10 34.96±8.49 7.307 0.000 ALT(U/L) 97.78±29.4 34.08±8.34 25.086 0.000 TG(mmoI/L) 2.52±0.85 2.41±0.82 1.010 0.314 TC(mmoI/L) 5.42±0.86 5.38±0.87 -0.352 0.725 HDL-C(mmoI/L) 1.39±0.23 1.40±0.24 -0.428 0.669 LDL-C(mmoI/L) 2.76±0.44 2.69±0.39 1.371 0.172超敏C反应蛋白(mg/L) 4.43±2.38 3.97±2.37 1.472 0.142 Hcy(μmol/L) 11.45±1.53 12.36±1.91 -3.980 0.000 visfatin (μg/L) 45.06±18.35 39.65±19.03 2.251 0.025
2.2两组NNMT基因多态性比较 基因型频率在两组间NNMT基因型分布差异有统计学意义(P<0.05);两组G型等位基因频率分别为63.5%和75.0%,等位基因在两组间分布差异有统计学意义(P=0.006)。其次,GG基因型为NAFLD发病的保护因素(OR=0.577,95% C.I.=0.346-0.962; P=0.034),AA基因型为NAFLD发病的危险因素(OR=2.667,95% C.I.=1.157-6.147;P=0.018)。见表2。
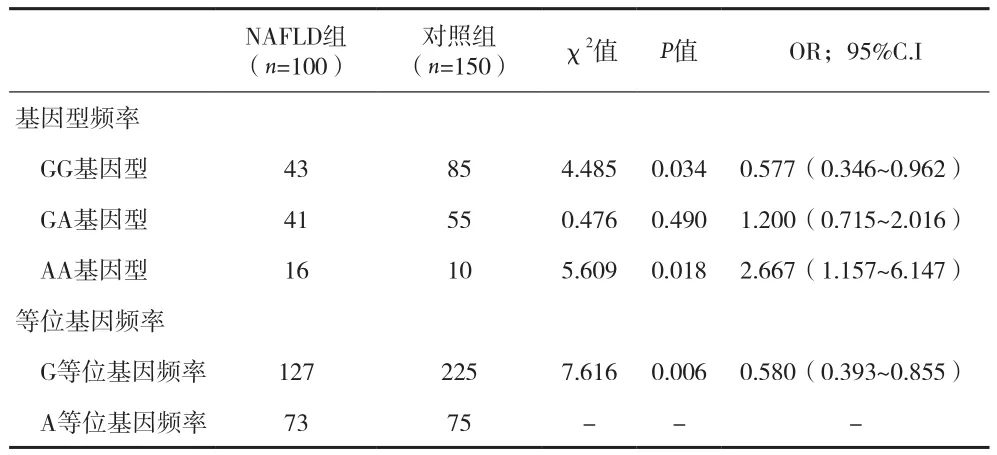
表2 两组NNMT基因多态性基因型分布和等位基因频率分布
2.3Hardy-Weinberg 平衡分析 NAFLD组和对照组NNMT基因多态性基因型Hardy-Weinberg 平衡分析,结果显示,NAFLD组χ2=1.335;P=0.248,对照组χ2=0.074;P=0.785,可以认为两组趋向于遗传平衡。
2.4不同基因型HCY及visfatin水平比较 NAFLD患者组内NNMT基因多态性基因型HCY及visfatin水平比较,AA型HCY及visfatin水平较GG及GA型均显着增高,组内比较有统计学意义(P<0.05)见表3。正常对照组内HCY及visfatin水平比较差异无统计学意义(P>0.05)。见表4。
表3 NAFLD患者不同基因型HCY及visfatin水平比较(±s)

表3 NAFLD患者不同基因型HCY及visfatin水平比较(±s)
注:与GG基因型比: *P<0.05; 与GA基因型比: # P<0.05
组别 n HCY visfatin GG基因型 36 11.82±1.47 39.37±16.04 GA基因型 32 11.28±1.59 44.91±19.39 AA基因型 32 10.11±1.50 *# 48.32±20.81*# F值 3.682 2.994 P值 0.019 0.038
表4 正常对照组不同基因型HCY及visfatin水平比较(±s)
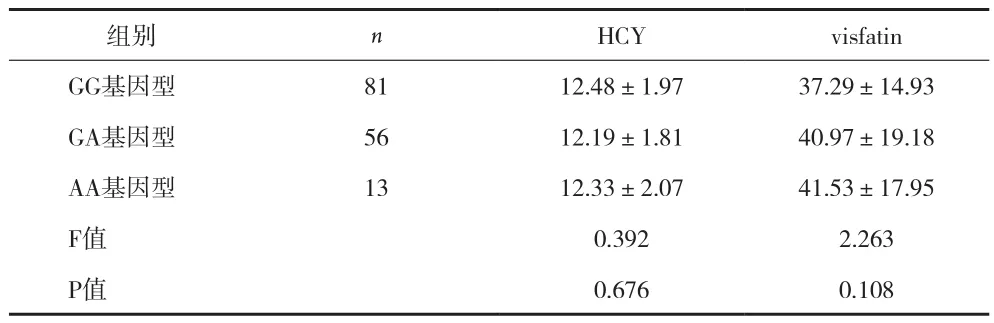
表4 正常对照组不同基因型HCY及visfatin水平比较(±s)
组别 n HCY visfatin GG基因型 81 12.48±1.97 37.29±14.93 GA基因型 56 12.19±1.81 40.97±19.18 AA基因型 13 12.33±2.07 41.53±17.95 F值 0.392 2.263 P值 0.676 0.108
2.5相关分析及回归分析 采用二分类非条件Logistic回归分析NNMT基因多态性与NAFLD发病的关系,纳入多因素AST、ALT、BMI、TG、TC、Hcy情况下,最终进入模型的因素:GG基因型(OR=0.249,95% C.I.=0.063-0.427; P=0.005),HCY水平(OR=0.917,95% C.I.=0.748-1.124; P=0.044) 为保护因素,ALT水平(OR=1.017,95% C.I.=1.006-1.027; P=0.002) 及visfatin水平(OR=1.265,95% C.I.=0.996-1.607; P=0.034)为危险因素,见表5。以复查NAFLD患者B超诊断评分为因变量(轻度1分,中度2分,重度3分),以visfatin、Hcy为自变量,然后进行相关性分析,发现Hcy 水平(r=-0.419,P=0.011)和B超诊断评分呈显着负相关,visfatin(r=0. 447,P=0.015)为正相关。
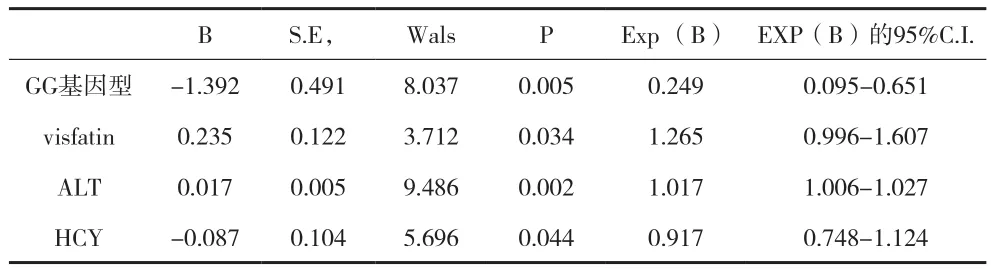
表5 NAFLD易感基因多态性的logistic回归分析
2.6NNMT基因多态性基因型与随访期间非酒精性肝病转归的关系 250例受检者中12例失访,平均随访时间4年。随访过程中,以复查B超脂肪肝发生及程度加剧为终点事件,评价非酒精性肝病转归。总体上,新发及加重发生率31.20%(78/250)。而AA基因型中新发及加重发生率65.38%(17/26)。经Kaplan-Meier法分析并绘制曲线后,随访期间NNMT基因GG与AA基因型间的累积转归有明显差异Log Rank检验统计量为5.460, P=0.019,见图1。
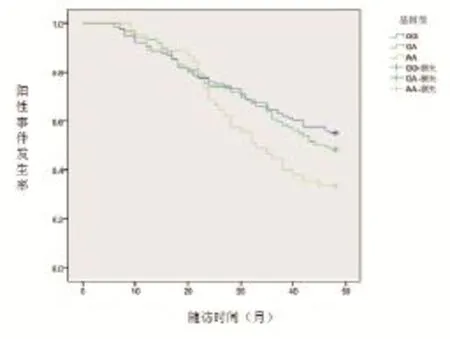
图1 NNMT基因不同基因型与随访期间非酒精性肝病转归的关系
3 讨论
近年来, 随着人们生活水平的提高,NAFLD的发病率呈逐年上升趋势。NAFLD的发病机制尚未明确,遗传-环境及多元代谢紊乱的相互作用可能是其主要的发病因素。首先,本研究通过NAFLD组和对照组NNMT基因(rs694539)基因型Hardy-Weinberg平衡检验,提示两组具有群体代表性。单因素分析,GG基因型为保护因素,AA基因型为危险因素。提示NNMT基因多态性(rs694539)与NAFLD的发病有相关性。国外Ali等[6]研究结果与本研究相似。其次,本资料结果提示,NAFLD患者中visfatin及Hcy水平较正常组低。Logistic回归分析提示GG基因型,HCY为保护因素,ALT、visfatin为危险因素,且Hcy水平与肝脏脂肪变呈负相关,血清visfatin为正相关。最后随访过程中,两组新发及加重发生率为31.20%(78/250)。而AA基因型中新发及加重发生率为65.38%(17/26)。累积阳性率NNMT基因GG 与AA基因型间有显着差异。
根据上述结果,推测可能原因为:(1)低水平Hcy抑制合成谷胱甘肽,上调组织对氧自由基反应的敏感性,且对肝内脂肪的转运与合成功能也有一定的上调作用。(2)人NNMT基因位于11号染色体长臂23.1,总长16.5kb, NNMT转录起始点为cDNA TATA box/TCTAAAbox3'端后30bp处,其非编码区存在高度多态性。NNMT基因的非编码区rs694539基因多态性对转录的调控有较大的影响[7]。NNMT是S-腺苷-L蛋氨酸(SAM)依赖的一种胞质酶,主要催化吡啶类及尼克酰胺物质的甲基化,使之形成吡啶盐。其通过甲基化S-腺苷蛋氨酸(SAM),使之形成N-甲基尼克酰胺,生成S-腺苷Hcy(SAH),后脱去腺苷合成Hcy,其活性强度与Hcy水平形成正相关联系。Hcy水平的改变很大程度上受rs694539基因多态性影响。尤以GG基因型对NNMT酶活性影响较大。(3)visfatin通过调控血糖及模拟胰岛素的作用,导致胰岛素抵抗,使得脂肪组织在肝脏异常堆积,诱导肝脏的胰岛素受体底物的磷酸化,通过不同于胰岛素的信号转导机制,激活受体后信号转导通路发挥类似胰岛素的生物学作用。诱导脂肪和肌肉组织中的葡萄糖摄取并抑制肝脏组织中葡萄糖生成[8]。
本试验通过比较分析NNMT基因多态性(rs694539)与NAFLD的相关性,NAFLD与血清visfatin及Hcy水平相关,研究分析显示NNMT基因(rs694539)的A等位基因频率为NAFLD的危险指标,AA基因型人群更易发生NAFLD及其脂肪肝程度加剧。但结果仍需大规模大样本试验证实。本研究不足之处,(1)样本量仍偏小,结果仍有待扩大样本量来证实。(2)由于技术原因,未能直接证实NNMT基因(rs694539)位点下游相关因子含量及其发生机制。(3)人群的其他生活习惯及环境因素控制欠佳。(4)仍需要进行更大样本量的前瞻性研究或相匹配的病例对照研究来进一步明确是否rs694539位点多态性与NAFLD发生风险相关,减少偏倚。将在后续研究中补足本研究欠缺之处。
综上所述,NNMT基因多态性与NAFLD发病具有一定的相关性,但这一结论有待于更大规模、包含更多调查变量的随机试验加以证明。
1 Kamada Y,Takehara T,Hayashi N.Adipocytokines and liver disease.J Gas troenterol,2008,43(11):811~822.
2 张亚丽,李伶,杨刚毅,等. Visfatin 基因表达下调对小鼠脂肪细胞及肝细胞脂代谢的影响. 中国老年学杂志,2013, 33(1): 77~79.
3 肖建新,陈雷. NNMT基因多态性与非酒精性脂肪性肝炎的相关性.临床肝胆病杂志,2013,29(12):909~913.
4 Souto JC, Blanco-Vaca F, Soria JM,et al. A genomewide exploration suggests a new candidate gene at chromosome 11q23 as the major determinant of plasma homocysteine levels: results from the GAIT project. Am J Hum Genet. 2005,76(6):925~933.
5 非酒精性脂肪性肝病诊疗指南.中华肝脏病杂志,2006,14(3):161~163.
6 Ali Sazci,Mavi Deniz Ozel, Emel Ergul, et al. Association of Nicotinamide-N-Methyltransferase Gene rs694539 Variant with Patients with Nonalcoholic Steatohepatitis. Genetic tesing and molecular biomarkers 2013,17(11):1~5.
7 Zhang L, Miyaki K, Araki J, et al. The relation between nicotinamide-N-methyltransferase gene polymorphism and plasma homocysteine concentration in healthy Japanese men. Thromb Res ,2007, 121:55~58.
8 An SA,Lee HB,Kim Y, et al. Plasma total homocysteine level is associated with the pulsatility index of cerebral arteries in lacunar infarction.Yonsei Med J,2013, 54( 4) : 819~824.
Objective The aim of this study was to investigate the possible role of nicotinamide-N-methyltransferase (NNMT) gene rs694539 variant in the development of NAFLD and visfatin. Methods We analyzed NAFLD patients and healthy controls using a polymerase chain reactionrestriction fragment length polymorphism (PCR-RFLP)method developed in our laboratory. ELISA technique was employed to determine the plasma visfatin concentration.Results The visfatin levels of NAFLD group were higher than control group (P<0.05).The NNMT rs694539 variant was found to be significantly associated with NAFLD. Logistic regression analysis of GG genotype and HCY levels were the protect factors, ALT and visfatin level for the risk factors. Follow-up period NNMT gene GG and AA genotype cumulative outcome have obvious differences between the Log Rank=5.460,P=0.019. Conclusion The rs694539 variant of NNMT gene is associated with NAFLD. NAFLD is associated with serum visfatin level, AA genotype increases the risk of deelopment and progression of NAFLD.
NNMT Gene Polymorphism Nonalcoholic Steatohepatitis visfatin
浙江省温州市科技计划项目(Y20140089;Y20130363)
325000 浙江温州 解放军第118医院消化内科



