颜也夫
2013年国际糖尿病联盟(IDF)发布数据表明,全球约3.82亿糖尿病患者,90%为2型糖尿病[1-2]。我国成人患病率为11.6%[3-4]。糖化血红蛋白(HbAlc)对T2DM的早期诊断和筛查起重要作用[5]。2010年,ADA推荐HbAlc≥6.5%为糖尿病的诊断切点;NHANES研究也证实,以OGTT标准为参照,HbAlc诊断糖尿病特异性高[6]。2013年《中国2型糖尿病防治指南》将HbAlc≥7.0%作为T2DM患者启动临床治疗的重要判断标准,建议HbAlc>9.0%的新发T2DM患者进行短期胰岛素强化治疗的标准。本文通过分析HbAlc水平与新发2型糖尿病患者糖代谢紊乱程度及胰岛功能的相关性,以期为临床T2DM患者治疗提供参考。
1 临床资料
1.1 一般资料 选取2015年1月至2016年9月本院T2DM患者220例,根据HbAlc水平将所有患者分为低糖化组(112例)与高糖化组(108例),低糖化组HbAlc≤9%,高糖化组HbAlc>9%。纳入标准:(1)所有患者均符合1999年WHO糖尿病诊断标准。(2)所有患者均为新发糖尿病患者,既往未服用降糖药。排除标准:(1)1型糖尿病和继发性糖尿病。(2)妊娠试验阳性患者。(3)急性代谢紊乱以及合并感染患者。(4)精神神经性疾病患者。两组患者性别、年龄及体重指数比较差异无统计学意义(P>0.05),具有可比性,见表1。

表1 两组患者的一般情况
1.2 方法 基本操作OGTT试验与INS试验:所有患者在试验前8h保持无任何热量摄入,于清晨空腹口服溶于250~300ml水内的无水葡萄糖粉75g,在5min内服完,从服第一口糖开始计时,于服糖前和服糖后30min、1h、2h、3h分别在前臂采静脉血测静脉血糖含量(G-30、G30、G60、G120、G180)和胰岛素含量(I-30、I30、I60、I120、I180)含量。功能评估 :(1)采用稳态模型评估胰岛β细胞分泌指数(HOMA-β)=20×I-30/(G-30-3.5)反映基础胰岛素分泌功能。(2)采用稳态模型评估胰岛素抵抗指数(HOMA-IR)=G-30×I-30/22.5。(3)采用Matsuda指数评估IS即总体胰岛素敏感指数(WBISI)=10000/[18×(G-30×I-30×平均血糖×平均胰岛素)1/2]。ΔI30/ΔG30=(I30-I-30)/(G30-G-30)反映早相胰岛素分泌指数。(4)服糖后60~120min胰岛素曲线下面积与血糖曲线下面积比值(AUCI60~120/G60~120)=[(I60+I120)/2+I60+I120]/[(G60+G120)/2+G60+G120]反映晚相胰岛素分泌功能。注:葡萄糖1mmol/L=18mg/dl。
1.4 统计学方法 采用SPSS23.0统计软件。计量资料用(x±s)表示,采用独立样本t检验;计数资料用χ2检验,用χ2检验,单因素相关分析采用Pearson相关分析法,多因素相关分析采用多元回线性回归分析,以P<0.05为差异有统计学意义。
2 结果
2.1 OGTT试验与INS试验结果比较 随着HbAlc的升高,低HbAlc组与高HbAlc相比较,G-30、G30、G60、G120、G180和胰岛素抵抗指数HOMA-IR、ΔI30/ΔG30逐渐升高(P<0.05),而 I-30、I60、I120、I180和胰岛 β 细胞分泌指数 HOMA-β、WBISI、AUCI60~120/G60~120则随着HbAlc的升高而逐渐降低(P<0.05);见表2、3、4。

表2 OGTT试验结果[mmol/L,(x±s)]

表3 INS试验结果[mIU/L,(x±s)]

表4 胰岛功能相关指数情况(x±s)
2.2 HbAlc与胰岛素相关指标的相关性分析 HbAlc与WBISI呈正相关,与HOMA-β、HOMA-IR、ΔI30/ΔG30、AUCI60~120/G60~120呈显着性负相关(P<0.05),见表5。

表5 HbAlc与胰岛素相关指标的相关性分析
2.3 HbAlc与胰岛素相关指标的多元线性回归分析 HOMA-β、HOMA-IR、ΔI30/ΔG30、AUCI60~120/G60~120为HbAlc的影响因素,标准化回归系数Beta分别为1.003、0.224、0.674、-2.378,差异有统计学意义(P<0.05),见表 6。
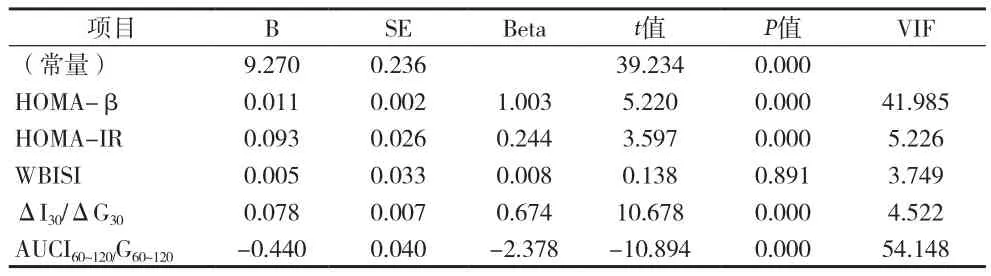
表6 HbAlc与胰岛素相关指标的多元线性回归分析
3 讨论
T2DM的重要发病机制之一是由于胰岛β细胞分泌功能损伤,导致血糖难以控制,且随着病情的逐步进展,血糖的逐渐升高,进一步加重胰岛β细胞分泌功能损伤,使病情更加恶化[7]。1999年英国糖尿病前瞻性研究(UKPDS)发现,糖尿病患者在最初诊断时胰岛功能已丧失50%左右,且以逐年下降的趋势,至诊断第六年时胰岛功能仅残留约30%左右[8]。胰岛功能的不可逆转性损伤导致血糖随病程的延长而逐渐恶化,而长期慢性高血糖导致多种糖尿病的慢性并发症的发生[9]。
HbAlc作为目前公认的判定糖尿病患者血糖控制水平具有较高价值的临床指标,是血液中红细胞内的血红蛋白与葡萄糖或其他糖的氨基发生非酶催化反应的产物,其量与血糖浓度呈正相关,反映患者近2~3个月平均血糖水平,其稳定性较强,不受某一次高血糖、低血糖、进食、抽血时间及外源性胰岛素应用等因素的影响[10]。UKPDS研究和糖尿病控制与并发症试验(DCCT)等大型临床试验确立HbAlc在血糖控制和预测DM并发症中的地位[8,11]。2010年ADA已将HbAlc纳入T2DM的诊断指标,美国、日本等国家将其正式列入T2DM的诊断标准,2010年《中国2型糖尿病防治指南》建议HbAlc<7.0%作为血糖控制达标目标。
本资料结果显示,随着HbAlc的升高,各组基础胰岛素及早、晚胰岛素分泌随HbAlc增加而下降,而胰岛素抵抗指数则随HbAlc的升高而增加。表明胰岛细胞分泌功能随血糖代谢紊乱加重而恶化,这在HbAlc≥9.0患者者中表现更明显。早相胰岛素分泌障碍使肝糖原输出增多,导致餐后血糖升高,与新发T2DM患者血糖波动及变异相关。因此,对于高HbAlc患者,应尽早采取恢复或促进早相胰岛素分泌治疗,以降低餐后血糖,并减少糖尿病慢性并发症发生风险;晚相胰岛素分泌逐渐下降,使机体处理餐后高血糖的能力进一步下降。而早相和晚相胰岛素分泌障碍提示,血糖代谢紊乱程度越重,这在HbAlc≥9.0更为明显,因此对于HbAlc≥9.0的新发T2DM患者应尽早启动胰岛素强化治疗。
综上所述,随着HbAlc的升高,新发T2DM患者胰岛β细胞分泌功能逐渐下降,而胰岛素敏感性及抵抗指数则逐渐增加,对于新发T2DM患者应根据不同HbAlc水平采取不同的治疗措施,以促进和恢复胰岛β细胞分泌功能,延缓糖尿病并发症的发生。本研究由于样本量较小,统计结果可能存在一定偏倚,有待更大规模的相关临床研究验证。
[1] 李学永. 中国成人的心血管健康状况. 中国循证心血管医学杂志, 2015, 7(3):306-306.
[2] Patel BD, Ghate MD. ChemInform Abstract: Recent Approaches to Medicinal Chemistry and Therapeutic Potential of Dipeptidyl Peptidase-4 (DPP-4) Inhibitors. European Journal of Medicinal Chemistry, 2014, 74(20):574-605.
[3] 中华医学会糖尿病学分会.中国2型糖尿病防治指南(2013年版). 中华内分泌代谢杂志, 2014, 30(10):26-89.
[4] Xu Y, Wang L, He J, et al. Prevalence and Control of Diabetes in Chinese Adults. Jama the Journal of the American Medical Association, 2013, 310(9):948-59.
[5] Sarmah D. Importance and Status of HBA1C in T2DM and its Indian Perspective. Asian Journal of Biomedical & Pharmaceutical Sciences, 2012, 2(12):1-10.
[6] 周健, 庞璨, 包玉倩,等. 糖化血红蛋白诊断糖尿病的关键问题:诊断切点及与糖尿病筛查和预防.中国糖尿病杂志,2014, 6(12):845-848.
[7] Kabadi UM, Kabadi MU, Weber S, et al. Progressive β Cell Failure in Type 2 Diabetes Mellitus: Microvascular Pancreatic Isletopathy?Journal of Diabetes Mellitus, 2015, 5(1):21-27.
[8] Good C B. The UK Prospective Diabetes study. Lancet, 1999,352(9144):1933.
[9] Zia A, Bhatti A, Jalil F, et al. Prevalence of type 2 diabetesassociated complications in Pakistan. International Journal of Diabetes in Developing Countries, 2015, 36(2):1-10.
[10] Sarmah D. Importance and Status of HbAlc in T2DM and its Indian Perspective. Asian Journal of Biomedical & Pharmaceutical Sciences, 2012(12):1-10.
[11] Diabetes control and complications trial . Henry Ford Hospital Medical Journal, 1983, 31(2):115-116.
[12] Lavoie S, Steullet P, Kulak A, et al. Glutamate Cysteine Ligase-Modulatory Subunit Knockout Mouse Shows Normal Insulin Sensitivity but Reduced Liver Glycogen Storage. Frontiers in Physiology, 2016, 7(142):1-8.



