徐雷 齐江彤 陈伟良
急性缺血性卒中(AIS)是最常见的卒中类型,占全部卒中发病的60%~80%,具有高发病率、致残率及病死率等特点[1]。AIS中的早期神经系统恶化(END)也称进展性卒中,指疾病在早期阶段症状的持续进展和神经功能损伤的逐渐恶化。不同研究报道的缺血性卒中END发生率差异较大,介于10%~40%[2]。其差异性包含多方面的因素,如AIS后初始评价时间、END的诊断标准不同等客观因素;另外,缺血性卒中存在不同亚型,各种亚型的病因及机制不同也造成END发生率不同。本文对不同CISS分型AIS患者早期神经功能恶化相关影响因素进行分析,探讨影响END发生可能的相关危险因素,为其临床诊治提供依据。
1 资料与方法
1.1 临床资料 选择2016年1月至2018年12月本院收治的AIS患者299例,符合中华神经科学会1996年制定的脑卒中诊断标准[3],并经头颅核磁共振检查诊断证实。其中男197例,女102例。(1)纳入标准:①符合脑卒中的诊断标准;②选择发病<24 h入院。若患者晨醒发现症状,以夜间入睡时间作为起病时间;③入院期间完成头颅MRI、头颅CTA、颈动脉彩超、动态心电图、心脏彩超、血糖、甘油三酯、高密度胆固醇、低密度胆固醇等检查。(2)排除标准:①合并严重心、肝、肾功能不全;②脑卒中合并出血;③有精神疾病患者。
1.2 方法 收集入组患者一般情况,包括患者性别、年龄、体重、入院时收缩压、入院时舒张压、既往史(吸烟、酗酒、房颤、高血压病、糖尿病);实验室检查:空腹血糖、低密度胆固醇、高密度胆固醇、甘油三酯;辅助检查:头颅MRI、头颅 CTA、动态心电图、心脏彩超、颈动脉彩超等。所有入组患者入院及入院前3d每天行NIHSS评分(如病情变化随时进行NIHSS评分)。根据入院后NIHSS评分变化分为END组和非END组(END诊断标准:AIS患者发病72h内NIHSS评分增加≥ 3分[4])。其中 END组 90例(30.1%),非 END组209例(69.9%);根据临床资料对END组按CISS分型进一步分组:大动脉粥样硬化型(LAA)42例(46.7%)、心源性卒中(CS)22例(24.4%)、穿支动脉型(PAD)18例(20%)、其他原因型(OE)3例、不明原因型(UE)5例。
1.3 统计学方法 采用SPSS 24.0统计软件。计量资料以()表示,采用独立样本t检验;计数资料采用χ2检验。多因素分析采用Logistic回归分析。以P<0.05为差异有统计学意义。
2 结果
2.1 影响END发生的相关危险因素分析 299例AIS患者中,END患者90例,非END患者209例;两组间年龄、性别、体重、饮酒、吸烟、入院收缩压、入院舒张压、空腹血糖、甘油三酯、高密度胆固醇差异均无统计学意义;两组间高血压病、糖尿病、入院时NIHSS评分、颈动脉狭窄、房颤、低密度胆固醇比较差异均有统计学意义(见表1)。多因素Logistic回归分析,以早期患者神经功能恶化为应变量(是为1,其余为0),以高血压病、糖尿病、入院时NIHSS评分、颈动脉狭窄≥50%、房颤、低密度胆固醇为自变量,将单因素模型中显着的变量纳入多因素Logistic回归分析,结果显示糖尿病、入院时NIHSS评分、颈动脉狭窄≥50%、房颤、低密度胆固醇是独立危险因素(见表 2)。
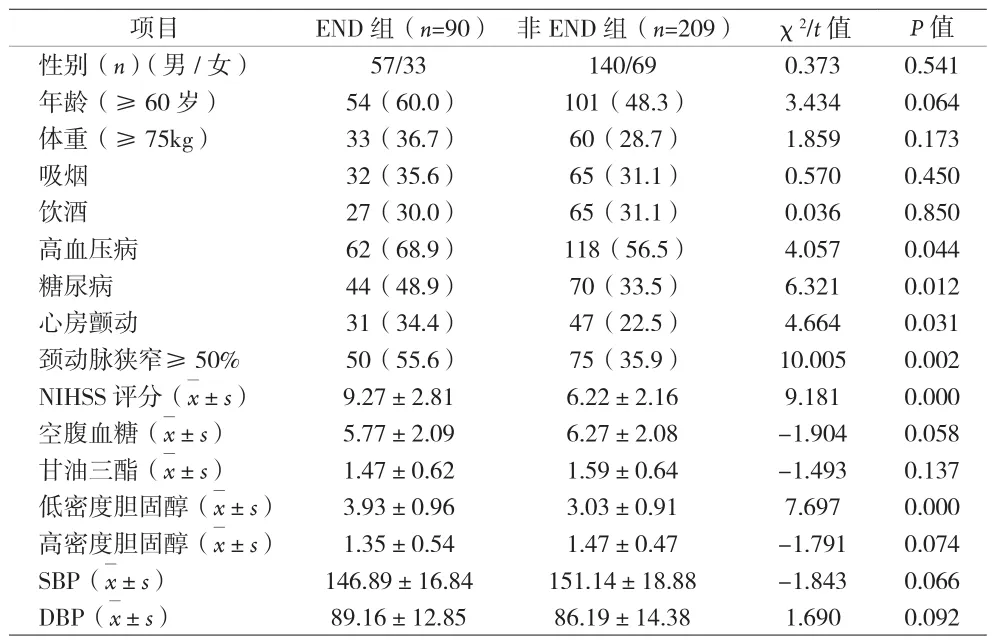
表1 END患者发病风险单因素分析[n(%)]
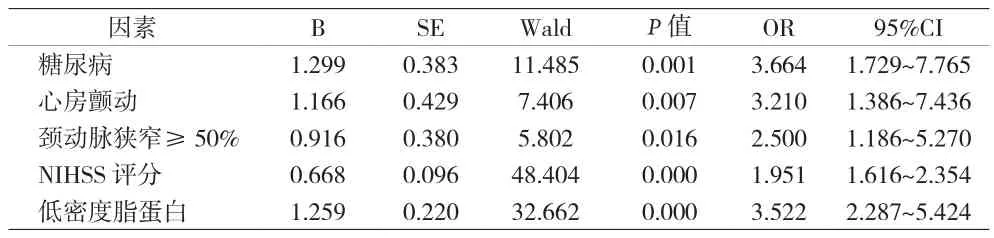
表2 END患者发病风险多因素分析
2.2 CISS分型的END危险因素分析 99例END患者,大动脉粥样硬化型(LAA)42例(46.7%)、心源性卒中(CS)22例(24.4%)、穿支动脉型(PAD)18例(20%)、其他原因型(OE)3例、不明原因型(UE)5例;对入组患者CISS分型的危险因素进行统计学分析(UE、OE组样本量过少不做统计),结果显示:LAA组发生比例最高(46.7%);房颤、NIHSS评分在CS组占比最大;低密度胆固醇、颈动脉狭窄≥50%在LAA组发生比例最大;糖尿病在PAD组比例最大(见表3)。
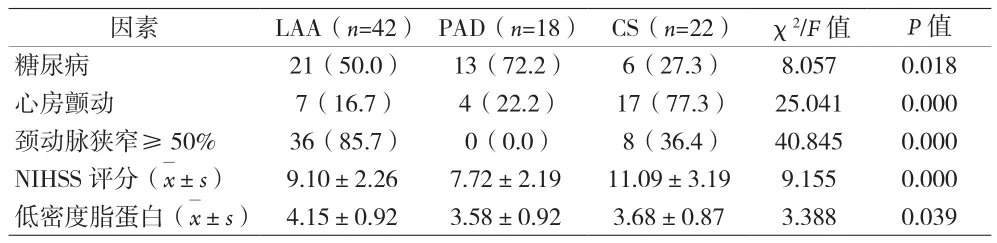
表3 CISS分型间危险因素差异性分析[n(%)]
3 讨论
END具有发病率高、危害程度大的特点,其发生机制比较复杂,临床研究已有很多报道。目前较广泛认为,END可能与以下几种机制有关:(1)侧支循环不良;(2)脑水肿;(3)卒中复发;(4)梗塞后出血性转化;(5)癫痫发作、(6)早期治疗不当。其中侧支循环形成不良可影响缺血半暗带代谢,使缺血半暗带体积增大,似乎是END最主要的机制[5]。本组AIS患者299例,90例住院3d内发生EDN,END发生率为30.1%,与以往报道相符。
本资料结果表明,糖尿病是END的独立危险因素(OR 3.664,95%CI,1.729~7.765),并在 PAD 组发生比例最大,这与国内外的多项研究相符。既往Megherbi等研究报道,与无糖尿病病史的AIS患者比较,存在糖尿病病史的AIS患者出现更严重的症状和体征,以及相对较大的神经功能缺损[6]。另有研究指出糖尿病病史是AIS患者病情恶化发展为END的独立危险因素[7]。其原因考虑糖尿病患者自身大小血管调节功能明显降低且侧支循环不足,一旦发生AIS,患者病变部位脑组织无充分血供,无氧代谢增加,进而使缺血脑组织内乳酸堆积、血脑屏障破坏;而且糖尿病患者本身的高血糖对缺血性脑组织就有毒性作用,易促使脑组织肿胀,加重脑组织的损害,导致神经功能缺损。
本资料结果表明,低密度胆固醇、颈动脉狭窄≥50%是END的独立危险因素,并在LAA组发生比例最大。颈动脉狭窄其可能机制在于:颈动脉狭窄后,大脑血液供应不足,远端脑血管处于低灌流状态[8]。当血管轻度狭窄时,机体可以自身调节保证大脑组织的供血量。当血管狭窄逐渐加重时,末梢灌注压就会不断下降,脑组织的供血量得不到正常供应,导致AIS发生,出现神经缺血症状;而发生END患者的梗死部位多发生在侧脑室体旁、分水岭区[9],是侧支循环不足的区域,颈动脉的严重狭窄造成远端灌注压偏低,使缺血灶周边的半暗带扩大,梗死范围加大,导致END发生。而脂代谢异常与颈动脉狭窄的发生发展存在密切联系。其中低密度胆固醇(LDL-C)被证实与颈动脉狭窄病变发生发展关联最为紧密[10]。LDL-C在其它高危因素诱导下形成并释放入血大量氧自由基,对动脉血管内皮具有一定的毒性作用,而且诸多细胞因子对其刺激下导致动脉局部形成硬化斑块,加重动脉血管狭窄程度[11],进而间接增大AIS患者END的发生。
本资料结果表明,房颤、入院NIHSS评分是END的独立危险因素。房颤END发生(OR 3.210,95%CI1.386~7.436),并在CS组发生比例最大,这与Lamassa等[12]研究相一致。其原因考虑为脑栓塞的发生均是即刻发生的,因此在栓塞发生前,脑组织未形成新生血管的时间,侧支循环建立不充分,使缺血性脑组织范围持续扩大,导致症状进行性加重;且附壁的血栓易在血流的冲击下反复脱落,使更多的脑动脉出现栓塞,导致END的发生。CS组中入院NIHSS评分为END的独立危险因素(OR 1.951,95%CI,1.616~2.354);其原因考虑为高NIHSS评分本身意味着患者病情重,梗塞面积大,而房颤等心源性栓塞多形成体积较大附壁血栓,栓子的大小决定房颤所栓塞的脑血管常均较大,造成大面积脑栓塞,而大范围的脑栓塞势必出现大范围的脑细胞水肿,严重脑细胞水肿加重脑功能受损,导致神经缺损症状进一步加重,出现END;这与Karepov等[13]研究相一致。
综上所述,AIS患者中END发生的原因多种多样,对END患者进行病因分型,进而对不同类型所存在的不同危险因素进行有针对性的早期干预,有利于减少AIS患者END的发生,进而改善预后。本文样本数量及观察指标有限,降低结论的可靠性,需今后工作中更多的研究证实。



