张美珍 李登云 胡丹兰
肺癌的发病率在所有恶性肿瘤中占比较高,且逐年增长[1-2],其中大多数属于非小细胞肺癌。探讨肺癌发病的相关机制与寻求有效、合适的治疗药物,向来是一项重大课题。大黄素(EM)是从大黄类植物中提取的有效活性成分,研究发现其对淋巴肉癌和肺癌等具有抑制作用,是具有很高药用性的生物抑制剂[3-5]。细胞外调节蛋白激酶1/2(ERK1/2)是细胞中信号传导的关键蛋白,M2型丙酮酸脱氢酶(PKM2)是ERK1/2的下游调控因子,在肿瘤相关蛋白P53的表达中发挥重要作用,而P53可以有效促进肿瘤细胞的凋亡。本研究旨在观察大黄素对肺癌细胞中ERK1/2-PKM2/P53信号通道的影响,为肺癌的临床治疗提供新的科学思路。
1 材料与方法
1.1 材料及仪器 人体非小细胞肺癌细胞(ATCC);大黄素(CAS:32507-66-7;纯度>97%,上海同田生物技术有限公司);DMEM培养基(高糖型)(CAS:HL12049.1,上海哈灵生物技术有限公司);标准胎牛血清(CAS:16000-044,Gibco);青链霉素(CAS:P1400,纯度:98%,贵州赛兰博科技有限公司);MTT粉剂(CAS:298-93-1,上海吉凯基因科技有限公司);细胞计数试剂盒(CAS:ZP328,Genview);transwell小室(CAS:3415,Corning Life Sciences)二甲基亚砜(CAS:67-68-5,aladdin);膜联蛋白APC(CAS:KA3808,上海哈灵生物技术有限公司);细胞凋亡检测试剂盒(CAS:40302ES20,Merck);酶标仪(CAS:Multiskan FC,赛默飞);流式细胞仪(CAS:AttuneNxT,赛默飞);荧光定量PCR(CAS:PikoReal,BIO-RAD);Western湿电转膜仪(Trans-Blot-cell)。
1.2 实验方法 (1)细胞培养:将肺腺癌细胞制成悬液,之后置于胎牛血清培养基中,在37 ℃、5% CO2的孵箱中培养。(2)分组:将培养好的细胞分为药剂组和溶剂组。其中,药剂组按加入大黄素浓度的不同分为药剂A组(大黄素浓度50 μg/ml)、药剂B组(大黄素浓 100 μg/ml)、药剂 C 组(大黄素浓度 150 μg/ml)、药剂D组(大黄素浓度200 μg/ml);溶剂组加入等量不含大黄素的溶剂(大黄素浓度0 μg/ml)。(3)MMT实验:取对数期细胞,稀释成3×104个/ml,接种于孔板,每孔100 μl。以培养液为空白对照,溶剂组和药剂组各亚组均设5个复孔,在设定好参数的培养箱中培养48 h之后,每孔加入20 μl MTT,等待4 h后吸出上清,每孔加150 μl二甲基亚砜,震荡,处理好样品后将流式细胞仪波长设定为490 nm进行测定,计算细胞的抑制率。(4)Transwell 细胞侵袭实验:取稀释的人工基质胶l25 μl加入transwell板上室,使胶覆盖整个聚碳酸酯膜,然后在设定好参数的培养箱中放置,使人工基质胶聚合;取对数期待测细胞,调整浓度为2×105个/ml,上室接种处理后肺癌细胞悬液,下室用初始的培养基做趋化因子;将细胞分组并置于设置好参数的培养箱中培养24 h,然后用工具擦去凝胶和膜上表面的细胞,处理完毕后进行细胞固定,结晶紫染色20 min,再使用PBS清洗多次;显微镜下计数,选取四周和中间5个方向随机范围内的细胞数,计算取平均值。(5)检测细胞凋亡实验:取对数期肺癌细胞,接种到6孔板中,每孔约2×105个细胞,置于设置好参数的培养箱中,根据细胞分组按照检测试剂盒提供的操作步骤分别处理,继续培养48 h,使用流式细胞仪检测凋亡情况,计算结果。(6)Western blot蛋白检测实验:将肺癌细胞分为溶剂组和药剂A、B、C、D四组,培养48 h,之后进行蛋白提取和蛋白定量。将样品放在沸水中加热至蛋白完全变性,拿出冷却至室温,进行电泳与转膜,转膜后进行封闭及免疫杂交,清洗好的膜用封闭缓冲液常温封闭1 h,用洗膜液3次,一抗4 ℃孵育,过夜,洗膜,二抗常温下孵育1 h,洗膜,处理完毕后,用化学发光法进行显影处理,拍照,采用ImageJ软件对实验所得条带进行定量分析,计算结果。
1.3 统计学方法 采用SPSS 21.0统计软件。计量资料以()表示,两两比较采用LSD-t法,多组比较采用单向方差分析。以P<0.05为差异有统计学意义。
2 结果
2.1 各组MMT实验结果比较 随着大黄素浓度的增加,肺癌细胞的抑制率明显增加,呈浓度依赖性(P<0.05)。见表 1、图 1。
表1 各组MMT实验结果比较(n=5)

图1 大黄素浓度与抑制率变化折线图
2.2 各组肺癌细胞侵袭能力比较 药剂组侵袭细胞的数量明显低于溶剂组,药剂组大黄素浓度与侵袭细胞数呈负相关(P<0.05)。见表2、图 2。
表2 肺癌细胞侵袭能力比较(n=5)
图2 transwell实验肺癌细胞结晶紫染色
2.3 各组细胞凋亡水平比较 药剂四组肺癌细胞的凋亡率高于溶剂组,大黄素浓度与凋亡率呈正相关(P<0.05)。见表 3、图 3。

表3 细胞凋亡水平比较(n=5)
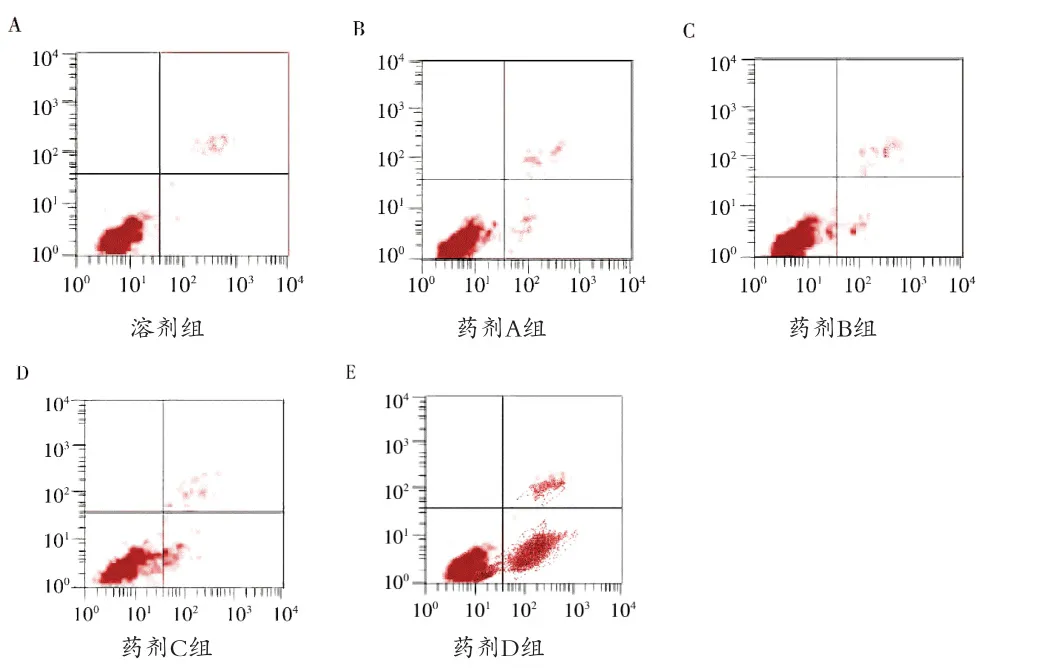
图3 各组肺癌细胞细胞凋亡图
2.4 Western blot实验结果 药剂组各组ERK1/2、PKM2蛋白的表达水平更低,P53蛋白的表达水平更高;大黄素浓度与ERK1/2、PKM2蛋白的表达呈负相关(P<0.05),与P53蛋白的表达呈正相关(P<0.05)。见表4、图4。
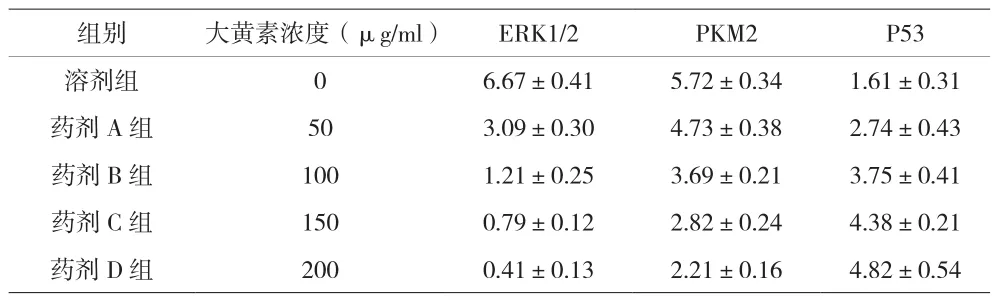
表4 各组蛋白表达水平比较(n=5)
图4 各组蛋白表达水平
3 讨论
正常情况下,细胞的增殖受其自身限制,且侵袭转移能力较差,通过细胞凋亡维持正常细胞内环境的稳定[6]。而肿瘤细胞的细胞分裂不受约束,侵袭与转移能力急速增强,细胞异常活跃,凋亡因子明显受到抑制,导致肿瘤细胞难以控制[7]。常见抗肿瘤药的作用机制有以下几种:①干扰核酸进行生物合成;②破坏DNA结构和功能;③嵌入DNA中干扰转录过程;④干扰影响蛋白质合成;⑤调节体内激素产生抑制作用。抗肿瘤药通过以上机制抑制肿瘤细胞的作用无差别,同时均能较大程度地损害正常细胞。大黄素是一种从自然植物中提取的蒽醌类化合物,通过嵌入干扰和生物还原等作用机制,对肿瘤细胞具有较高的特异性,且本身毒性较低,对正常细胞影响很低。大黄素吸收进入人体后,约一半剂量去向不明,在肌肉组织及脂肪中均未能检出,可能与它在体内的脂溶性相关,在肝组织中的剂量远远多于其他体内组织,排泄量为吸入剂量的2.7%,主要由粪便排出。所以,大黄素的浓度与剂量在体内的代谢转化、吸收排泄均有据可依,通过调整大黄素的浓度与剂量,有助于个体差异性的临床治疗。
ERK1/2位于RAS/RAF/MEK/ERK通路下游,当RAS/RAF/MEK/ERK通路发生异常时,细胞的正常功能会出现障碍,甚至发生癌变。作为RAS/RAF/MEK/ERK通路下游的“最终管理器”,靶向抑制ERK1/2有望用于治疗通路异常激活造成的癌变,对于产生RAF或MEK抑制剂耐药的患者也可能有效。ERK1/2信号途径可被多种刺激因子激活,与细胞的周期活动密切相关[8-10],磷酸化是其发挥生理功效的关键[11-12]。相关实验研究发现,加入抑制ERK1/2活化后,细胞中原癌基因的表达会相应减少,通过调控ERK1/2可有效减少细胞的癌变[13-14]。PKM2和P53是ERK1/2通路的下游调控因子,PKM2可促进肿瘤细胞的活跃[15],P53有助于细胞凋亡,进而抑制肿瘤细胞[16-17]。
本研究结果表明,药剂组中肺癌细胞的增殖能力与溶剂组相比均降低,细胞侵袭能力明显下降,细胞凋亡率增加,且效果和大黄素浓度明显相关,说明大黄素可以有效抑制肺癌细胞的增殖能力。在分子水平上,药剂组肺癌细胞中ERK1/2和PKM2蛋白的表达低少于溶剂组,且与大黄素浓度相关,说明大黄素可以抑制ERK1/2-PKM2信号通路,降低ERK1/2的磷酸化,降低PKM2蛋白的表达,浓度越高则作用效果越明显,提示大黄素的作用靶点是ERK1/2、PKM2信号通路。同时,大黄素会促进肺癌细胞中P53的高表达,表达水平和大黄素浓度呈正相关,说明大黄素可通过诱导P53高表达促进肺癌细胞的凋亡。
综上,大黄素可以有效抑制肺癌细胞的增值、侵袭,促使肺癌细胞凋亡。其作用机制可能是抑制ERK1/2的磷酸化,阻断ERK1/2-PKM2信号通路,诱导P53表达,最终达到抑制肺癌细胞的目的。不过,本研究仅探讨了大黄素的体外抗肿瘤作用机制,作用效果未与同类型药物进行比较,大黄素及其衍生药物能否成为治疗非小细胞肺癌的特效药,还需要更多的对比研究、动物及人体试验进一步验证。



