吕望 王胜男 潘克跃 朱鹏 姜盈盈 叶渊文
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD),简称慢阻肺,以持续性气流受限为特征。随着病情恶化,COPD可发展为慢性阻塞性肺疾病急性加重(acute exacerbation chronic obstructive pulmonary disease,AECOPD),表现为呼吸困难加重、咳嗽加剧、痰量增多,此时患者需要改变用药方案并增加治疗措施[1]。COPD患者每年约发生0.5~3.5次急性加重,是COPD患者死亡的重要因素[2]。有研究显示,AECOPD患者存在外周血淋巴细胞功能紊乱,NK细胞也参与炎症反应[3]。CD8+淋巴细胞和活化的NK细胞在吸烟的COPD患者中比例明显增高[4-5],但是NK细胞在COPD的病理过程中的作用仍不清晰[6]。本研究分析AECOPD患者外周血中NK细胞激活受体基因(NKG2D)和抑制受体基因(NKG2A)的表达,探讨NK细胞活化状态的临床相关性,以期为病情的研判提供实验基础,现报道如下。
1 资料与方法
1.1 临床资料 外周血标本收集于本院2020年1月至2021年12月急诊住院患者,研究病例符合《AECOPD诊治中国专家共识(2017年更新版)》[2]诊断标准,AECOPD患者30例,中位年龄57岁,其中男18例,女12例。COPD患者30例,中位年龄55岁,其中男17例,女13例。选择健康志愿者20人,中位年龄54岁,其中男12例,女8例。本研究经温州市人民医院临床伦理委员会批准,所有入选者均签署知情同意书。RNA提取试剂、逆转录试剂盒和SYBR Green试剂盒购于上海翌圣公司;荧光定量PCR仪购于美国BioRad公司。
1.2 检测方法 (1)单个核细胞中NKG2D和NKG2A基因mRNA的表达量检测:淋巴细胞分离液收集单个核细胞,PBS清洗后加入TRizol试剂和三氯甲烷,高速离心后取上清液;加入同体积异丙醇高速离心后去上清液,加入无水乙醇清洗,自然晾干;加入RNase水溶解,测定RNA浓度和纯度;按照逆转录试剂盒说明书,各组加入相同含量的RNA进行逆转录反应;按照SYBR Green试剂说明书,荧光定量PCR扩增NKG2D和NKG2A基因,用2-△△Ct计算各基因的相对定量表达水平。扩增引物序列如下:β-actin-F:5'-GCATCCTCACCCTGAAGTA-3',β-actin-R :5'-GAGGTAGTCAGTCAGGTCC-3',NKG2D-F :5'-TTGATGGGGTGGATTCGTGG-'3,NKG2D-R:5'-TGCTTTTGCCATCGTGTTGA-3',NKG2A-F :5'-AGAAAGCACGTCATTGTGGC-3',NKG2A-R:5'-GCCAGCAAACTCTCTTCCCA-3'。(2)肺功能检测:所有患者入院后均检测第1秒用力呼气容积(FEV1)、第1秒用力肺活量占预计值百分比(FEV1%)、用力肺活量(FVC)和第1秒用力呼气容积/用力肺活量比值(FEV1/FVC)肺功能指标,患者检查前避免剧烈运动。(3)动脉血气分析:患者入院治疗前,于桡动脉或股动脉处抽取2 mL动脉血,肝素抗凝,应用全自动血气分析仪分别检测动脉血氧分压(PaO2)和二氧化碳分压(PaCO2)。
1.3 统计学方法 采用GraphPad Prism9统计软件。计量资料符合正态分布以()表示,采用t检验;相关性采用Pearson相关性分析,以P<0.05为差异有统计学意义。
2 结果
2.1 三组外周血NKG2D基因和NKG2A基因的表达水平比较 荧光定量PCR实验结果显示,AECOPD组中NKG2D基因表达水平高于对照组和COPD组,COPD组中的表达水平也高于对照组,差异有统计学意义(P<0.05);AECOPD组和COPD组中NKG2A基因的表达水平均低于对照组,差异有统计学意义(P<0.05)。AECOPD组中NKG2A基因的表达水平低于COPD组,差异无统计学意义(P>0.05),见表1。
表1 三组外周血NKG2D基因和NKG2A基因的表达水平比较()
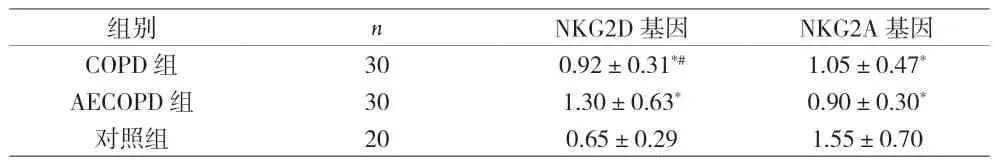
表1 三组外周血NKG2D基因和NKG2A基因的表达水平比较()
注:与对照组比较,*P<0.05,与AECOPD组比较,#P<0.05
组别 n NKG2D基因 NKG2A基因COPD 组 30 0.92±0.31*# 1.05±0.47*AECOPD 组 30 1.30±0.63* 0.90±0.30*对照组 20 0.65±0.29 1.55±0.70
2.2 两组患者肺功能和动脉血气的比较 对两组患者的肺功能和动脉血气分析结果显示,AECOPD组中的FEV1%、FEV1/FVC和PaO2明显低于COPD组(P<0.001),而PaCO2高于COPD组(P<0.05),差异有统计学意义,见表2。
表2 两组患者肺功能和动脉血气的比较()
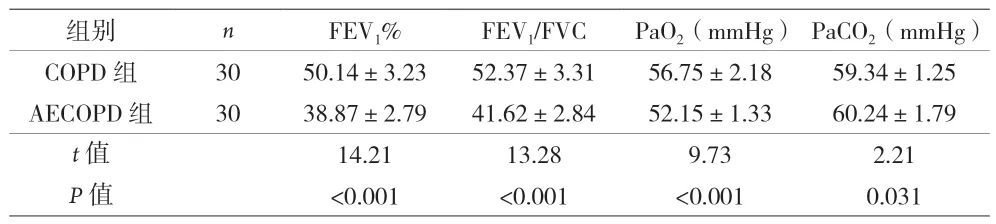
表2 两组患者肺功能和动脉血气的比较()
组别 n FEV1% FEV1/FVC PaO2(mmHg) PaCO2(mmHg)COPD 组 30 50.14±3.23 52.37±3.31 56.75±2.18 59.34±1.25 AECOPD 组 30 38.87±2.79 41.62±2.84 52.15±1.33 60.24±1.79 t值 14.21 13.28 9.73 2.21 P值 <0.001 <0.001 <0.001 0.031
2.3 NKG2D和NKG2A基因的表达与肺功能的相关性分析 经Pearson相关性分析显示,COPD和AECOPD组患者外周血NKG2D基因的表达水平与FEV1%和FEV1/FVC均呈明显负相关(P<0.05);NKG2A基因的表达水平与FEV1%和FEV1/FVC均呈明显正相关(P<0.01),见图1。
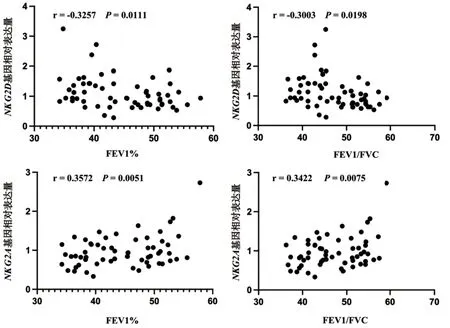
图1 COPD和AECOPD患者外周血中NKG2D和NKG2A基因与肺功能的相关性分析
2.4 NKG2D和NKG2A基因的表达与动脉血气的相关性分析 经Pearson相关性分析显示,COPD和AECOPD组患者外周血NKG2D基因的表达水平与PaO2均呈负相关(P<0.05),NKG2A基因的表达水平与PaO2均呈正相关,但是与PaCO2均不具有相关性(P>0.05),见图2。
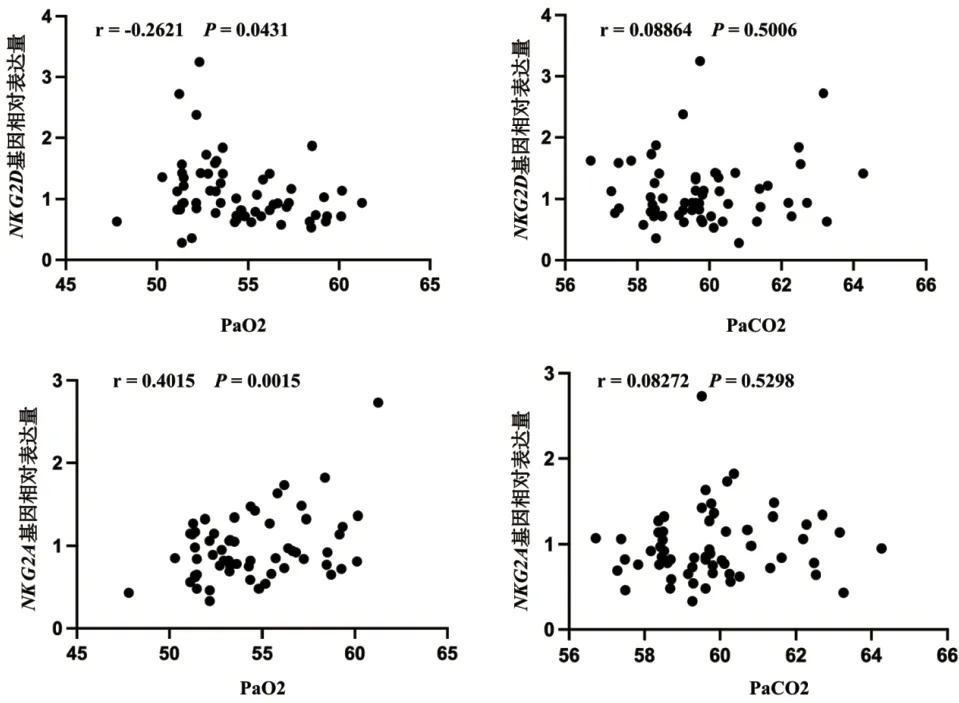
图2 COPD和AECOPD患者外周血中NKG2D和NKG2A基因与动脉血气的相关性分析
3 讨论
COPD是一种常见的慢性气道疾病,发病率很高。AECOPD是一个重要的危险因素,可能导致病情恶化,肺功能显着降低,部分原因是气道和全身炎症增加[7]。AECOPD患者常出现呼吸急促、咳嗽加剧、黏液分泌过多等急性恶化症状。AECOPD的诱因,可能是细菌或病毒感染,或吸入环境颗粒物引起气道黏膜水肿、平滑肌痉挛和分泌物增加所致[8]。
NK细胞的功能是由激活受体和抑制受体紧密控制的。在激活受体中,NKG2D(Klrk1)几乎在所有的NK细胞上表达,可识别应激和感染相关配体,并能克服抑制信号,激发细胞毒性和细胞因子的释放[9-10]。有研究发现,病毒和细菌感染、慢性炎症和香烟烟雾暴露均可诱导受损上皮细胞迅速表达NKG2D配体,作为NKG2D配体调节的关键因素[11]。在本研究中,COPD组和AECOPD组中NKG2D表达水平均明显高于对照组,AECOPD组表达水平高于COPD组,提示NKG2D表达与COPD疾病的发生和发展有关。本研究结果显示,抑制受体NKG2A基因的表达在COPD和AECOPD组中均表达下调,而且AECOPD组低于COPD组。有文献报道COPD组的NKG2A+细胞比例低于对照组,但是与疾病的严重程度、吸烟情况和加重频率无相关性[12]。也有文献报道NK细胞抑制受体CD158a+和CD158b+在吸烟和COPD加重患者中表达下调,而且CD158b+NK细胞比例与FEV1%和FEV1/FVC呈负相关性[13]。但是本研究结果显示NKG2A基因的表达水平与FEV1%、FEV1/FVC和PaO2均呈正相关。FREEMAN等[14]的研究结果显示,COPD患者肺上皮细胞中NKG2D配体MICA和MICB的表达上调,并且与FEV1%呈负相关性。本研究结果显示NKG2D基因的表达水平与FEV1%、FEV1/FVC和PaO2均呈明显负相关,提示NKG2D基因的表达与患者肺功能下降有关。杨东升等[3]研究表明COPD急性加重期患者存在明显的淋巴细胞免疫功能紊乱,患者呼吸衰竭时CD3-CD56+NK细胞比例升高,并且参与了COPD的炎症反应过程。
作为天然免疫细胞,NK细胞被认为是人体抵抗感染和肿瘤的第一道防线。尽管现有研究表明NK细胞可能在COPD及其恶化中发挥关键作用,但在NK细胞数量、激活和抑制受体表达、细胞功能等方面的报道仍存在差异,这可能与不同疾病进展阶段有关[15]。本研究结果提示NK细胞激活受体NKG2D基因的表达与COPD疾病进展以及患者肺功能相关,可能是活化的NK细胞参与了肺部组织损伤的病理过程。尽管到目前为止,NK细胞在AECOPD中的作用仍然没有得到充分认识,深入研究有望更好理解与感染相关的急性加重和疾病恶化的免疫机制,以期为COPD和AECOPD的临床治疗提供新的思路。



