徐琛 周一波 陈傅华 陈江涛
目前临床仍以腹部超声作为肝脏疾病,如肝炎、肝硬化和肝癌诊疗的首选工具,常规多普勒超声对较大直径>2 cm 肝脏结节良恶性质判断有较好准确性,彩色血流频谱能够识别结节内的血流信号,提高恶性结节的特异性[1]。但肝硬化背景易干扰回声信号,降低超声对直径≤2 cm 肝脏恶性结节的敏感性[2]。丰富的血供是结节恶性增殖的重要条件,超声造影(contrast-enhanced ultrasound,CEUS)能够对肝脏多期增强扫描,实时观察血流灌注,利用时间-增强曲线获得多个定量参数,定性和定量评估结节的恶性程度[3-4]。根据CEUS 典型征象制定肝脏影像报告和数据管理系统(liver image report and data management system,LI-RADS),并将LR-5 判断为肝细胞癌和LR-M 为其他恶性肿瘤[5]。目前,我国尚缺乏关于CEUS LI-RADS 分类对肝硬化伴直径<2 cm 肝脏结节良恶性质鉴别诊断临床报道。报道如下。
1 资料与方法
1.1 临床资料 回顾性分析2019 年7 月至2022 年7月本院诊断肝硬化伴最大直径≤2 cm 的肝脏单发实性结节患者142 例。纳入标准:①年龄>18 岁;②肝脏超声、CT 检查确定肝硬化、肝脏单发实性结节最大直径≤2 cm;③肝脏穿刺活检或手术后取得明确病理诊断;④ CEUS 图像清晰。⑤患者签署知情同意书。排除标准:①穿刺活检获得的病理诊断不明确;②结节最大直径>2 cm;③严重肝硬化并发症、严重心肺肾功能衰竭;④先天性肝纤维化所致的肝硬化。
1.2 方法 (1)收集资料:记录患者一般资料包括性别、年龄、饮酒、高血压、糖尿病和高脂血症、肝硬化病程、乙型肝炎和丙型肝炎及病毒载量;血生化包括空腹血糖、总胆固醇和低密度脂蛋白胆固醇(LDL-C)、谷丙转氨酶、总胆红素、乳酸脱氢酶、血肌酐和尿素氮以及白蛋白。采用常规多普勒超声和CEUS 评估结节位置、大小、增强程度及模式、廓清及廓清时间。经肝脏穿刺活检及手术病理确诊恶性67 例(肝细胞癌57例、其他恶性肿瘤10 例)和良性75 例。(2)超声检查方法:采用Mindray Resona 7 彩色多普勒超声诊断仪,SC5-1U 凸阵探头,频率为1~6 MHz,配备超声造影成像及分析软件,造影剂采用声诺维(意大利Bracco 公司)。患者取平卧位,调节仪器参数适当加压探头获得肝脏清晰二维切面,记录结节位置、大小、回声强度和血流信号。然后转换至CEUS 界面,经肘静脉注射1.2~2.4 mL 造影剂,同时启动CEUS 双幅模式,实时、动态扫描4~6 min,存储动态图像。由2 名接受过超声造影专业培训且具备独立分析能力的超声医师分析图像。动脉期显着增强定义为整体或部分增强,非环状或周边不连续的结节状增强[5]。廓清定义为门静脉期或延迟期低增强,增强程度低于周围肝实质[5]。根据廓清时间分为“早期廓清”(注射造影剂后60 s 内廓清)和“延迟廓清”(注射造影剂60 s 后廓清)。LR-1 为良性病变,LR-2 为良性病变可能大,LR-3 类为中度可疑肝细胞癌,LR-4 高度可疑肝细胞癌,LR-5 为肝细胞癌,LR-M 为非肝细胞肝癌特异性恶性肿瘤可能[5]。CEUS LI-RADS 分类标准见表1。
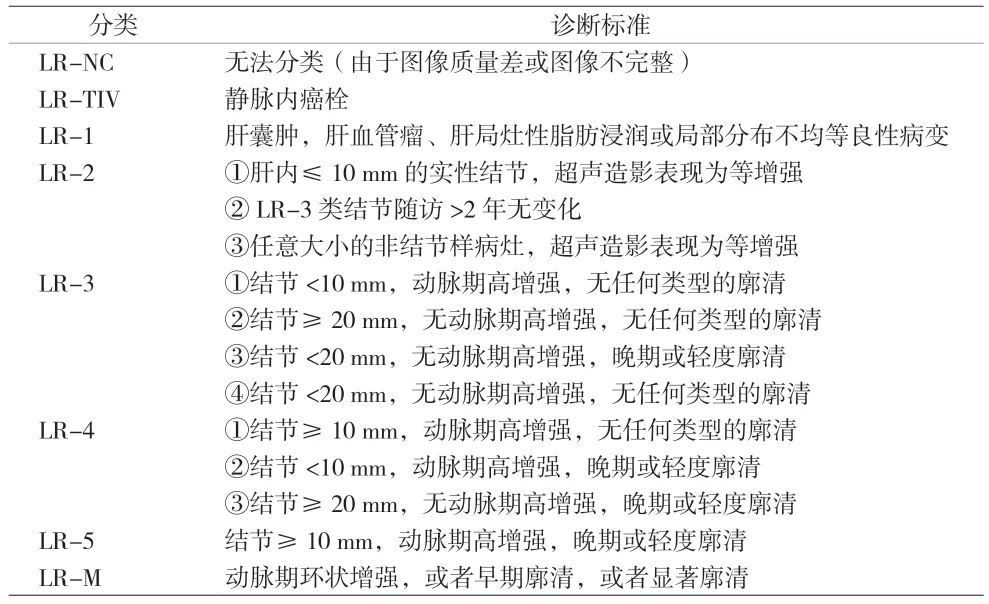
表1 CEUS LI-RADS分类标准参考表
1.3 统计学方法 采用SPSS 20.0 统计软件。符合正态分布的计量资料以(±s)表示,两组间比较采用t检验;计数资料以n(%)表示,用χ2检验;以病理结果为金标准,评估CEUS LI-RADS 分类鉴别诊断肝结节良恶性的准确性、敏感度、特异度、阳性预测值、阴性预测值、阳性似然比、阴性似然比、假阳性率和假阴性率;受试者操作曲线(ROC)计算曲线下面积(AUC)和最大约登指数;以P<0.05 为差异有统计学意义。
2 结果
2.1 两组患者一般资料比较 见表2。

表2 两组患者一般资料比较
2.2 两组患者血生化比较 见表3。
表3 两组患者血生化比较(±s)

表3 两组患者血生化比较(±s)
组别 n 空腹血糖(mmol/L)总胆固醇(mmol/L)LDL-C(mmol/L) 谷丙转氨酶(U/L) 总胆红(µmol/L) 乳酸脱氢酶(U/L) 血肌酐(µmol/L)尿素氮(mmol/L)白蛋白(g/L)良性组 75 5.6±1.2恶性组 67 5.9±1.54.8±1.2 2.5±0.6 56.2±10.3 65.8±13.5 156.9±32.4 55.7±9.8 12.3±3.4 45.2±4.3 4.7±1.3 2.6±0.7 58.9±11.2 69.7±14.5 172.4±42.6 53.2±8.9 10.9±3.2 43.6±4.1 t 值 0.567 0.469 0.327 0.754 0.603 1.052 0.856 0.452 0.526 P 值 0.526 0.623 0.658 0.296 0.352 0.123 0.301 0.523 0.479
2.3 两组患者常规超声比较 见表4。
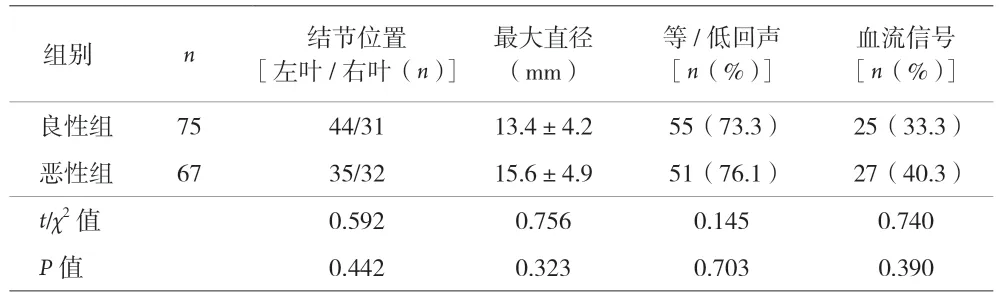
表4 两组患者常规超声比较
2.4 两组患者CEUS 比较 与良性组比较,恶性组动脉期显着增强,门脉期和延迟期等或低增强,“快进快出”模式,延迟廓清,廓清时间延长,差异均有统计学意义(P<0.05)。见表5。
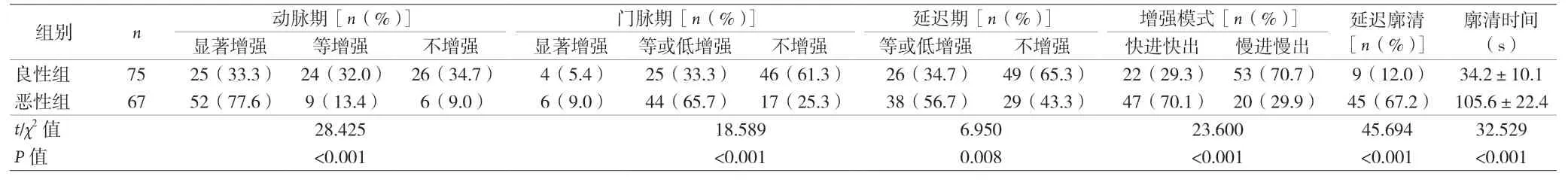
表5 两组患者CEUS比较
2.5 CEUS LI-RADS分类诊断性能 CEUS LI-RADS分类评估LR-5 和LR-M 共50 例(其中37 例LR-5 和13例LR-M),1~4 共92 例,其中1 类20 例,2 类25 例,3 类30 例,4 类17 例。以LR-5 和LR-M 作为诊断肝结节恶性的标准(见图1、2),CEUS LI-RADS 分类诊断肝结节恶性的准确性为83.80%,敏感度为70.15%,特异度为96.00%,阳性预测值为94.00%,阴性预测值为78.26%,阳性似然比为53.73%,阴性似然比为31.09%,假阳性率为4.00%,假阴性率为29.85%。见表6。
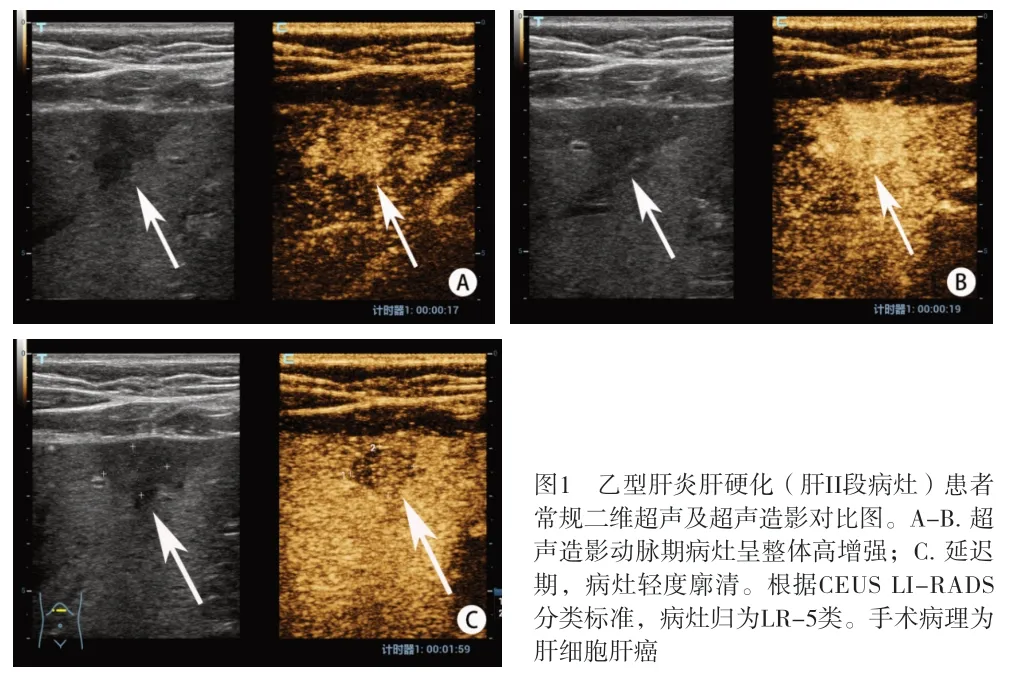
图1 乙型肝炎肝硬化(肝II段病灶)患者常规二维超声及超声造影对比图。A-B. 超声造影动脉期病灶呈整体高增强;C. 延迟期,病灶轻度廓清。根据CEUS LI-RADS分类标准,病灶归为LR-5类。手术病理为肝细胞肝癌
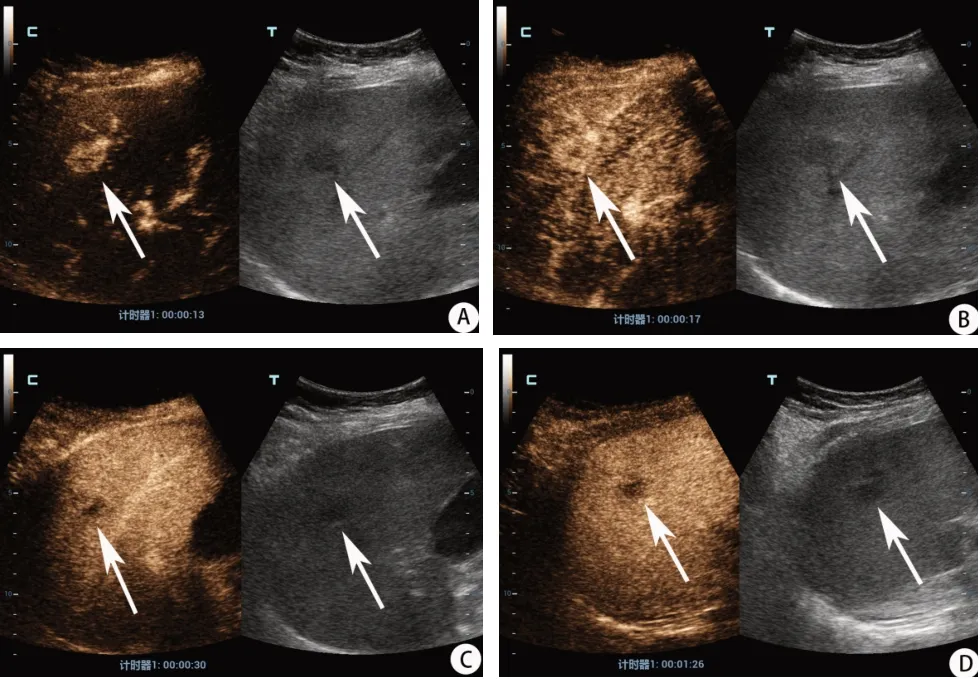
图2 乙型肝炎肝硬化(肝Ⅷ段病灶)患者常规二维超声及超声造影对比图。A-B. 超声造影动脉期病灶呈整体高增强;C. 门脉早期(30 s)病灶出现廓清(早期廓清);D. 延迟期病灶呈轻度廓清。根据CEUS LI-RADS分类标准,病灶归为 LR-M 类。手术病理为胆管细胞癌

表6 CEUS LI-RADS分类诊断性能(n)
2.6 CEUS LI-RADS 分类诊断肝结节恶性的ROC分析 以LR-5 和LR-M 作为诊断肝结节恶性的标 准,ROC 计 算LI-RADS 分 类 的AUC 为0.846(95%CI=0.797~0.899,P<0.001),最大约登指数 为66.15%。见图3。
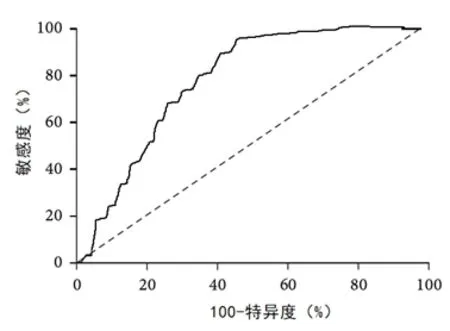
图3 CEUS LI-RADS分类诊断肝结节恶性的ROC曲线
3 讨论
CEUS 在评估肝脏局灶性病变方面具有较高的准确性。临床背景(肝硬化、其他恶性肿瘤)对准确解释CEUS 结果至关重要。肝硬化下>95%局灶性病变是肝细胞癌,肝细胞癌通常表现为动脉期显着增强,随后晚期发生轻度和延迟廓清[6-7]。对于肝内胆管细胞癌,动脉期的造影增强模式可能不同[8-9]。CEUS 的主要优点是实时成像和肾脏低毒性。肝硬化已被公认为肝细胞癌和肝内胆管细胞癌的主要危险因素,因此,如何提高肝硬化背景下肝脏结节良恶性质鉴别诊断对于肝癌防治具有十分重要的临床意义。
本研究显示,良恶性组患者一般资料差异无统计学意义(P>0.05),常规超声显示结节位置、最大直径、回声及血流灌注差异无统计学意义(P>0.05)。提示单纯依赖临床指标和常规超声鉴别诊断小直径的肝结节良恶性有一定局限性。肝硬化背景降低了常规超声对结节回声的敏感性[10]。CEUS 利用造影剂提高了结节与背景肝实质的对比度[11],此外,肝脏属于双重富血供脏器,通过多期造影剂增强模式和廓清方式能够提供更多肝脏恶性结节的生物学特征[12-13]。CEUS 显示,恶性组动脉期显着增强,门脉期和延迟期等或低增强,“快进快出”模式,延迟廓清,廓清时间延长(P<0.05)。恶性结节具有典型的增强和廓清模式,也提示恶性结节的血液灌注特征,与恶性增殖相一致[14-15]。本研究根据CEUS LI-RADS 分类对小直径肝结节性质进行诊断,准确性、特异度和阳性预测值较好。HUANG 等[16]研究也认为,LR-1 和LR-2 分类中未发现恶性病变,LR-3分类中5%为恶性,LR-4、LR-5 和LR-M 中HCC 检出率分别为48%、98%和75%。与世界医学和生物学超声联合会(WFUMB)和欧洲医学和生物学超声学联合会(EFSUMB)标准相比,CEUS LR-5 在诊断敏感性较低的小肝癌方面表现出更高的特异性。最后,本研究ROC 计算CEUS LI-RADS 分类诊断恶性结节的AUC 为0.846,提示CEUS LR-5 和LR-M 对诊断肝硬化伴小直径的恶性结节有较好的应用潜力。
综上所述,超声造影LI-RADS 分类对肝硬化伴直径<2 cm 肝脏结节良恶性质鉴别诊断仍有较高的准确性和特异度,有较好的临床应用价值。本研究的局限性在于样本量有限,未对肝硬化的严重程度进行亚组分析,剪切波弹性成像联合CEUS 是否能够进一步提高小直径结节恶性诊断的性能还有待比较[17]。



