陈周浔 郭 健 刘纳新 朱冠保
胃癌的浸润转移是一个多因素综合作用的复杂的连续过程,在这个过程中,有许多不同因子在不同层次上单独调节,或者通过相互间的调节来调控整个浸润转移过程;另一方面肿瘤细胞自身的增殖和凋亡状态也与浸润转移的过程密切相关。由于对此机制缺乏深入了解,阻碍了有效防治措施。Autotaxin是一种胞外磷酸二酯酶、细胞自分泌运动刺激因子,首先由Stracke等[1]从人类恶性黑色素瘤细胞A2058培养基中分离并纯化,为125kDa胞外糖蛋白,被报道能刺激黑色素瘤细胞产生随机性或方向性的运动。蛋白序列分析研究表明ATX与细胞表面一型溶血磷脂酶D(lysophospholipase D,LysoPLD)有显着的同源性,通过对其外部氨基酸的剪切而被释放到胞外,能将溶血磷脂酰胆碱(LPC)水解转化为被称为多功能“磷脂调控因子”的胆碱溶血磷脂酸(LPA)[2,3]。水解终产物LPA的产生能较充分地解释ATX对肿瘤细胞的间接调控影响。因此通过拮抗溶血磷脂酸的合成、阻断溶血磷脂酸的代谢途径和抑制溶血磷脂酸受体的活性及其信号转导,可望成为抗肿瘤生长和转移的新方向。揭示自分泌运动因子ATX与胃癌浸润、转移及预后的关系,对于阐明胃癌发展的分子机制以及防治有重大意义。而有效地阻断ATX活性则成为胃癌肿瘤分子镖靶,并有可能为分子疗法提供新的理论及实践依据。
材料与方法
1.材料:菌株和质粒:人胃癌细胞株AGS、大肠杆菌DH5α由本研究组保存。主要材料:pSUPER RNAi System,购自Oligoengine公司,RT-PCR试剂盒购自德国QIAGEN公司,Trizol试剂及 LipofectamineTM2000 Reagent购自 Invitrogen公司,RPMI 1640培养基及10% 牛胎血清购自GIBCO公司,Autotaxin(E-12)Antibody:sc-374222购自Santa cruz biotechnology公司,8μm孔径的聚碳酯膜transwell小室购自Corning公司、matrigel基质胶购自BD PharMingen公司。
2.方法:(1)shRNA-ATX设计、合成及质粒载体构建:按照人Autotaxin基因序列,通过网上设计软件OptiRNA中,选取两条靶序列,分别为p1:5'-ATCCTCGACATGGCAAGGAG-3'和 p2:5'-CTCAGAAAGTGAAATCTCGCTCTC -3'设计并合成编码shRNA序列的DNA单链,经退火连接后,经由XhoⅠ/BglⅡ双酶切克隆至带有H1启动子的质粒载体pSuperneo-GFP中,用含卡那霉素抗性的LB平板筛选阳性克隆,挑取克隆质粒后行酶切鉴定并测序。取得测序正确的重组ShRNA-Autotaxin,PCR扩增条件为:94℃预变性5min;94℃变性30s,58℃退火 30s,72℃延伸 40s(30个循环),72℃10min。将表达质粒转染胃癌细胞,得到长期稳定低表达ATX的细胞克隆。本实验设4组:分别为WT(野型组)、pSUPER-control空载质粒组、pSUPER-mock组(随机片段组)、pSUPER-ATX组。(2)蛋白质印迹法检测ATX蛋白的表达:以GAPDH的水平作为等量蛋白质样本的内对照,每个标本至少重复3次进行SDS-PAGE电泳,并转至硝酸纤维素膜上,室温封闭2h后,用TBST缓冲液漂洗3次,再加入兔抗人ATX抗体(1∶1000),4℃孵育过夜。TBST缓冲液漂洗3次后加入辣根过氧化物酶标记的羊抗兔IgG二抗(1∶2000),室温摇床孵育1h,增强化学发光系统显色,暗室内X线底片感光成像。(3)细胞增殖试验:将细胞接种域孔板中培养,每孔细胞数约为2×103个,分别在培养24、48、72、96h后,每孔加入MTT溶液(5mg/m l)20μl,继续培养4h后,吸弃上清液,每孔加入二甲基亚砜150μl,室温下振荡10min,使结晶完全溶解。在酶标仪上于波长490nm处测定各孔的吸光度值。重复实验3次,取平均值。(4)细胞迁移及侵袭实验实验:采用Corning公司8μm孔径的聚碳酯膜transwell小室(24孔板)。在transwell小室的下室中预先加入600μl 20%FCS的1640培养基,37℃平衡1h,将不同胃癌细胞株的细胞用PBS洗3次。胰酶消化后重悬于含10%FBS的1640培养基中,取1×106/ml细胞100μl加入至 transwell上室。在 37℃、5%CO2条件下培养。取出transwell小室,从上室用棉棒擦净未穿透微孔滤膜的细胞。PBS冲洗后用4%甲醛固定,行Giemsa染色在200倍显微镜下计数滤膜下表面的细胞数,随机计数5个视野中的细胞数目,每个标本重复3次。以迁移细胞的数目(取试验平均值)来表示肿瘤细胞的迁移能力。与细胞迁移实验的不同,细胞侵袭实验加用细胞外基质matrigel(BD PharMingen)来模拟体内细胞外基质环境。将细胞外基质 matrigel,按50μl/cm2的比例加入transwell小室的聚碳酯膜上表面,37℃或室温下通风橱中放置30min使其成胶。其余操作步骤同迁移实验。以侵袭细胞的数目来表示肿瘤细胞的侵袭能力。
3.统计学方法:数据采用excel数据包统计处理,采用t检验,one-way ANOVA法进行统计学处理,P<0.05为差异具有统计学意义。
结 果
1.AGS野型细胞和各组转染细胞的ATX差异性表达:用RT-PCR检测细胞ATX mRNA表达的改变,选取构建后的两个细胞克隆pSUPER-ATX1和pSUPER-ATX2,结果显示:此两组 pSUPER-ATX转染细胞的ATX mRNA表达量相对于WT细胞分别下降了(79.34 ±9.95)% 和(95.42 ±1.93)%,提示在shRNA的作用下,ATX mRNA的表达受到明显抑制(t=7.247,P < 0.01;t=14.391,P < 0.01,图 1),WT组、pSUPER-control组及 pSUPER-mock组之间的ATX mRNA的表达量没有明显区别。用Western blot法检测细胞ATX蛋白表达的改变,结果显示:两组pSUPER-ATX转染细胞的ATX mRNA表达量相对于WT细胞分别下降了(78.45±5.45)%和(85.42±3.56)%,提示在shRNA的作用下,ATX 蛋白的表达受到明显抑制(t=8.457,P <0.01;t=11.936,P <0.01,图 2),野型及阴性对照组的 ATX蛋白的表达量没有明显区别。上述结果显示,pSUPER-ATX2对细胞内源性ATX的表达抑制效果优于pSUPER-ATX1,故将pSUPER-ATX2组选为以下细胞生物学行为测定的实验细胞克隆。

图1 野型AGS组以及空载质粒pSUPER-control组、pSUPER-ATX组(2组克隆,分别为pSUPER-ATX1、pSUPER-ATX2)、随机片段组pSUPER-m ock组转染后ATX mRNA表达量的改变
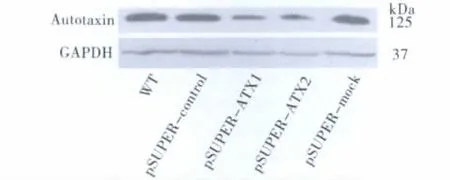
图2 野型AGS组以及空载质粒pSUPER-control组、pSUPER-ATX组(2组克隆,分别为pSUPER-ATX1、pSUPER-ATX2)、随机片段组pSUPER-mock组转染后ATX蛋白表达量的改变
2.细胞增殖能力的改变:采用MTT法测定4组细胞的增殖能力,结果如图3所示。在转染后50h,pSUPER-ATX2组细胞增殖能力较WT组、pSUPER-control组以及pSUPER-mock组持续降低,根据存活细胞数量与吸光度值呈正比的原理,各组间细胞数量有区别,pSUPER-ATX2对AGS细胞的增殖能力有抑制作用,但此差异没有统计学的显着性。
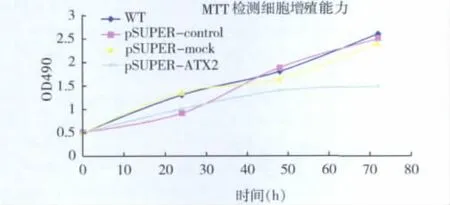
图3 MTT法检测转染后各组AGS细胞吸光度值的改变
3.细胞迁移和侵袭能力的改变:采用transwell法及matrigel法测定细胞迁移和侵袭能力,选取pSUPER-ATX2克隆参与实验比较。结果显示:在转染后20h起,pSUPER-ATX2组较 WT组、pSUPER-control组以及pSUPER-mock组的迁移和侵袭细胞数开始降低;转染后48~72h,pSUPER-ATX2组迁移和侵袭细胞相对于WT组、pSUPER-control组以及pSUPER-mock组有明显减少,如图4、图5所示。以pSUPER-ATX组和WT组对比结果为例,迁移细胞数分别下降了(67.63 ±12.03)%(t=15.487,P <0.01)和侵袭细胞数分别下降了(68.02 ±15.63)%(t=9.417,P <0.01)。这些结果提示在 pSUPER -ATX的作用下,胃癌细胞AGS的迁移和侵袭能力也受到不同程度的抑制。
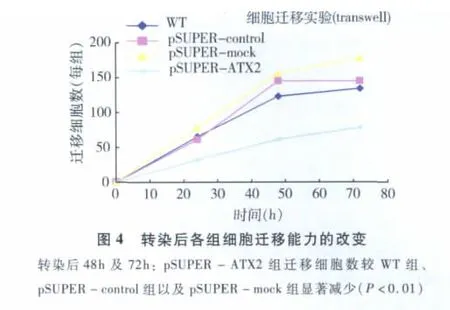
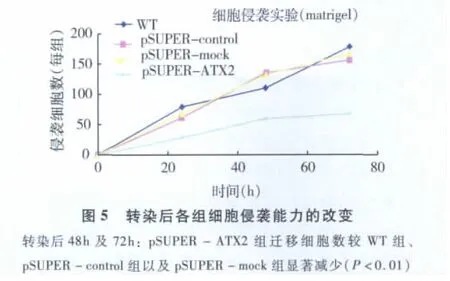
4.AGS细胞迁移及侵袭实验图片:pSUPERATX组相比野型细胞 WT,空载质粒组 pSUPER-control细胞以及随机片段组pSUPER-mock细胞,其跨膜穿透的细胞数明显较少(P<0.01,图6)。
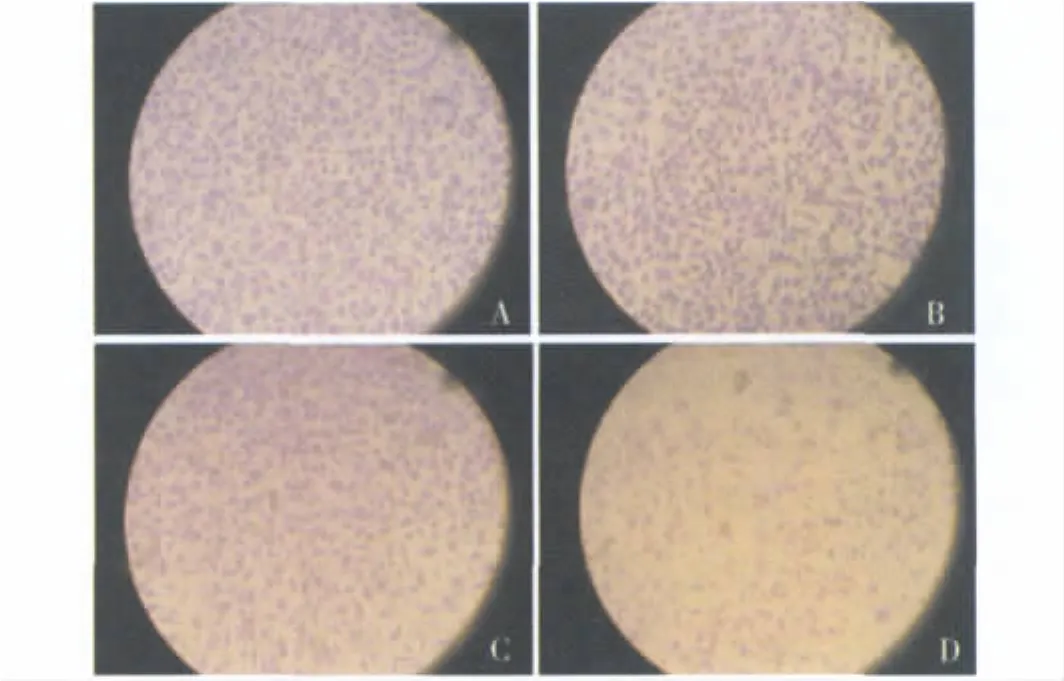
图6 细胞侵袭能力分析
讨 论
目前国内外对ATX在正常细胞及肿瘤细胞中的表达的研究主要集中在甲状腺癌、恶性黑色素瘤、乳腺癌、肝细胞癌以及成神经细胞瘤,中有相关报道[4~13]。Euer等[14]报道通过使用基因芯片技术发现,ATX与40余种和细胞高转移特性密切相关基因的高表达调节有相关性。体外实验结果表明,通过质粒转染无内源性ATX表达的NIH3T3细胞后,此细胞具有更强的侵袭性转移潜力[15];在体外细胞学研究中证实ATX系统能介导瘤细胞的迁移性,进一步体内实验证明,转染ATX后细胞的成血管能力明显增强,从而间接证实了ATX扮演的成血管因子功能。Noh等最近首次使用RNA干扰技术阻断乳腺癌MDA435细胞的ATX表达,并利用基因芯片技术将亲本细胞和转染细胞基因表达进行广谱扫描比较,发现绝大部分被上调或下调的基因与细胞代谢、细胞骨架组构、转录调节以及细胞信号转导密切相关。故认为ATX是磷脂酸代谢信号转导中的关键调节因子而因此可以成为新的乳腺癌基因疗法的分子镖靶。
本研究组在过去的研究中发现,相对于无远处及淋巴转移的胃癌组织样本,ATX在伴有远处及区域淋巴转移的胃癌样本中呈显着的高表达态,数据结果显示ATX与人类胃癌细胞的转移潜力呈正相关。正常胃组织中的ATX可能在细胞的生长调控中起一定的作用,其具体作用机制尚待进一步研究。本研究利用RNA干扰技术,将ATX经由XhoⅠ/BglⅡ双酶切克隆至带有H1启动子的质粒载体pSuper-neo-GFP中,转染人胃癌细胞株,建立稳定传代的低表达ATX的细胞株。检测结果提示靶向shRNA的导入可以抑制AGS细胞内源性的ATX mRNA和蛋白的表达。而转染后低表达ATX的AGS细胞迁移和侵袭能力显着低于野型细胞。由此提示ATX参与介导胃癌细胞的侵袭及转移过程,其信号转导通路在胃癌细胞转移中很可能起着举足轻重的作用,而干预这些信号通路则可能成为胃癌转移防治的理想选择,同时也为ATX作为胃癌分子靶点提供新的理论及实践依据。本研究组推测ATX参与介导胃癌细胞的侵袭及转移过程可能依赖于RhoGTP酶的参与。RhoGTP酶家族是一类参与众多细胞信号转导通路的重要蛋白,其家组成员是联系膜表面受体与肌动蛋白细胞骨架的关键调节分子,起着分子开关的作用。反应于细胞外信号诱导肌动蛋白细胞骨架组织的相应改变,继发一系列的生物学反应,如细胞形态形成、趋化作用及轴突的定向等。Reymond等证实,细胞运动信号转导主要通过几种GTP酶等完成调控,因此 Rho、Rac、Cdc42以及Ras在细胞运动过程中具有促进作用。这些因子在调节细胞骨架、细胞运动、细胞增殖、细胞凋亡等方面发挥重要作用。本研究结果为进一步揭示自分泌运动因子ATX在促进胃癌细胞的侵袭及转移的分子机制而需进行的体内研究提供了基础。
1 Stracke ML,Krutzsch HC,Unsworth EJ,et al.Identification,purification,and partial sequence analysis of autotaxin,a novelmotilitystimulating protein[J].JBiol Chem,1992,267(4):2524 -2529
2 Umezu-Goto M,Kishi Y,Taira A,et al.Autotaxin has lysophospholipase D activity leading to tumor cell growth and motility by lysophosphatidic acid production[J].JCell Biol,2002,158(2):227 -233
3 Liu S,Murph M,Panupinthu N,et al.ATX -LPA receptor axis in inflammation and cancer[J].Cell Cycle,2009,8(22):3695 -3701
4 Kehlen A,Englert N,Seifert A,et al.Expression,regulation and function of autotaxin in thyroid carcinomas[J].Int JCancer,2004,109(6):833-838
5 Seifert A,Klonisch T,Wulfaenger J,et al.The cellular localization of autotaxin impacts on its biological functions in human thyroid carcinoma cells[J].Oncol Rep,2008,19(6):1485 -1491
6 Saunders LP,Ouellette A,Bandle R,et al.Identification of smallmolecule inhibitors of autotaxin that inhibit melanoma cell migration and invasion[J].Mol Cancer Ther,2008,7(10):3352 - 3362
7 Zhang H,Xu X,Gajewiak J,et al.Dual activity lysophosphatidic acid receptor pan-antagonist/autotaxin inhibitor reduces breast cancer cell migration in vitro and causes tumor regression in vivo[J].Cancer Res,2009,69(13):5441-5449
8 Liu S,Umezu-Goto M,Murph M,etal.Expression ofautotaxin and lysophosphatidic acid receptors increasesmammary tumorigenesis,invasion,and metastases[J].Cancer Cell,2009,15(6):539 -550
9 Panupinthu N,Lee HY,Mills GB.Lysophosphatidic acid production and action:critical new players in breast cancer initiation and progression[J].Br JCancer,2010,102(6):941 -946
10 Cooper AB,Wu J,Lu D,et al.Is autotaxin(ENPP2)the link between hepatitis C and hepatocellular cancer?[J].J Gastrointest Surg,2007,11(12):1628-1634
11 Wu JM,Xu Y,Skill NJ,et al.Autotaxin expression and its connection with the TNF-alpha-NF-kappaB axis in human hepatocellular carcinoma[J].Mol Cancer,2010,9:71
12 Wang W,Wu F,Fang F,et al.Inhibition of invasion and metastasis of hepatocellular carcinoma cells via targeting RhoC in vitro and in vivo[J].Clin Cancer Res,2008,14(21):6804 -6812
13 Haga A,Nagai H,Deyashiki Y.Autotaxin promotes the expression of matrix metalloproteinase-3 via activation of the MAPK cascade in human fibrosarcoma HT -1080 cells[J].Cancer Invest,2009,27(4):384-390
14 Euer N,Schwirzke M,Evtimova V,et al.Identification of genes associated withmetastasisofmammary carcinoma inmetastatic versus nonmetastatic cell lines[J].Anticancer Res,2002,22(2A):733 -740
15 Nam SW,Clair T,Campo CK,et al.Autotaxin(ATX),a potent tumormotogen,augments invasive and metastatic potential of rastransformed cells[J].Oncogene,2000,19:241 -247



