董 平 吴雪平 陈卫东
血管钙化(vascular calcification,VC)是动脉粥样硬化、高龄、糖尿病、慢性肾脏病等疾病的病理改变结果。终末期肾脏病血液透析(maintenance hemodialysis,MHD)患者的血管钙化发生率可高达80%~85%,其钙化严重程度与心血管并发症及高病死率相关[1~3]。越来越多的研究证实微炎性状态在慢性肾脏病(chronic kidney disease,CKD)患者体内普遍存在,是动脉血管钙化发生、发展的主要机制。血小板/淋巴细胞比值(platelet lymphocyte ratio,PLR)、中性粒细胞/淋巴细胞比值(neutrophil lymphocyte ratio,NLR)是近年来新提出非特异性复合炎性指标,可较为稳定反映机体炎性状态的指标。研究表明,PLR、NLR在脑缺血发作、恶性血管疾病中作为炎性指标与疾病的发生、发展及预后关系密切,而PLR、NLR在MHD患者中血管钙化相关研究尚少[4,5]。本研究旨在探讨PLR、NLR在MHD患者发生血管钙化的临床应用价值,为该类患者早期预测血管钙化提供临床依据。
资料与方法
1.研究对象:回顾性分析2020年5月~2021年3月在蚌埠医学院第一附属医院肾病科住院并行维持性血液透析治疗的114例终末期肾脏病患者的临床资料,其中男性65例(57.02%)、女性49例(42.98%),患者年龄27~83 (53.40±13.52)岁,透析龄为5~156个月。纳入标准:①年龄≥18周岁;②规律血液透析≥3个月,2~3次/周,每次4h,采用普通肝素抗凝,透析血流量200~250ml/min,透析液流量为500ml/min;③行腹部侧位平片检查。排除标准:①合并有自身免疫性疾病、结缔组织疾病、严重血液系统疾病、恶性肿瘤;②近3个月有急、慢性感染者;③肝功能异常;④近3个月内有手术史或外伤史;⑤临床资料不完整。本研究经蚌埠医学院第一附属医院医学伦理学委员会审批(伦理审批号:2020KY087)。
2.观察指标:(1)患者一般资料:收集患者年龄、性别、体重指数(BMI)、高血压、糖尿病、冠心病、透析龄(月)。(2)实验室检查:收集患者收缩压、舒张压、中性粒细胞计数、淋巴细胞计数、血小板计数、血红蛋白(Hb)、丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、碱性磷酸酶(ALP)、白蛋白(ALB)、尿酸(UA)、血肌酐(Scr)、血脂总胆固醇(TC)、甘油三酯(TG)、血磷、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)、C反应蛋白(CRP)、甲状旁腺激素(PTH)、25羟维生素D等,并计算NLR、PLR、校正钙、钙磷乘积。(3)腹主动脉钙化评估及分组:血管钙化诊断标准:当腹主动脉发生钙化时,腰椎旁可见纵向线条样或条形高密度影。根据腹部侧位平片的结果分为AAC组与非AAC组。
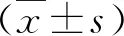
结 果
1.两组间一般临床资料比较:AAC组较非AAC组患者具有较高的糖尿病、冠心病患病率;其年龄、透析龄水平偏高,差异有统计学意义(P<0.05)。两组在性别、合并高血压、BMI方面比较,差异无统计学意义(P>0.05),详见表1。
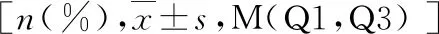
表1 AAC组与非AAC组基线资料比较
2.MHD患者两组实验室指标比较:AAC组NLR、PLR、C反应蛋白高于非ACC组,差异有统计学意义(P<0.05)。收缩压、舒张压、ALT、AST、HB等其余生化指标比较,差异无统计学意义(P>0.05),详见表2。
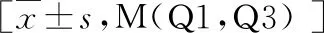
表2 AAC组与非AAC组临床指标对比
3.AAC危险因素的Logistic分析:以腹主动脉钙化的发生结局(发生血管钙化赋值为1,未发生血管钙化赋值为0)为因变量,将年龄、透析龄、糖尿病(有糖尿病病史=1,无糖尿病病史=0)、冠心病史(有冠心病病史=1,无冠心病病史=0)、CRP、NLR、PLR作为自变量进行二元Logistic回归分析。年龄(OR=1.057,95% CI:1.012~1.104,P=0.012)、NLR(OR=1.420,95% CI:1.069~1.885,P=0.015)、PLR(OR=1.007,95% CI:1.001~1.014,P=0.036)是AAC的独立危险因素,详见表3。
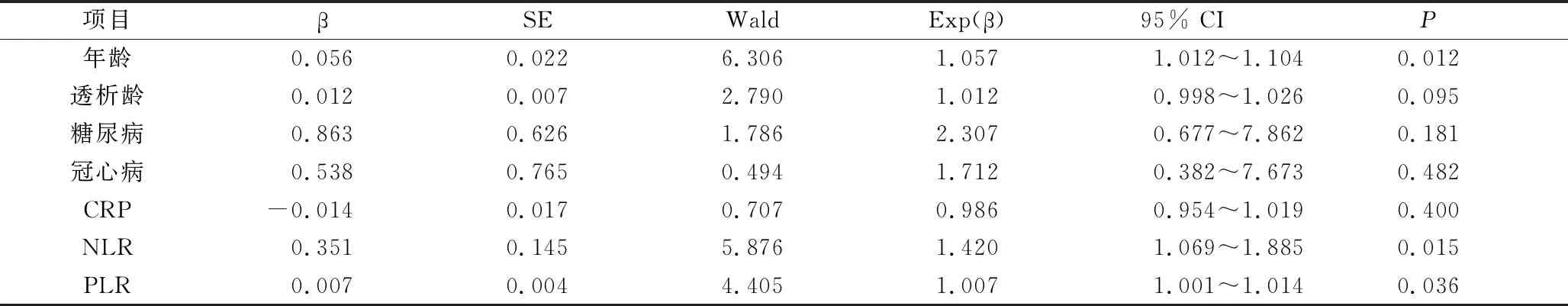
表3 影响AAC的多因素Logistic分析
4.AAC与各临床资料的相关性分析:AAC与年龄、糖尿病、血磷、CRP、PLR、NLR呈正相关,差异有统计学意义(P<0.005);PLR与年龄、NLR、CRP呈正相关,差异有统计学意义(P<0.005)。NLR与年龄、PLR、CRP呈正相关,差异有统计学意义(P<0.005),详见表4。
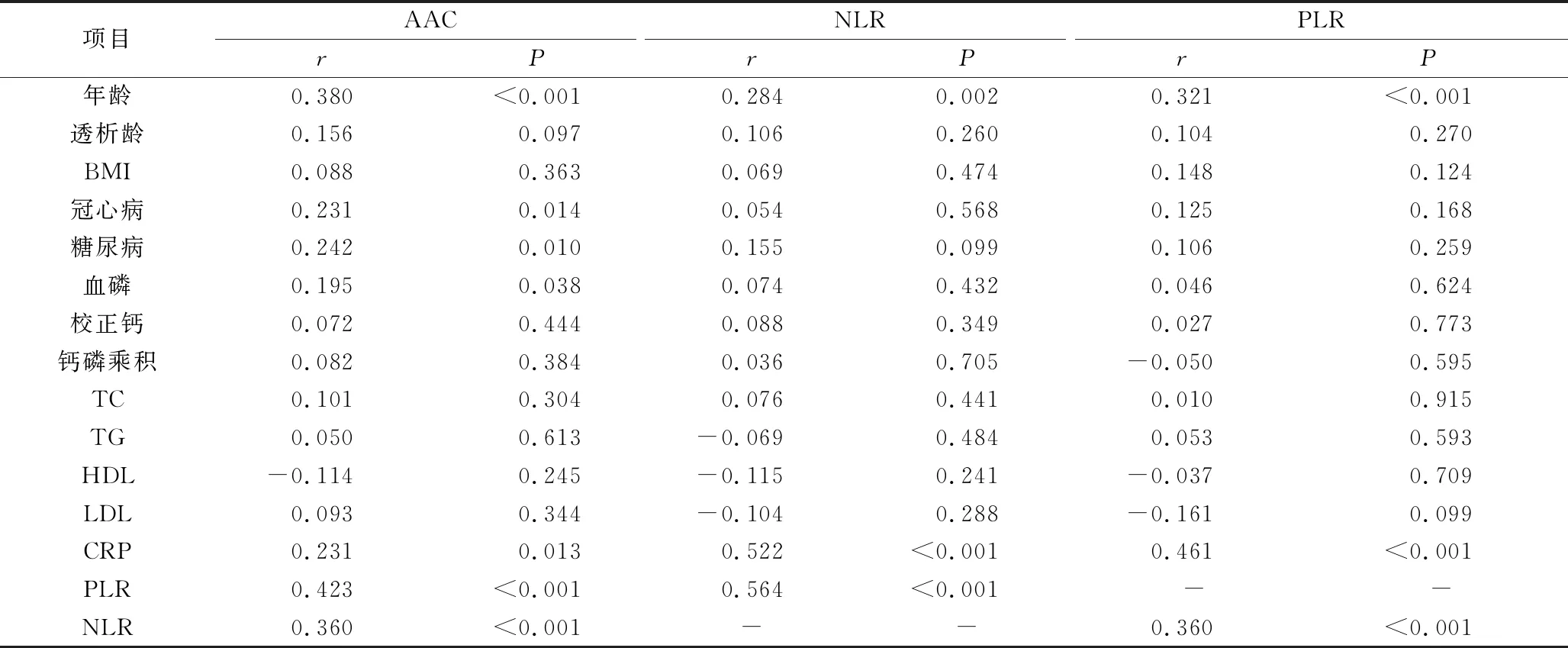
表4 AAC、NLR及PLR与各临床资料的相关性分析
5.NLR、PLR在MHD患者发生AAC的预测价值:以NLR和PLR为检验变量,有无AAC为状态标量,绘制ROC曲线示:PLR预测MHD患者发生AAC的曲线下面积为0.778(95% CI:0.691~0.864,P<0.001),当PLR在114.87时,敏感度和特异性之和最大(敏感度为83%、特异性为66%);NLR预测MHD患者发生AAC的曲线下面积为0.769(95% CI:0.679~0.860,P<0.001),当NLR在3.37时,敏感度和特异性度之和最大(敏感度为80%、特异性为68%)。NLR和PLR曲下面积均>0.7,差异有统计学意义,详见表5、图1。
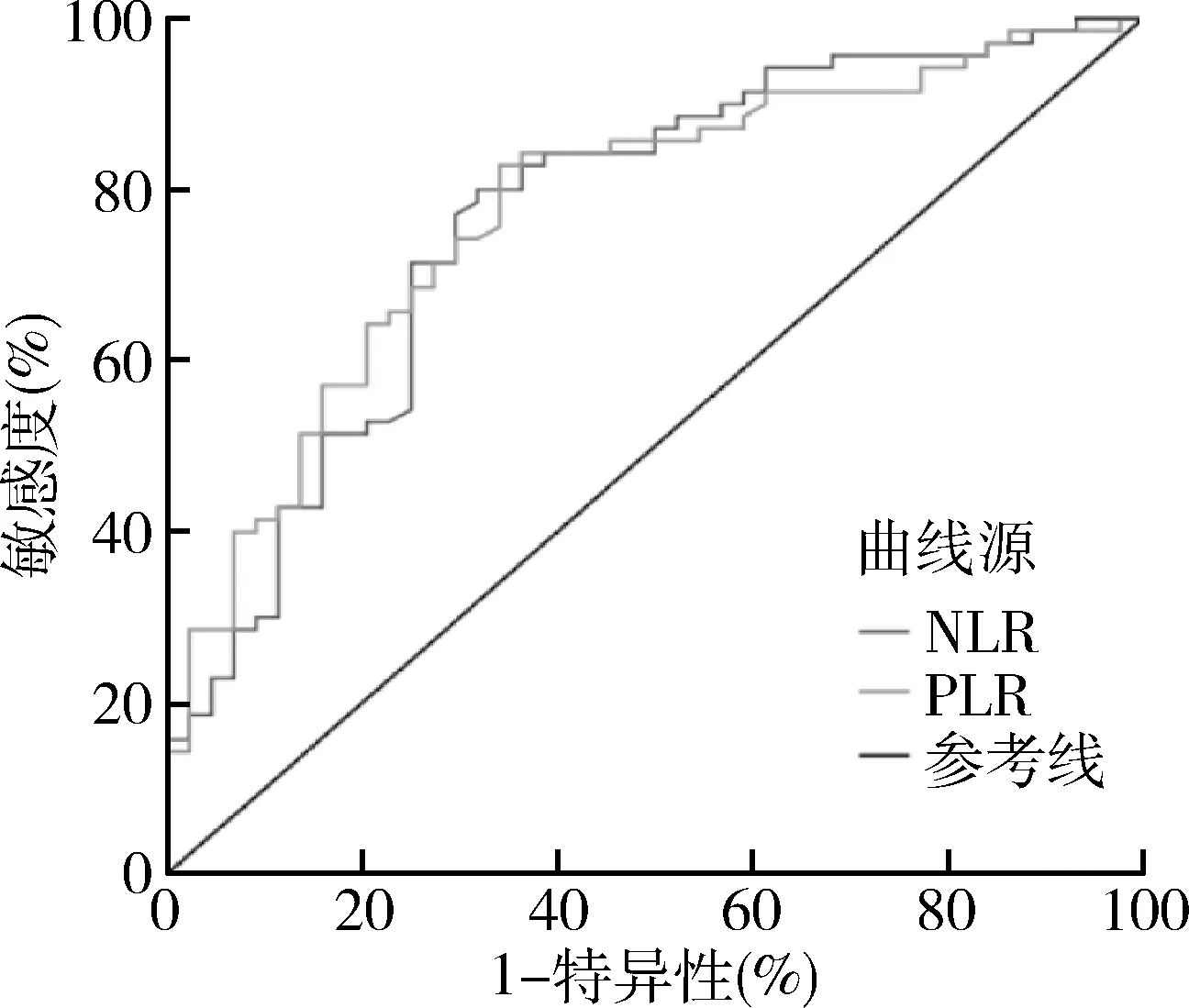
图1 MHD患者NLR、PLR在发生AAC中的ROC曲线分析
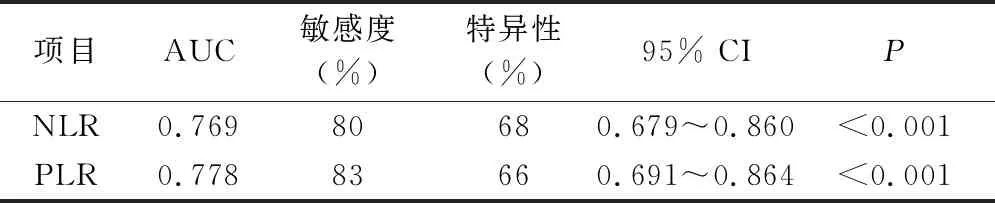
表5 PLR和NLR在腹主动脉钙化中的ROC曲线分析
讨 论
CKD是一个日益严重的公共健康问题,全球患病率约为10%,目前将近550万人将接受肾脏替代治疗,其中主要是血液透析治疗[6,7]。MHD患者的病死率在过去10年中有所下降,然而仍然比正常人群的病死率高几倍[8]。普通腹部侧位平片可以提供有关慢性肾脏病矿物质疾病状态,是血管钙化和心血管风险的可能信息,腹主动脉钙化已被用作MHD患者血管钙化的指标和该类患者动脉粥样硬化风险的新标记。
CKD 的慢性炎性状态有许多因素共同参与,包括免疫异常、氧化应激、慢性和反复感染和肠道微生物失调等[9]。微炎性状态与冠心病、代谢综合征、糖尿病、衰老有关[10]。从老年人和衰老的内皮细胞中分离出的微泡钙化相关蛋白水平较高,可促进血管内皮细胞的钙化[11,12]。CKD 早期已经发现血管壁中促炎和促成骨蛋白表达上调以及主动脉中膜钙化[13]。杨洁等[14]研究显示,MHD患者AAC发生率很高,高龄、长透析龄是AAC加重的危险因素。本研究结果显示,114例MHD患者AAC的发生率为61.4%,AAC组患者具有较高的发病年龄及透析龄,且糖尿病、冠心病患病率均高于非AAC组患者。
MHD人群中的持续炎症是对由尿毒症滞留溶质、血液透析过程本身、慢性肾病并发症及其治疗干预引起的体内平衡失衡的不适应反应[15]。MHD患者的炎症可以用几种标志物来测量,如CRP、高敏CRP、白细胞介素-6、肿瘤坏死因子α、降钙素原、白蛋白、铁蛋白和胆固醇水平[16]。近年来,NLR、PLR作为不同疾病的炎症标志物已逐渐得到了补充[17,18]。对于CKD患者的炎性状态其具有更高的稳定性、平衡性及代表性[19]。NLR升高表明中性粒细胞的相对增多,中性粒细胞是临床上较为常见的炎性细胞之一,能发挥黏附、吞噬及趋化作用,在炎性状态其表达水平升高。针对PLR升高现象,有研究表明在炎性状态下,炎性细胞因子可以调节血小板的释放,以此作为炎性状态下血小板数量减少的快速恢复机制[20]。此外,血小板中α颗粒含有细胞因子,也具有明显的促炎作用[21]。而淋巴细胞数量的减少可能是由于炎性反应中高皮质醇水平引起的淋巴细胞凋亡增加和淋巴细胞生成抑制所致[22,23]。
本研究结果显示,AAC组患者CRP水平较非AAC组患者高,表明血管钙化患者微炎症情况重于非血管钙化患者。PLR、NLR作为近年来新提出的复合炎性指标,其在本文的横断面研究中发现,PLR、NLR与CRP呈正相关, PLR预测MHD患者发生AAC的曲线下面积为0.778(最佳截断值为114.87,敏感度为83%,特异性为66%);NLR预测 MHD 患者发生AAC的曲线下面积为0.769(最佳截断值为3.37,敏感度为80%,特异性为68%),提示PLR、NLR与炎性指标CRP相关,对MHD患者AAC发生有一定的诊断性,但特异性不强,受多种因素的影响,其在预测MHD患者发生腹主动脉钙化方面可能存在一定的局限性,其敏感度和特异性尚需要大规模的研究。
值得指出的是,本研究中钙化组患者与非钙化组患者的血磷、校正钙、钙磷乘积、PTH水平比较,差异无统计学意义,这与既往研究不符,考虑原因:(1)未对服用骨化三醇、维生素D类似物药物情况进行统计分析,不排除与药物的使用有关。(2)本研究对象为长期规律透析的患者,注重饮食控制及相关指标的监测,可能存在一定的选择偏倚。(3)不排除与PTH、维生素 D 和血清钙、磷等多种因素间互相影响的复杂机制有关。释放以CRP为主的细胞因子使微炎性状态持续导致终末期肾脏病的患者发生血管钙化[24]。但本研究中CRP并不是AAC发生的独立危险因素,考虑本研究规模相对较少,入选病例存在病情偏轻或偏重可能,结果存在偏倚。
综上所述,新型炎性指标PLR、NLR与传统炎性指标CRP相关,对MHD患者AAC发生有一定的诊断性,但特异性不高,可能是受到多种因素的影响,其对透析患者血管钙化的评估效用受到干扰。



