王思瑶 陆春晖 张 洁 靳 瑾
糖尿病现已成为全球日益严重的公共卫生问题,严重威胁着人类健康。作为以高血糖为主要特征的慢性进行性代谢疾病,糖尿病主要由遗传和环境因素共同导致,而胰岛β细胞功能异常是导致糖尿病发生、发展的关键因素[1,2]。机体内血糖长期处于升高状态会诱导氧化应激、炎症等反应发生,加速胰岛β细胞凋亡,进而使其功能受损,引起糖尿病及相关并发症的发生[3]。目前,寻找改善高糖环境作用下胰岛β细胞功能损伤的药物或分子靶标,对于开发糖尿病的新型有效治疗方案来说意义重大。
短链脂肪酸(short-chain fatty acids,SCFAs)主要由膳食纤维和未消化碳水化合物发酵过程中的肠道微生物群所产生,也是肠道上皮细胞能量供应的重要来源,其主要包括乙酸钠、丙酸钠和丁酸钠[4]。据报道,SCFAs能够促进肠黏膜上皮细胞增殖,改善肠道屏障的完整性,防止微生物易位,并进一步抑制炎性反应。然而,肠道菌群失调和产生SCFAs的细菌减少常见于各种代谢疾病中,包括糖尿病和肥胖症[5,6]。在临床研究和动物建模研究中,增加膳食纤维摄入量或给予SCFAs,能够对炎症性肠病、过敏性气道疾病、1型糖尿病和2型糖尿病发挥保护作用,并抑制促炎性细胞因子的分泌和活性氧的产生,这表明SCFAs在治疗慢性炎症或代谢疾病方面具有广阔的治疗潜力,但其确切机制仍不明晰[7~9]。本研究旨在探讨乙酸钠、丙酸钠和丁酸钠3种SCFAs对高糖环境下所诱发胰岛β细胞功能损伤的影响及其可能的作用机制。
材料与方法
1.主要材料与试剂:大鼠胰岛素瘤INS-1细胞购自美国ATCC公司,胎牛血清购自杭州四季青生物工程材料有限公司,乙酸钠、丙酸钠、丁酸钠购自美国Sigma公司,青-链霉素双抗、RPMI1640完全培养基及胰蛋白酶购自美国Gibco公司,CCK-8试剂盒购自上海汉恒生物工程有限公司,Annexin V-FITC/PI检测试剂盒购自南京诺唯赞生物科技股份有限公司,Hoechst 33258染液和DCFH-DA荧光探针购自北京百奥莱博科技有限公司,胰岛素含量检测试剂盒购自上海超研生物科技有限公司,环氧树脂购自美国Bio-Rad公司,RIPA裂解液、BCA测定试剂盒及ECL购自上海碧云天生物技术有限公司,兔抗LC3-Ⅰ、LC3-Ⅱ、p62、PINK1及Parkin单克隆抗体购自英国Abcam公司,兔抗GAPDH多克隆抗体与辣根过氧化物酶标记的二抗购自美国 Santa Cruz公司。其他试剂均为国产分析纯。
2.方法
(1)细胞培养与分组处理:INS-1细胞置于37℃、5%CO2培养箱中培养,添加RPMI1640完全培养基(含10%胎牛血清、1%青-链霉素双抗),每24h更换1次培养液,待其长满瓶壁70%后,0.25%胰酶消化,常规传代培养。将对数生长期的细胞接种于96孔培养板,分组后进行对应处理,具体如下:①对照组:使用5mmol/L葡萄糖处理细胞;②模型组:使用33mmol/L葡萄糖处理细胞,建立高糖诱导损伤;③乙酸钠(sodium acetate,NaA)组:预先以100μmol/L NaA处理细胞24h,然后高糖诱导损伤;④丙酸钠(sodium propionate,NaP)组:预先以100μmol/L NaP处理细胞24h,然后高糖诱导损伤;⑤丁酸钠(sodium butyrate,NaB)组:预先以100μmol/L NaB处理细胞24h,然后高糖诱导损伤。处理结束后,收集各组细胞进行后续实验。
(2)CCK-8法检测细胞增殖活性:INS-1细胞接种到96孔细胞培养板中,处理后24h,每孔中加入10μl CCK-8溶液,孵育培养2h,通过酶标仪检测每孔450nm处吸光度(absorbance,A)值,计算细胞增殖率,细胞增殖率(%)=实验组A450/对照组A450×100%。
(3)流式细胞术检测细胞凋亡水平:收集5组INS-1细胞,常规消化后离心,PBS清洗细胞,加入适量1×binding buffer重悬细胞,调整密度为1×106个/毫升,吸取100μl细胞悬液移入流式检测管,再依次加入5μl Annexin V-FITC和10μl碘化丙锭,震荡混匀,室温孵育10min,立即通过流式细胞仪上机检测各组细胞凋亡情况。
(4)Hoechst 33258染色观察细胞凋亡形态:收集5组INS-1细胞,PBS清洗后,加入5μg/ml Hoechst 33258工作染液,置于37℃培养箱内避光孵育30min,PBS洗涤细胞并重悬,取适量细胞混悬液制片,在荧光显微镜下观察并拍摄图片,结果中细胞核呈亮蓝色荧光。
(5)放射免疫法测定细胞释放胰岛素的含量:将5组INS-1细胞分别以2×105个/孔接种于48孔细胞培养板中,置于37℃、5%CO2培养箱培养过夜后,以4000r/min(离心半径10cm)离心30min,吸取上清液,放射免疫法检测不同处理组细胞释放胰岛素的含量,具体步骤按照试剂盒说明书进行。
(6)DCFH-DA荧光探针测定细胞ROS水平:将5组INS-1细胞分别以1×104个/孔接种于96孔细胞培养板中,添加含有10μmol/L DCFH-DA 的无血清培养基培养细胞,置于37℃培养箱内孵育30min,在荧光显微镜下观察并拍摄图片,通过酶标仪检测激发波长488nm、发射波长525nm处每孔细胞的荧光强度。
(7)透射电子显微镜观察线粒体超微结构及自噬泡:收集5组INS-1细胞,PBS清洗,用预冷的2.5%戊二醛固定液固定过夜,再用1%四氧化锇中固定,分级乙醇溶液中脱水后,环氧树脂包埋。切片后,样品用乙酸双氧铀和柠檬酸铅染色,在透射电子显微镜观察各组细胞线粒体形态及线粒体自噬情况,拍摄图片。
(8)Western blot法检测线粒体自噬相关蛋白表达水平:添加RIPA裂解缓冲液分别提取5组INS-1细胞蛋白,BCA法蛋白定量,于-70℃冰箱中保存备用。在蛋白样品中加入等体积样品缓冲液,煮沸变性,每泳道按30μg上样,通过10%SDS-PAGE电泳后,电转至PVDF 膜上。常温下以5%脱脂奶粉封闭并震荡1h,在膜上加入LC3-Ⅰ、LC3-Ⅱ、p62、PINK1及Parkin的单克隆抗体,共置于4℃冰箱孵育过夜,用辣根过氧化物酶标记的对应二抗,室温孵育1h,ECL显影并定影,以GAPDH作为内参蛋白,Image J软件测定各蛋白条带灰度值,计算各蛋白相对表达量。
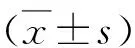
结 果
1.各组INS-1细胞增殖率比较:与对照组比较,模型组细胞增殖率显着降低(P<0.05);而NaA组、NaP组及NaB组细胞增殖率均显着高于模型组细胞增殖率(P<0.05),详见图1。
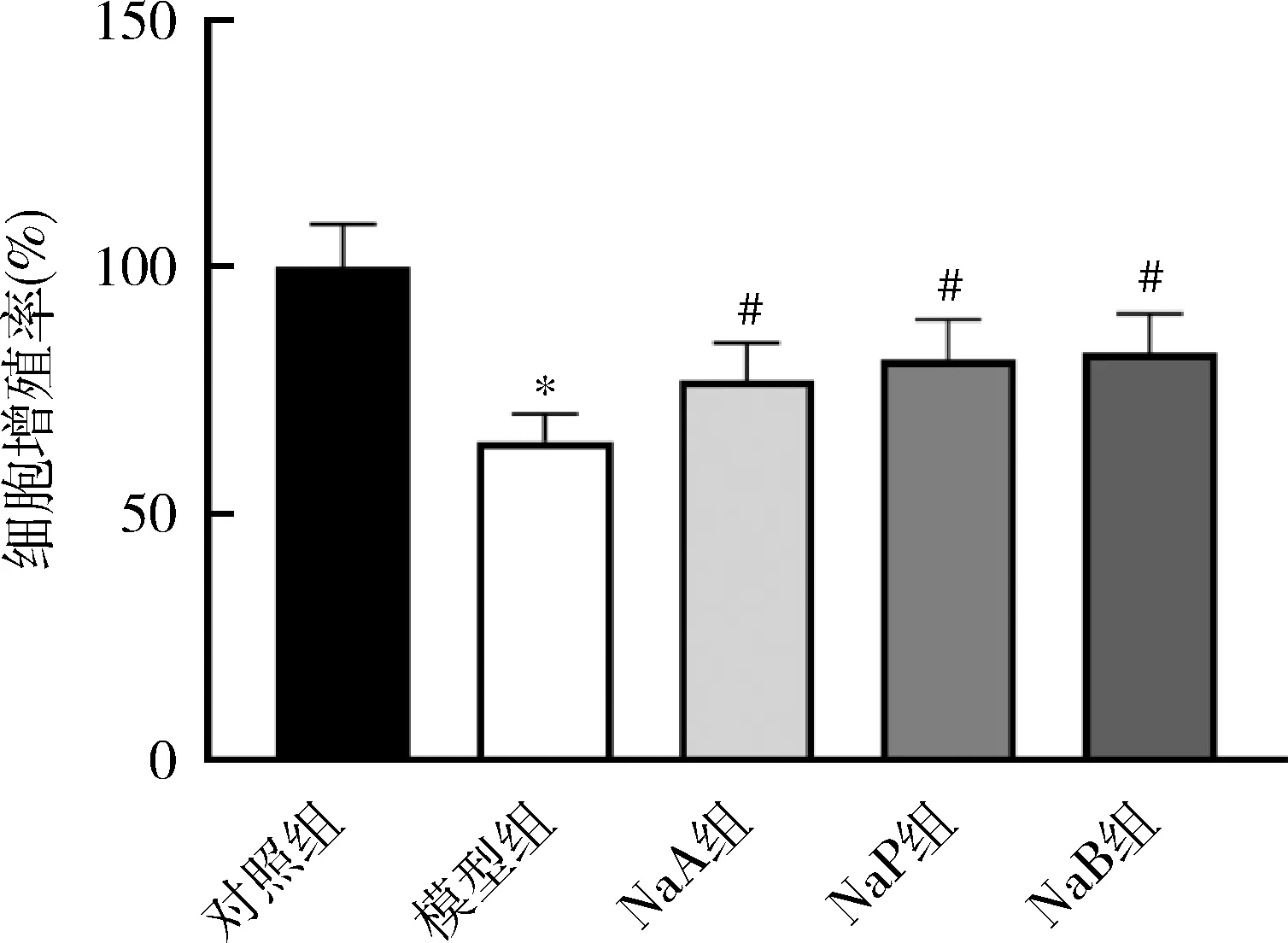
图1 各组INS-1细胞增殖率比较与对照组比较,*P<0.05;与模型组比较,#P<0.05
2.各组INS-1细胞凋亡水平比较:与对照组比较,模型组细胞凋亡率显着升高(P<0.05);与模型组比较,NaA组、NaP组及NaB组的细胞凋亡率均显着降低(P<0.05),详见图2。
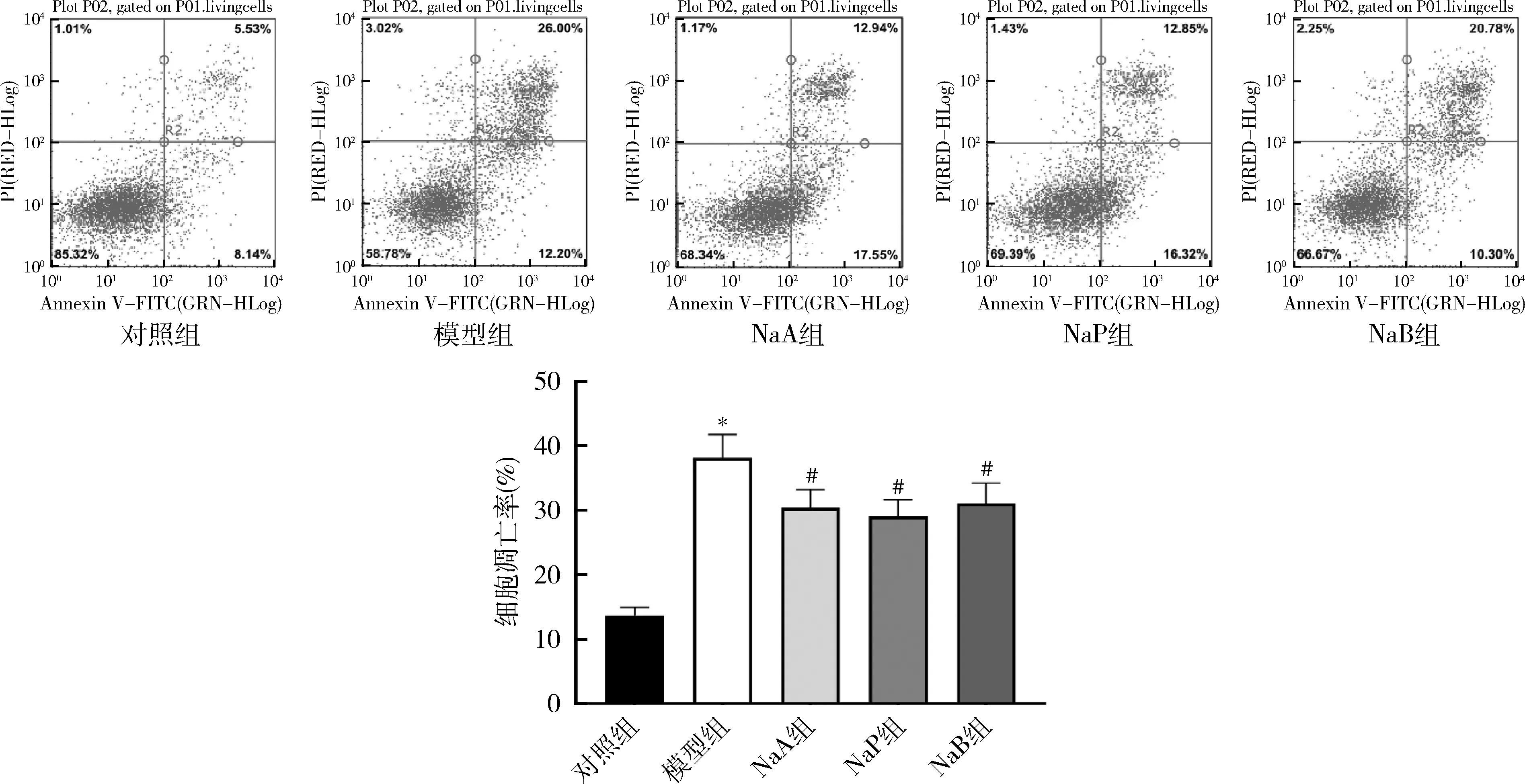
图2 各组INS-1细胞凋亡率比较与对照组比较,*P<0.05;与模型组比较,#P<0.05
通过Hoechst 33258染色观察到对照组INS-1细胞形态结构完整,外围轮廓清晰,细胞大小较为一致;模型组的部分细胞内出现浓缩、碎裂的蓝色凋亡体,说明细胞发生损伤与凋亡;相较于模型组,NaA组、NaP组以及NaB组细胞内浓缩与碎裂现象有所改善,未见明显的蓝色凋亡体,详见图3。
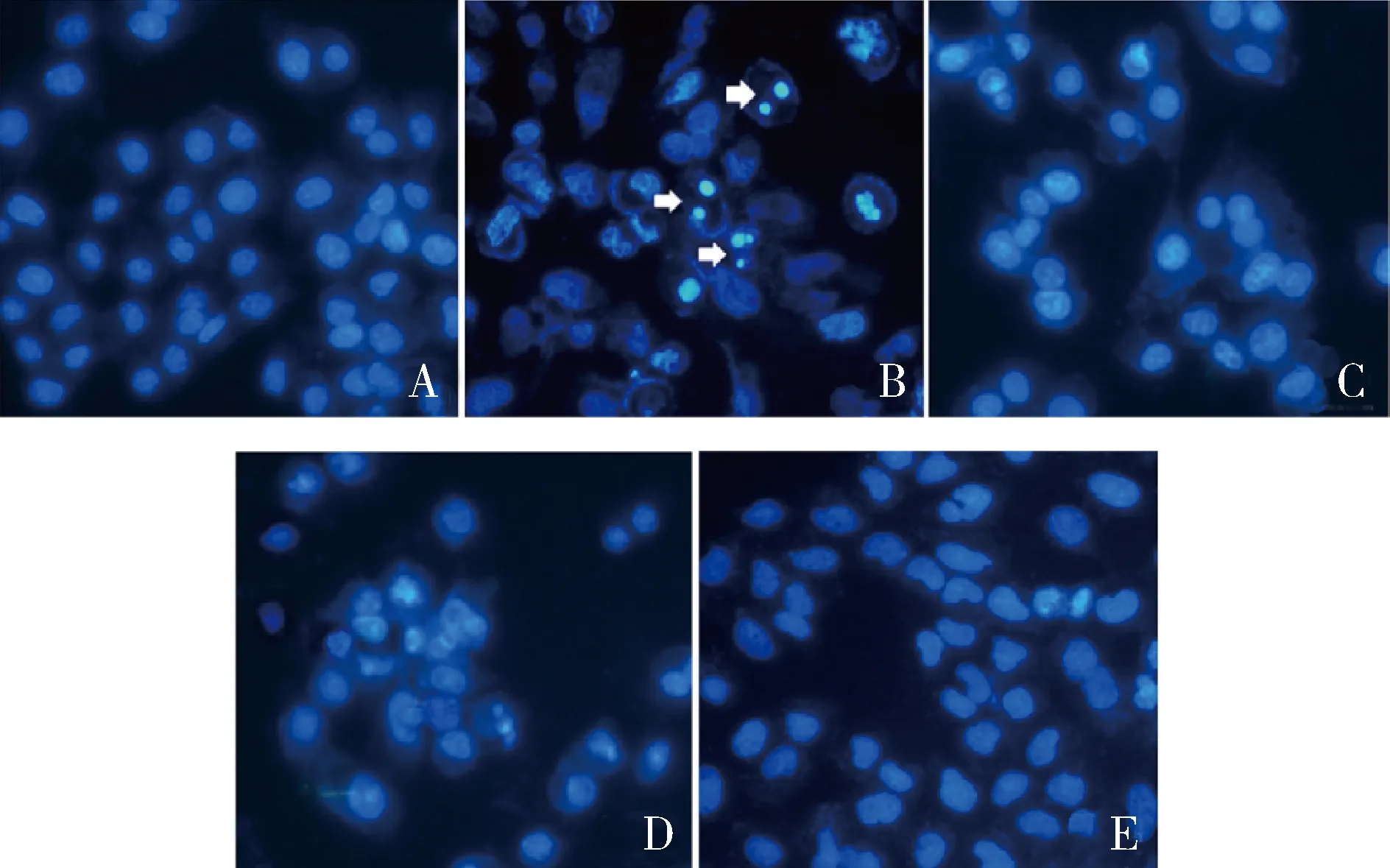
图3 各组INS-1细胞凋亡形态观察(Hoechst 33258染色,×200)A.对照组;B.模型组;C.NaA组;D.NaP组;E.NaB组。箭头所指为蓝色凋亡体
3.各组INS-1细胞胰岛素释放含量比较:与对照组比较,模型组细胞的胰岛素释放量显着降低(P<0.05);而相较于模型组,NaA组、NaP组及NaB组的细胞胰岛素释放水平均显着增加(P<0.05),详见图4。
4.各组INS-1细胞活性氧水平比较:与对照组比较,模型组细胞荧光强度显着升高(P<0.05),说明细胞内ROS水平增加;与模型组比较,NaA组、NaP组及NaB组的各组细胞荧光强度均显着降低(P<0.05),说明细胞内ROS水平下降,详见图5。
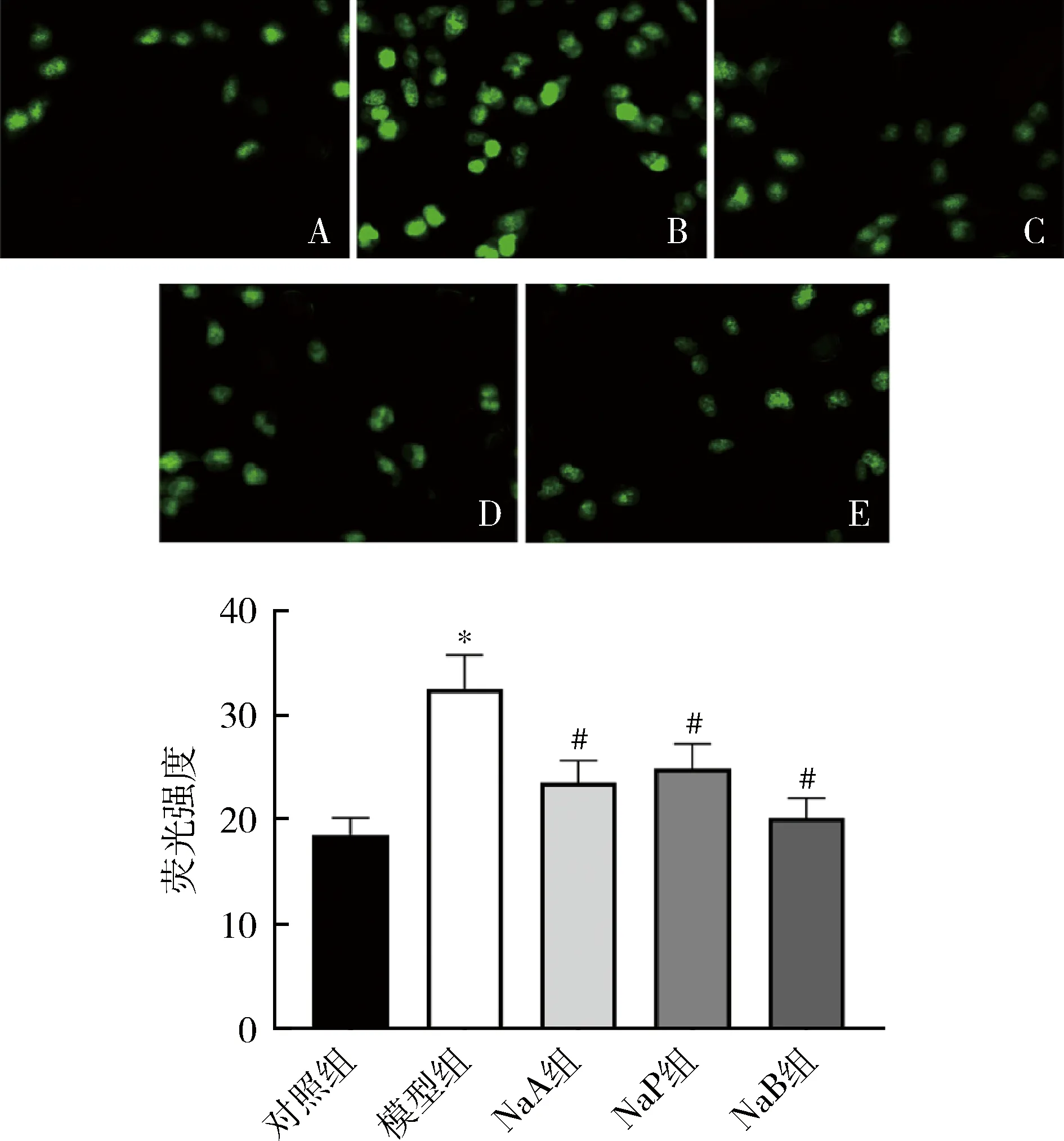
图5 各组INS-1细胞ROS水平测定(DCFH-DA染色,×100)A.对照组;B.模型组;C.NaA组;D.NaP组;E.NaB组。与对照组比较,*P<0.05;与模型组比较,#P<0.05
5.各组INS-1细胞线粒体超微结构观察结果:TEM下观察到对照组线粒体形态结构完整,嵴清晰可见;模型组线粒体结构受损,有明显的空泡形成、嵴破坏和自噬体吞噬等现象;NaA组、NaP组及NaB组线粒体受损现象均较模型组明显减轻,自噬体吞噬减少,详见图6。
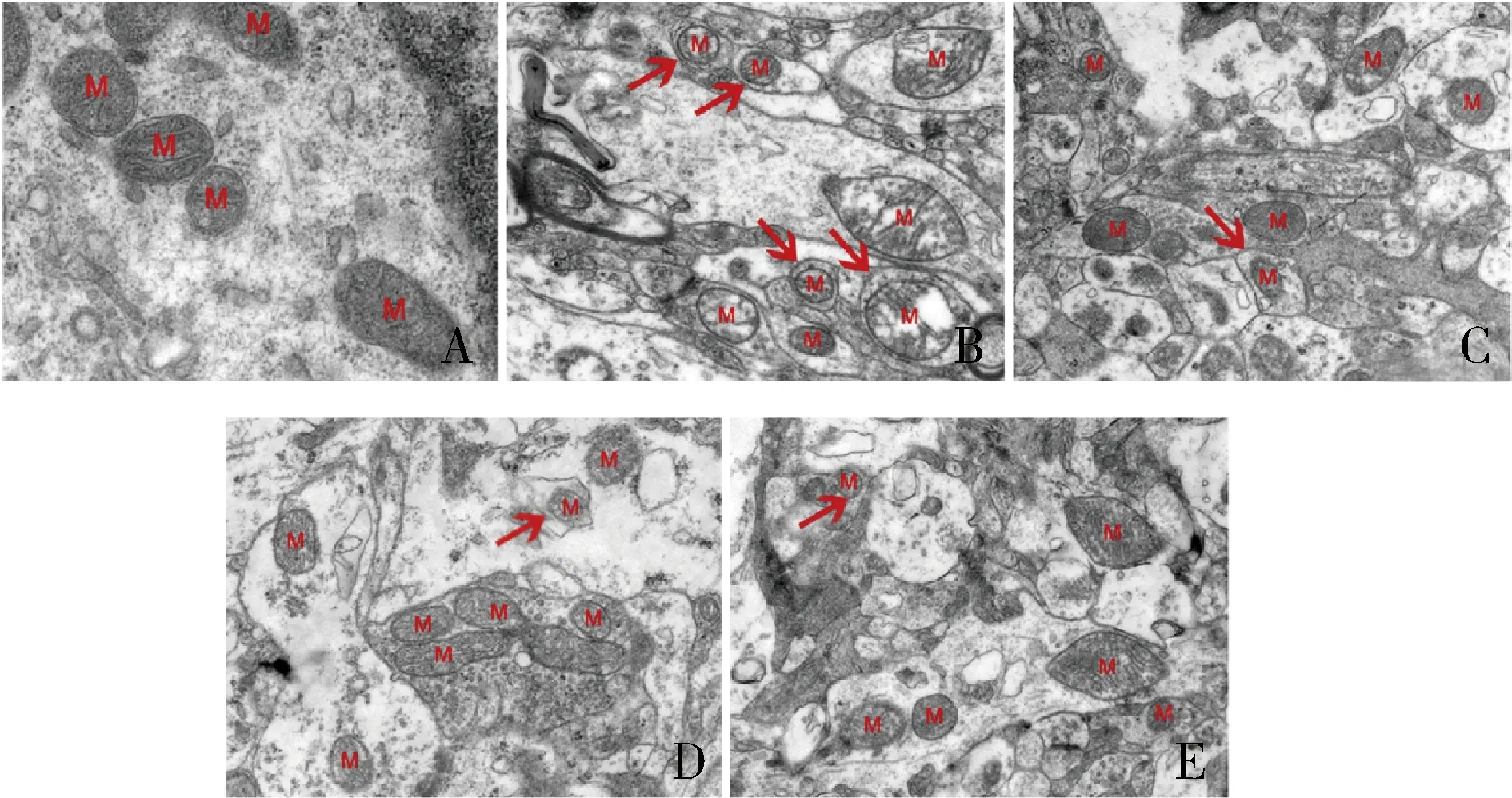
图6 各组INS-1细胞线粒体超微结构观察(TEM,×10000)A.对照组;B.模型组;C.NaA组;D.NaP组;E.NaB组。箭头所指为线粒体吞噬体,M表示线粒体
6.各组INS-1细胞线粒体自噬相关蛋白表达比较:与对照组比较,模型组细胞中LC3-Ⅱ/LC3-Ⅰ比值升高,PINK1与Parkin蛋白相对表达量显着上调,而p62蛋白相对表达量显着下调(P<0.05);与模型组比较,NaA组、NaP组及NaB组的细胞中LC3-Ⅱ/LC3-Ⅰ比值降低,PINK1与Parkin蛋白相对表达量显着下调,同时,p62蛋白相对表达量显着上调(P<0.05),详见图7。
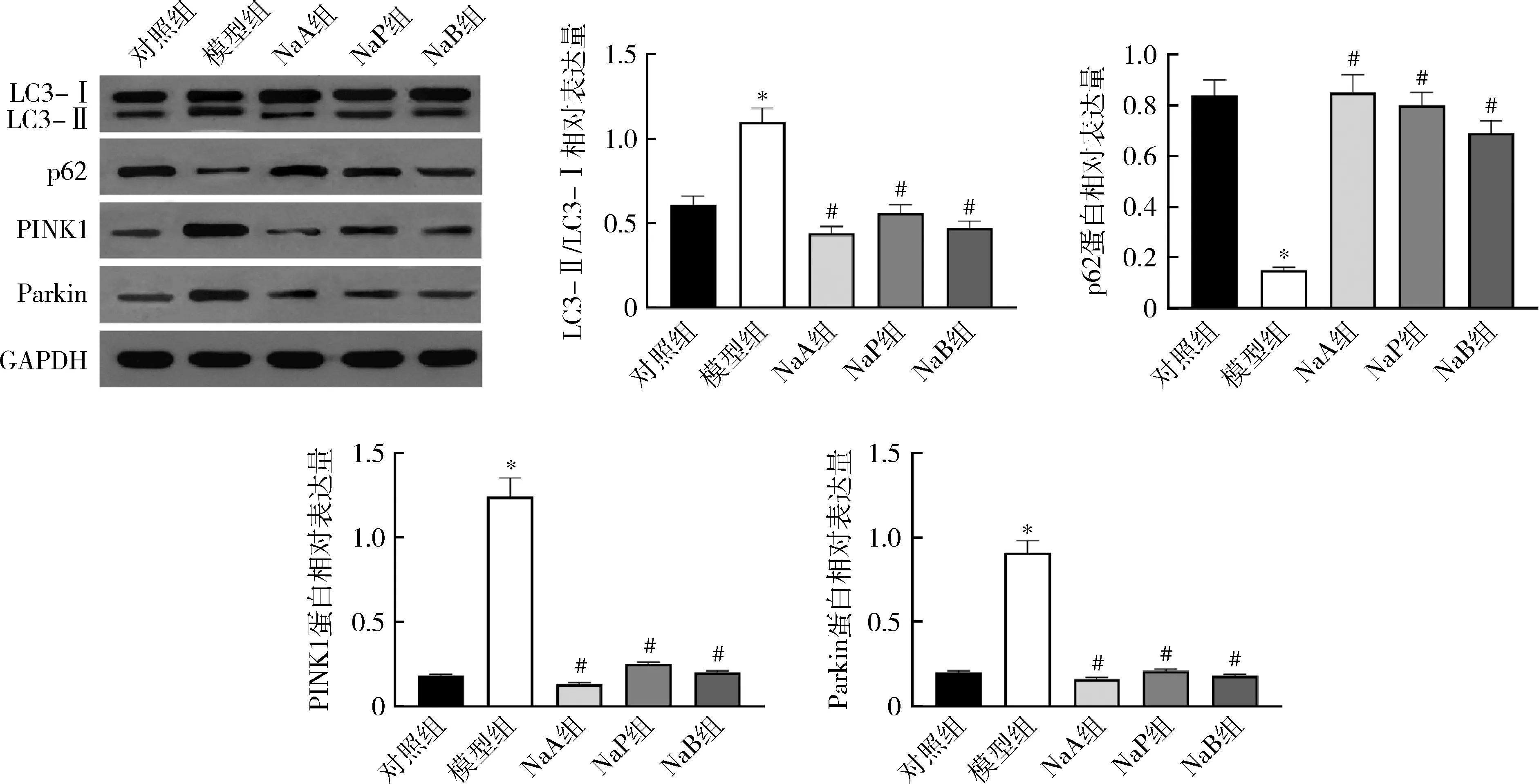
图7 各组INS-1细胞线粒体自噬相关蛋白表达比较与对照组比较,*P<0.05;与模型组比较,#P<0.05
讨 论
糖尿病的特征在于各种代谢异常,主要包括糖代谢和脂代谢以及其他内分泌激素的代谢紊乱,从而引起高血糖、胰岛素分泌不足、胰岛素功能障碍等[2]。在过去的几十年中,我国糖尿病及其并发症的发生率一直在稳步上升[10]。血糖稳态由胰岛控制,胰岛主要由α细胞、β细胞、δ细胞和PP细胞组成。其中,胰岛α细胞通过分泌胰高血糖素促进肝葡萄糖合成来提高血糖水平;胰岛δ细胞分泌生长抑素,通过旁分泌信号途径下调胰岛α细胞和胰岛β细胞释放的激素;胰岛PP细胞分泌的胰多肽对于胰岛素分泌具有再调节作用;胰岛β细胞则通过刺激脂肪、肌肉、肝脏和肠细胞中的血糖摄取来释放胰岛素,从而达到降低血糖水平的效果[11]。
研究表明,胰岛β细胞受损是糖尿病发生的主要病理性特征,糖尿病患者体内血糖一直处于较高水平,这将直接诱导胰岛β细胞损伤,增加体内胰岛素抵抗,进而导致胰岛素释放降低,血糖水平进一步上升,产生恶性循环,这种持续性作用会导致胰岛β细胞衰竭,其特征是胰岛β细胞功能障碍和数量明显减少[12,13]。目前,控制血糖的治疗策略主要集中在口服药物和胰岛素注射两个方面,口服药物如磺脲类药物,可以通过不同的信号通路促进内源性胰岛素分泌,但容易引起严重的低血糖症;外源性胰岛素注射,尤其是针对新发糖尿病的短期强化胰岛素治疗,可使胰岛β细胞功能得到恢复[14]。虽然这些干预措施可以控制血糖或暂时改善胰岛素分泌,但由2型糖尿病引起的并发症的发生率并没有显着降低,主要原因可能是缺乏内在的对胰岛β细胞的直接保护方式。
大量研究指出,SCFAs在糖尿病的病理生理学中起关键作用。例如,与健康对照组比较,1型糖尿病患者产生SCFAs的细菌数量明显减少,促进SCFAs合成的基因也减少,这与微生物群紊乱有关[15]。患有2型糖尿病的患者产生SCFAs的微生物群和SCFAs丰度降低,这是由于肠道微生物群改变、肠道屏障受损以及血浆脂多糖水平升高所致[16]。在小鼠模型中,使用SCFAs进行干预可以缓解1型糖尿病,这是通过降低自身免疫T细胞计数、抑制B淋巴细胞增殖以及扩大结肠、脾脏和全身淋巴结中的FoxP3+Treg细胞实现的[17]。此外,已有研究表明,SCFAs在糖尿病患者中的有利作用主要体现在降低血糖水平、改善胰岛素抵抗、减轻炎症和增强胰高血糖素样肽1(glucagon-like peptide-1,GLP-1)的分泌。SCFAs可以保护胰岛β细胞免受游离脂肪酸和其他一些细胞因子造成的损害,如采用SCFAs中的丙酸钠预处理可显着减少棕榈酸盐和炎性细胞因子诱导的胰岛β细胞死亡,增强葡萄糖刺激的胰岛素分泌和维持胰岛β细胞质量[18]。本研究结果同样显示,经过乙酸钠、丙酸钠和丁酸钠预处理,明显降低了高糖环境诱导的INS-1细胞凋亡,并增加了胰岛素释放水平,由此进一步说明了SCFAs可能在糖尿病中发挥胰岛保护作用。
胰岛β细胞长期处于高糖环境下会增加细胞内活性氧产生,而ROS的过量累积会导致胰岛β细胞凋亡[19]。因此,清除胰岛β细胞内过量的ROS并增强抗氧化能力是保护细胞免受高糖刺激受损的可行方法。本研究结果显示,在高糖环境刺激下INS-1细胞内ROS水平显着增加,而经过3种SCFAs乙酸钠、丙酸钠和丁酸钠预处理的INS-1细胞内ROS水平均显着下降,该结果说明SCFAs能够抑制高糖环境刺激下INS-1细胞内ROS水平的增高,从而抑制氧化应激反应,对胰岛β细胞发挥保护作用。
线粒体自噬参与调节糖尿病中胰岛β细胞的生理功能,通过自噬可以去除由内质网应激引起的错误折叠蛋白质或受损线粒体,并抑制氧化应激反应,由此说明该途径是控制线粒体质量的重要途径之一[20]。然而,由长期氧化应激引起的线粒体自噬也是多种疾病的共同特征,例如糖尿病、动脉粥样硬化、神经退行性疾病及脂质紊乱[21~23]。在糖尿病中,过度的线粒体自噬会损害胰岛β细胞并减少其胰岛素分泌,此外,还有助于线粒体内ROS的产生、NLRP3依赖性促炎反应的激活和脂毒性的加剧[24]。但关于高糖环境下线粒体自噬的潜在机制尚未完全阐明,探索基于胰岛β细胞自噬保护作用是控制糖尿病的有效方式。PINK1/Parkin途径是启动线粒体自噬的重要信号通路,当线粒体膜电位减小时,PINK1可以结合到线粒体中,将Parkin募集到线粒体外膜并启动线粒体自噬[25]。
本研究检测结果显示,经高糖环境诱导的INS-1细胞线粒体明显受损,内有自噬体吞噬现象,自噬相关蛋白LC3-Ⅱ/LC3-Ⅰ比值升高,p62蛋白相对表达量下调,PINK1与Parkin蛋白相对表达量均上调;而经乙酸钠、丙酸钠和丁酸钠预处理的INS-1细胞线粒体受损程度减小,自噬相关蛋白LC3-Ⅱ/LC3-Ⅰ比值降低,p62蛋白相对表达量上调,PINK1与Parkin蛋白相对表达量均下调,该结果提示SCFAs能够通过调节线粒体自噬而改善高糖环境刺激下的胰岛β细胞功能损伤。
综上所述,本研究结果表明,3种SCFAs乙酸钠、丙酸钠和丁酸钠能够保护高糖环境刺激下的INS-1细胞功能损伤,其可能的作用机制是通过抑制ROS产生及线粒体自噬实现的。该研究进一步明确了高糖环境下胰岛β细胞功能受损引起糖尿病发病的机制。但关于SCFAs保护高糖环境下损伤胰岛β细胞确切的分子机制尚不清楚,需要后续进行深入探究。



