唐亮,冯世庆,高瑞霄
不同时期移植人脐血CD34+细胞对大鼠脊髓损伤修复的对比研究
唐亮1,2,冯世庆1△,高瑞霄2
目的研究不同时期移植人脐血CD34+细胞修复大鼠脊髓损伤的效果和机制。方法免疫磁珠法从人新鲜脐血中分离得到CD34+细胞。雌性Wistar大鼠96只,以IMPACTOR MODEL-Ⅱ脊髓损伤打击器建立T10脊髓损伤模型,随机均分为免疫抑制剂应用组、损伤后急性期移植组和损伤后亚急性期移植组,对各组后肢功能恢复情况进行BBB评分,损伤中心行双重免疫荧光染色、2,3,5-氯化三苯基四氮唑(TTC)染色和血管明胶墨汁灌注观察。结果损伤后第8~56天,细胞急性期移植组的BBB评分高于其余2组(P<0.05);TTC染色示组织活力降低区域比例小于其余2组(P<0.01);明胶墨汁灌注示脊髓损伤中心血管密度大于其余2组(P<0.01);亚急性期移植组的细胞存活密度大于急性期移植组(个/视野:7.51±1.00 vs 5.51±0.89,t=6.051,P<0.01),2组均未观察到移植细胞的神经分化。结论人脐血CD34+细胞急性期移植可通过提高脊髓损伤中心血管密度促进微循环恢复,增加组织活力,促进大鼠脊髓损伤后肢体功能恢复。
脊髓损伤;脐血干细胞移植;人脐血CD34+细胞;组织活力;血管密度;神经分化
产业化、规模化、标准化生产的人脐血造血干细胞已于实验研究中证明对脊髓损伤(spinal cord inju⁃ry,SCI)有修复功能[1-2]。分离、纯化人脐血得到的CD34+细胞即人脐血造血干细胞,其免疫原性较低,急慢性移植抗宿主反应概率和程度均较骨髓移植低,并且较骨髓增殖、分化能力强[3],长年冻存影响不大[4],成瘤性较胚胎干细胞低,伦理学争议少,但是人脐血CD34+细胞移植修复SCI的时机、途径和其修复SCI的机制尚未得到深入研究。本实验拟将人脐血CD34+细胞分别在SCI后急性期和亚急性期局部移植入大鼠脊髓T10损伤中心,通过比较不同时期BBB(Basso,Beattie and Bresnahan)评分及病理改变情况,研究人脐血CD34+细胞移植修复SCI的机制及其在损伤局部的存活和神经分化情况。
1 材料与方法
1.1主要试剂小鼠抗人细胞核单克隆抗体(MAB1281,CHEMICON,USA),兔抗人神经元特异性烯醇化酶(NSE)多克隆抗体(武汉博士德生物工程有限公司),兔抗人髓鞘碱性蛋白(MBP)多克隆抗体、兔抗人胶质纤维酸性蛋白(GFAP)多克隆抗体、TRITC-山羊抗小鼠IgG和FITC-山羊抗兔IgG(北京中杉金桥生物技术有限公司),DAPI(北京泛博生物化学公司),环孢霉素A(CsA,杭州中美华东制药有限公司),地塞米松(Dex,天津金耀氨基酸有限公司),2,3,5-氯化三苯基四氮唑(TTC,北京索莱宝科技有限公司)。
1.2动物分组和模型制备雌性Wistar大鼠96只(军事医学科学院四所),10周龄,体质量(250±20)g,用随机数字表法均分成3组:Ⅰ组(免疫抑制剂应用组),CsA+Dex治疗;Ⅱ组(损伤后急性期移植组),损伤后第1天细胞局部移植+CsA+ Dex治疗;Ⅲ组(损伤后亚急性期移植组),损伤后第6天细胞局部移植+CsA+Dex治疗。模型制备:大鼠麻醉后,以脊柱T10节段为中心,切开暴露T9~T11节段,咬除棘突、椎板,显露硬膜,置于IMPACTOR MODEL-Ⅱ脊髓损伤打击器下,参数10 g×25 mm打击T10节段,双后肢抽动、甩尾,随后完全松弛,关闭切口。
1.3细胞移植免疫磁珠分选法从人新鲜脐血中分选CD34+细胞(纯度达90%以上),离心后用磷酸盐缓冲液(PBS)重悬,计数大于1×105/μL。按1.2中的方法暴露Ⅱ组和Ⅲ组大鼠脊髓,于损伤中心头、尾侧间隔4~5 mm取2点,用微量注射器倾斜45°向损伤中心注入2.5 μL细胞悬液,止血关闭切口。
1.4免疫抑制剂使用Ⅰ组和Ⅱ组于损伤当天、损伤后第1、3、5天,Ⅲ组于损伤后第6、7、9、11天灌胃,分别给予CsA 2.5、5.0、5.0、10.0 mg;Ⅰ组和Ⅱ组于损伤后第1、3、5天,Ⅲ组于损伤后第7、9、11天尾静脉注入Dex 0.125 mg。
1.5BBB评分损伤当天、损伤后第8、14、21、28、35、42、49、56天,由未知分组的经过训练的2名人员对3组的各8只大鼠后肢功能恢复情况进行BBB评分。
1.6损伤中心双重免疫荧光染色每组选8只大鼠,于损伤后第21天麻醉后开胸,游离心脏,灌注针头刺入左心室至主动脉,剪开右心耳,PBS、4%多聚甲醛依次灌注后取出脊髓,4%多聚甲醛4℃保存。损伤中心间隔50 μm做5 μm厚冰冻横切片6张。一抗MAB1281(1∶20)和兔抗人NSE(1∶400)[或兔抗人MBP(1∶200)或兔抗人GFAP(1∶200)]混合染色(每种染色组合2张片子),4℃湿盒过夜;二抗TRITC-山羊抗小鼠IgG(1∶1 600)和FITC-山羊抗兔IgG(1∶800)混合染色,37℃孵育1 h后DAPI染色,封片。另行人脐血CD34+细胞悬液染色和PBS替代一抗的损伤中心横切片染色。倒置荧光显微镜下分别以550、490和360 nm波长的激发光观察TRITC、FITC和DAPI染色,每张切片近中心位置读取任意3个400倍视野,数码照相记录后计数各组大鼠染色阳性的细胞数。
1.7损伤中心TTC染色Ⅰ组和Ⅱ组于损伤后第3天,Ⅲ组于损伤后第9天,每组选8只大鼠行心脏穿刺同前,4℃PBS灌注后距脊髓损伤中心上、下各约2 cm处迅速离断取出脊髓,横断损伤中心,2%TTC中37℃避光孵育30 min,4%多聚甲醛4℃固定,手术显微镜(LEICA M501,德国)下观察损伤中心横断面,数码照相记录后计算组织活力降低区域占整个横断面的比例。
1.8血管明胶墨汁灌注损伤后第14天,每组选8只大鼠行心脏穿刺同前,60℃条件下PBS、4%多聚甲醛、明胶墨汁(明胶,New Industry,Canada;墨汁,北京一得阁墨汁)依次灌注后迅速将大鼠置入冰水混合物中,距损伤中心上、下各约2 cm处离断取出脊髓,4%多聚甲醛4℃固定。损伤中心间隔50 μm做5 μm厚冰冻横切片3张,HE染色。显微镜下观察,损伤区域腹侧、背侧各取3个200倍视野,数码照相记录后计算血管面积占整个视野面积的比例作为血管密度。
1.9统计学方法用Image-Pro Plus 6.0专业图像分析软件采集图像并分析;数据统计分析采用SPSS 11.5软件,使用表示,各组BBB评分、TTC染色、脊髓血管明胶墨汁灌注所得数据比较采用单因素方差分析,组间多重比较采用LSD-t法,对损伤中心双重免疫荧光染色所得数据比较采用配对t检验,以P<0.05为差异有统计学意义。
2 结果
2.1BBB评分术前动物毛色洁白有光泽,行动敏捷,对外界反应灵敏。手术前BBB评分双后肢均为21分。损伤后当天,各组大鼠苏醒后均出现双侧后肢瘫痪,BBB评分0分。损伤后第8~56天,各组大鼠BBB评分均呈上升趋势,Ⅱ组评分明显高于其余2组(P<0.05),见表1。
2.2损伤中心双重免疫荧光染色结果各组中均未见到TRITC、FITC和DAPI三阳性细胞,Ⅱ组和Ⅲ组可见到TRITC和DAPI双阳性细胞(存活移植细胞),见图1。Ⅲ组存活移植细胞密度明显大于Ⅱ组(个/视野:7.51±1.00 vs 5.51±0.89,t=6.051,P<0.01)。
Tab.1Comparison of BBB locomotor score after spinal injury between three groups表1 脊髓损伤后各组BBB评分比较(n=8)
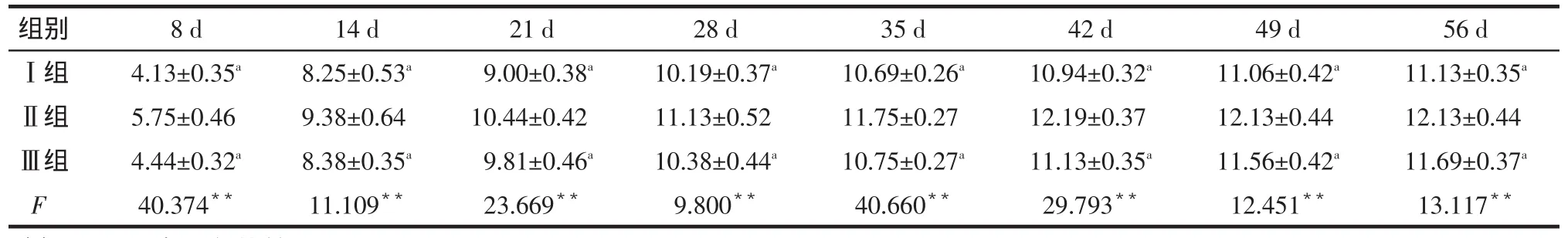
Tab.1Comparison of BBB locomotor score after spinal injury between three groups表1 脊髓损伤后各组BBB评分比较(n=8)
**P<0.01;a与Ⅱ组比较,P<0.05
组别Ⅰ组Ⅱ组Ⅲ组F 56 d 11.13±0.35a 12.13±0.44 11.69±0.37a 13.117**8 d 4.13±0.35a 5.75±0.46 4.44±0.32a 40.374**14 d 8.25±0.53a 9.38±0.64 8.38±0.35a 11.109**21 d 9.00±0.38a 10.44±0.42 9.81±0.46a 23.669**28 d 10.19±0.37a 11.13±0.52 10.38±0.44a 9.800**35 d 10.69±0.26a 11.75±0.27 10.75±0.27a 40.660**42 d 10.94±0.32a 12.19±0.37 11.13±0.35a 29.793**49 d 11.06±0.42a 12.13±0.44 11.56±0.42a 12.451**
2.3损伤中心TTC染色结果脊髓横断面组织活力正常部分色红润、表面平整,灰质色较深,活力降低部分色灰暗,组织水肿表面微凸起,见图2。Ⅱ组组织活力降低区域比例明显小于其余2组(P<0.01),见表2。
Tab.2The proportion of decreased vitality area and the blood vessel density in three groups表2 各组组织活力降低区域比例和损伤中心血管密度(n=8
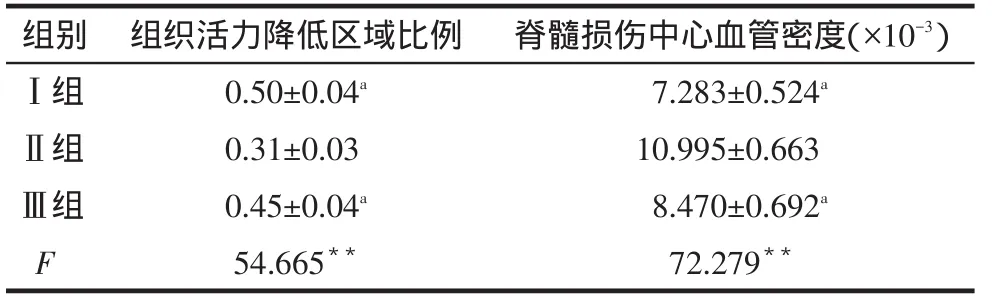
Tab.2The proportion of decreased vitality area and the blood vessel density in three groups表2 各组组织活力降低区域比例和损伤中心血管密度(n=8
**P<0.01;a与Ⅱ组比较,P<0.01
组别Ⅰ组Ⅱ组Ⅲ组F脊髓损伤中心血管密度(×10-3)7.283±0.524a 10.995±0.663 8.470±0.692a 72.279**组织活力降低区域比例0.50±0.04a 0.31±0.03 0.45±0.04a 54.665**
2.4脊髓血管明胶墨汁灌注正常脊髓T10节段多显示血管横截面,灰质较白质密集;损伤脊髓T10节段显示损伤中心血管,见图3。Ⅱ组脊髓损伤中心血管密度明显大于其余2组(P<0.01),见表2。
3 讨论
3.1修复机制细胞移植治疗SCI的机制包括代替坏死或凋亡的神经细胞和改善损伤局部微环境促进轴突再生或保护神经。本实验中未观察到移植后人脐血CD34+细胞的神经分化,结果与Nishio等[2]和Taguchi等[5]的研究结果一致,这3个实验中CD34+细胞的纯度都达到了90%以上,可以减少CD34-细胞中具有神经细胞分化潜力的细胞,如脐血间充质干细胞[6]的干扰。但是,Sigurjonsson等[7]研究发现人骨髓来源的CD34+细胞在鸡胚脊髓环境中可表达神经元特异性抗原微管相关蛋白2和神经元特异性核抗原,提示移植细胞向神经元的分化;Reali等[8]在少突胶质细胞条件培养基中培养的人骨髓CD34+细胞中也发现神经分化,且向各种神经细胞分化的比例受接触界面的影响,可见,CD34+细胞的神经分化受其来源和培养环境的影响。CD34是造血干细胞分化成熟到一定时期共有的抗原标志,又以CD38、 HLA-DR等抗原标志分成具有不同增殖分化能力的细胞亚群,提示以CD34为单一抗原标志分选造血干细胞,不能有效分离不同特性的细胞。对人脐血CD34+细胞的神经分化还需进一步研究,本实验尚不能排除神经替代机制。
TTC可和活细胞线粒体内的琥珀酸脱氢酶反应,生成红色的甲臜,用来表示细胞活力,反映组织血运供氧情况。Kao等[1]制作SD大鼠脊髓T8或T9的压迫损伤模型后立即尾静脉注入人脐血CD34+细胞,损伤中心TTC染色结果显示人脐血CD34+细胞移植组的组织活力降低区域随时间变化显着减小,且明显小于人脐血CD34-细胞移植组、单纯椎板打开组和生理盐水注射组。本实验TTC染色表明人脐血CD34+细胞在SCI后急性期和亚急性期移植均可显着促进损伤中心组织活力恢复,且急性期较亚急性期移植效果明显。
血管明胶墨汁灌注可以对血管进行有效铸型,血管形态保持较好[9]。本实验中应用浓度为10%的明胶不仅灌注充分,而且明胶韧性较好,不易断裂,血管铸型完整。实验结果显示人脐血CD34+细胞移植可以显着提高损伤中心血管密度,且急性期移植较亚急性期移植效果明显。
SCI机制中,原发、继发损伤都会影响组织活力,本实验中,组织活力的恢复、损伤中心血管密度的增大和后肢功能的改善具有一致性,支持人脐血CD34+细胞移植修复SCI的血管修复机制。大量研究表明人脐血CD34+细胞移植修复SCI可能主要通过增强损伤中心血管内皮生长因子(VEGF)的表达从而提高损伤中心血管密度,促进微循环恢复及内源性神经干/祖细胞(NSC/NPCs)的增生、迁移和神经元分化[10-11]。另外,人脐血CD34+细胞还可能通过分泌肝细胞生长因子(HGF)、胰岛素样生长因子(IGF)-1等促进新生血管形成[11]。脐血CD34+细胞含有内皮祖细胞CD34+/Flk-1+细胞[5],在缺氧条件下VEGF表达可诱导其向内皮细胞分化和增生,结构性参与生成缺血组织的新生血管,从而促进微循环恢复。
3.2移植时机SCI后的血液动力学变化在24 h内即可基本恢复正常[12],急性炎症反应在72 h内达到高峰,此后逐渐缓解,慢性炎症反应开始成为损伤后炎症反应的主要特征,这些变化特点影响移植细胞的成活分化。横断的脊髓由于损伤的溶酶体、组织水肿和一些毒性物质的释放可引起脊髓残端变性、坏死和空洞形成,这一过程要维持1周左右。在损伤后1周内移植物可能出现退变甚至坏死,损伤后较长时间移植,神经纤维很难再生通过胶质瘢痕,而在损伤后1周左右移植可以阻止胶质瘢痕生成,利于移植物的生长[13]。研究发现大脑缺血损伤后第3天损伤中心血管内皮增生最明显,第7天已经减弱,2周时接近损伤前水平[5]。毛星刚等[14]通过单宁酸-氯化铁灌注结合形态学和免疫组织化学法观察大鼠正常脊髓和脊髓挤压损伤后不同时间的血管形态变化及其与星形胶质细胞的关系,认为星形胶质细胞一方面可形成胶质瘢痕而成为神经纤维再生的障碍,同时对损伤后血管结构的恢复起到重要作用,而星形胶质细胞与血管广泛关联的建立也预示着血脊髓屏障功能的逐渐恢复,SCI后72 h内可能是治疗SCI后损伤区组织缺血的时间窗。Patel等[15]应用动态对比度增强磁共振成像观察到大鼠SCI后,损伤局部VEGF缓释法对血脊髓屏障通透性的提高及对后肢功能的改善,且Ritz等[16]利用定量RT-PCR发现VEGF在大鼠SCI后局部的持续低表达,尤以SCI后第3天明显;Taguchi等[5]实验证明损伤后48 h内移植人脐血CD34+细胞可促进缺血区域血管新生,保护残留组织,获得功能恢复。以上实验均提示急性期脐血CD34+细胞移植治疗SCI的潜力。
3.3问题与展望本实验表明SCI后急性期人脐血CD34+细胞局部移植可通过提高脊髓损伤中心血管密度促进微循环恢复,增强组织活力,促进大鼠SCI后肢体功能恢复,但缺少对人脐血CD34+细胞移植后促进血管新生的相关因素、因子的深入研究。总之,对已用于临床治疗并且其获取、储存已经产业化、规模化、标准化的人脐血CD34+细胞进行实验性修复脊髓损伤的研究,支持其急性期移植的有效性,具有深入研究的价值和很好的临床应用前景。
(图1~3见插页)
[1]Kao CH,Chen SH,Chio CC,et al.Human umbilical cord blood-derived CD34+cells may attenuate spinal cord injury by stimulating vascular endothelial and neurotrophic factors[J].Shock,2008,29(1):49-55.
[2]Nishio Y,Koda M,Kamada T,et al.The use of hemopoietic stem cells derived from human umbilical cord blood to promote restora⁃tion of spinal cord tissue and recovery of hindlimb function in adult rats[J].J Neurosurg Spine,2006,5(5):424-433.
[3]da Silva CL,Gonçalves R,Porada CD,et al.Differences amid bone marrow and cord blood hematopoietic stem/progenitor cell division kinetics[J].J Cell Physiol,2009,220(1):102-111.
[4]Broxmeyer HE,Srour EF,Hangoc G,et al.High-efficiency recov⁃ery of functional hematopoietic progenitor and stem cells from hu⁃man cord blood cryopreserved for 15 years[J].Proc Natl Acad Sci USA,2003,100(2):645-650.
[5]Taguchi A,Soma T,Tanaka H,et al.Administration of CD34+cells after stroke enhances neurogenesis via angiogenesis in a mouse model[J].J Clin Invest,2004,114(3):330-338.
[6]Achyut BR,Varma NR,Arbab AS.Application of umbilical cord blood derived stem cells in diseases of the nervous system[J].J Stem Cell Res Ther,2014,4:1000202.
[7]Sigurjonsson OE,Perreault MC,Egeland T,et al.Adult human he⁃matopoietic stem cells produce neurons efficiently in the regenerat⁃ing chicken embryo spinal cord[J].Proc Natl Acad Sci USA,2005,102(14):5227-5232.
[8]Reali C,Scintu F,Pillai R,et al.Differentiation of human adult CD34+stem cells into cells with a neural phenotype:Role of astro⁃cytes[J].Exp Neurol,2006,197(2):399-406.
[9]Jianbin T,Liang H,Jufang H,et al.Improved method of ink-gelatin perfusion for visualising rat retinal microvessels[J].Acta Histochem Cytochem,2008,41(5):127-133.doi:10.1267/ahc.08015.
[10]Cain JT,Berosik MA,Snyder SD,et al.Shifts in the Vascular endo⁃thelial growth factor(Vegf)isoforms result in transcriptome changes correlated with early neural stem cell proliferation and differentia⁃tion in mouse forebrain[J].Dev Neurobiol,2014,74(1):63-81.
[11]Majka M,Janowska-Wieczorek A,Ratajczak J,et al.Numerous growth factors,cytokines,and chemokines are secreted by human CD34(+)cells,myeloblasts,erythroblasts,and megakaryoblasts and regulate normal hematopoiesis in an autocrine/paracrine manner[J]. Blood,2001,97(10):3075-3085.
[12]Hamamoto Y,Ogata T,Morino T,et al.Real-time direct measure⁃ment of spinal cord blood flow at the site of compression:relation⁃ship between blood flow recovery and motor deficiency in spinal cord injury[J].Spine,2007,32(18):1955-1962.
[13]Xu XM,Onifer SM.Transplantation-mediated strategies to promote axonal regeneration following spinal cord injury[J].Respir Physiol Neurobiol,2009,169(2):171-182.doi:10.1016/j.resp.2009.07.016.
[14]Mao XG,Shen XF,Kuang F,et al.Changes of vessels and their associ⁃ation with astrocytes in injury site of adult rats after spinal cord inju⁃ry[J].Chin J Neuromed,2007,6(5):433-436.[毛星刚,沈学锋,邝芳,等.成年大鼠脊髓损伤后损伤区血管变化及其与星形胶质细胞的关系[J].中华神经医学杂志,2007,6(5):433-436].
[15]Patel CB,Cohen DM,Ahobila-Vajjula P,et al.Effect of VEGF treatment on the blood-spinal cord barrier permeability in experi⁃mental spinal cord injury:dynamic contrast-enhanced magnetic res⁃onance imaging[J].J Neurotrauma,2009,26(7):1005-1016.
[16]Ritz MF,Graumann U,Gutierrez B,et al.Traumatic spinal cord in⁃jury alters angiogenic factors and TGF-beta1 that may affect vascu⁃lar recovery[J].Curr Neurovasc Res,2010,7(4):301-310.
(2014-12-12收稿 2015-02-12修回)
(本文编辑 闫娟)
Experimental study on repairing spinal cord injury by human umbilical cord blood CD34+cell transplantation at different time points
TANG Liang1,2,FENG Shiqing1△,GAO Ruixiao2
1 Tianjin Medical University General Hospital,Tianjin 300052,China;2 Department of Orthopaedics,Tianjin Haihe Hospital△
ObjectiveTo investigate the effect of transplantation of human umbilical cord blood CD34+cells on spinal cord injury.MethodsCD34+cells were separated from fresh human umbilical cord blood by magnetic cell sorting.Ninetysix female Wistar rats were injured at T10 by IMPACTOR MODEL-Ⅱ,and then randomly assigned to three groups:Cyclo⁃sporin A(CsA)+Dexamethasone(Dex)treated group(Ⅰ,n=32),local transplantation of cells+CsA+Dex treated group(Ⅱ)at the first day after operation(DAO 1,n=32),local transplantation of cells+CsA+Dex treated group(Ⅲ)at DAO 6(n=32). BBB locomotor scoring system was used to assess the recovery of the lower limbs.The survival and neural differentiation of transplanted cells at the injury site were observed by double immunofluorescence.The tissue vitality at the injury site was ob⁃served by 2,3,5-triphenyl-2H-tetrazolium chloride(TTC)staining,and the blood vessel density was observed by infusing mixture of Chinese ink and glutin followed by HE staining.ResultsBBB score at DAO 8-56 was significantly higher inⅡgroup than that of other two groups(P<0.05).TTC staining showed that the proportion of decreased vitality area was signifi⁃cantly smaller inⅡgroup than that of other two groups(P<0.01).The result of gelatin ink perfusion showed that the blood vessel density at the injury site was significantly bigger inⅡgroup than that of other two groups(P<0.01).There were more survival transplanted cells inⅡgroup than those of III group(per visual field,7.51±1.00 vs 5.51±0.89,t=6.051,P<0.01). All the transplanted cells didn’t differentiate into neural cells.ConclusionHuman umbilical cord blood CD34+cells can promote the recovery of the lower limbs after spinal cord injury by repairing blood vessels to increase tissue vitality at the in⁃jury site in rats.
spinal cord injury;cord blood stem cell transplantation;human umbilical cord blood CD34+cells;tissue vitality;blood vessel density;neural differentiation
R681.5
A
10.11958/j.issn.0253-9896.2015.07.013
天津市科学技术委员会科技计划项目(08ZCKFSF03200);教育部新世纪人才支持计划(NCET-06-0251)
1天津医科大学总医院(邮编300052);2天津市海河医院骨科
唐亮(1982),男,主治医师,在职博士研究生在读,主要从事脊柱脊髓损伤、脊柱退行性疾病、脊柱结核研究
△通讯作者E-mail:fengsq@hotmail.com



