李浩,马勃,李志强,王启弘
犬动脉瘤动物模型的血流动力学分析
李浩1,2,马勃3,李志强2△,王启弘4
目的探讨建立稳定、理想、快捷的颅内动脉瘤模型的方法,为动脉瘤的相关研究提供可靠的动脉瘤模型。方法在改良的外科显微技术条件下制作侧壁型、分叉部、末端型和真性合并假性囊状动脉瘤,每种类型各7只。术后2周行彩色多普勒超声仪、磁共振成像(MRI)、磁共振血管成像(MRA)、数字减影动脉血管造影(IADSA)检查,进行动脉瘤模型的计算机流体力学(CFD)模拟分析。采用体外细胞培养的方法,对动脉瘤壁的组织生物力学特性进行分析,以微弹簧圈(MC)紧密填塞动脉瘤并再次进行上述检查。结果所有模型均获得成功,MC瘤腔栓塞能取得良好效果。培养证实血管内皮细胞(VEC)的体外增殖情况良好,并成功将VEC贴附于高分子可降解材料表面,进而生长成VEC层结构。对栓塞前后的动脉瘤模型进行了血流动力学分析,获得了相关的血流动力学参数,动脉瘤内的血流速度为2~7 cm/s,动脉瘤载瘤动脉内的血流速度为8~26 cm/s。结论建立了稳定、理想、快捷的颅内动脉瘤模型,可为动脉瘤的相关研究提供可靠的动脉瘤模型。
血流动力学;颅内动脉瘤;动物模型
颅内动脉瘤(aneurysm,AN)是动脉管壁病理性局限性扩张产生的脑血管瘤样突起,其破裂是引起人类自发性蛛网膜下腔出血的首位原因(约占79%~89%),占颅内出血的25%[1],其病死率及致残率极高,严重影响着人们的健康和生命,是人类猝死的重要原因之一[2]。动脉瘤一旦产生,便存在生长、
血栓形成和破裂的风险,称之为“动脉瘤行为”。动脉瘤行为与其内部的血流动力学的一些因素如血流状态、切应力、动脉压、搏动性血流等与血管壁本身的支撑力均有密切关系[1],是多个力学因素相互作用的结果。颅内动脉瘤的血流动力学研究对于疾病的控制和治疗具有重要意义。用人体作为实验材料进行研究很难实施,相关颅内动脉瘤动物模型已有研究,但较为复杂,可操作性不强。因此建立一个能够科学使用的、可供实验要求选择的、稳定理想的动脉瘤动物模型具有重要的现实意义[3]。本研究建立了4种不同类型的动脉瘤模型,并在不同血流模式下研究血流状态、切应力、压力及速度等参数与不同类型动脉瘤生长和破裂的关系,以确定不同类型动脉瘤腔内的血流动力学参数,以期为提高手术和介入栓塞动脉瘤的治疗效果提供依据。
1 材料与方法
1.1 建立不同类型的动脉瘤模型9~12 kg杂种犬28只,雌雄不限,4%戊巴比妥钠(1 mL/kg体质量)腹腔注射麻醉后仰卧位固定,暴露颈部皮下的颈外静脉(EJV)及左右两侧深部的颈总动脉(CCA)。取出EJV备用,阻断CCA的远近端血流,在显微镜下,将犬的EJV囊吻合到CCA侧壁,参照文献[4]制作成4类动脉瘤模型:侧壁型、分叉部、末端型以及真性合并假性囊状动脉瘤,每种类型7只。
1.2 血管内皮细胞(VEC)的培养以及微弹簧圈(MC)的构建取犬的颈静脉,应用组织贴块法进行原代培养,经凝血Ⅷ因子相关抗原免疫组化染色证实,用传3~5代的细胞进行实验。噻唑蓝(MTT)法测光吸收值以检测VEC的增殖活性。扩增VEC,培养于多孔复合膜(MC)上,测算出VEC在聚合结构中最佳的细胞密度。将培养的内皮细胞种在Aga⁃rose上,24 h后,内皮细胞聚集成团。吸出内皮细胞至离心管内,离心后,小心吸出上清。用DMEM(含0.05 mol/L NaOH、200 mmol/L HEPES以及260 mmol/L NaHCO3)重悬细胞,接种于高分子可降解材料表面。次日检测细胞黏附情况。参照Zund方法[3],MTT法测定深紫色产物甲臜含量,以反映VEC的黏附与生长情况。
1.3 在不同血流动力学条件下进行动脉瘤血流动力学分析彩超检查后,对形成动脉瘤模型的犬行股动脉穿刺,通过微导管进入动脉瘤内,测量4类动脉瘤内的压力并行数字减影血管造影(DSA)检查腔内形态改变。控制性低血压:采用吸入性麻醉剂异氟醚,用量随血压的控制而增减,控制平均动脉压(MAP)由基础值的17 kPa降至6 kPa。保持低血压水平30~60 min后检查。
1.4 栓塞后动脉瘤模型的血流动力学研究(1)影像学检查:对形成侧壁型、分叉部和末端型动脉瘤模型的犬行股动脉穿刺,通过微导管将MC紧密填塞于动脉瘤内,DSA检查填塞瘤腔情况。(2)栓塞后动脉瘤的力学评价:观察内皮细胞在细胞外基质中的生长、代谢及生物力学改变。(3)进行动脉瘤模型的计算机流体力学(CFD)模拟分析:根据不同类型动脉瘤动物模型的血液流动特性的流线图和速度梯度图,分析瘤口的近端、瘤顶和远端壁面受到的压力和切应力。
2 结果
2.1 建模结果术后所有动物全部存活,术后1周行DSA血管造影检查发现成功长出动脉瘤。成功地建立了侧壁型、分叉部、末端型以及真性合并假性囊状动脉瘤(操作真性合并假性囊状动脉瘤时,血管壁出现一个血泡,故没有拍照),最大直径约5.0 mm,见图1。
2.2 VEC培养及MC构建结果VEC体外增殖情况良好,见图2。VEC体外血管形成实验证实VEC能够贴附于高分子可降解材料表面,见图3。
2.3 栓塞前后动脉瘤模型的血流动力学结果动脉瘤内的血流速度为2~7 cm/s,动脉瘤载瘤动脉内的血流速度为8~26 cm/s。适当角度能够清楚显示AN和动脉,见图4。能够检测到血流从右至左流动,颜色由深至浅代表速度由快至慢。对动脉瘤模型CFD模拟分析后,获得速度梯度图(示动脉瘤及其附近的血流速度变化),见图5。远端、瘤顶、近端壁面受到的压力和切应力的测得数值见图6、7。可见,动脉瘤瘤顶的压力高、切应力最低;近端流入道部分的压力普遍较高,压力的最高值也出现在这一段,而且切应力最高。同样对栓塞后的动脉瘤分析获得速度梯度图,见图8。左CCA造影显示左CCA侧壁型囊状AN,在附近可看到合并假性AN,见图9。

Fig.4DSA angiography of canine aneurysm models图4 犬动脉瘤模型DSA血管造影
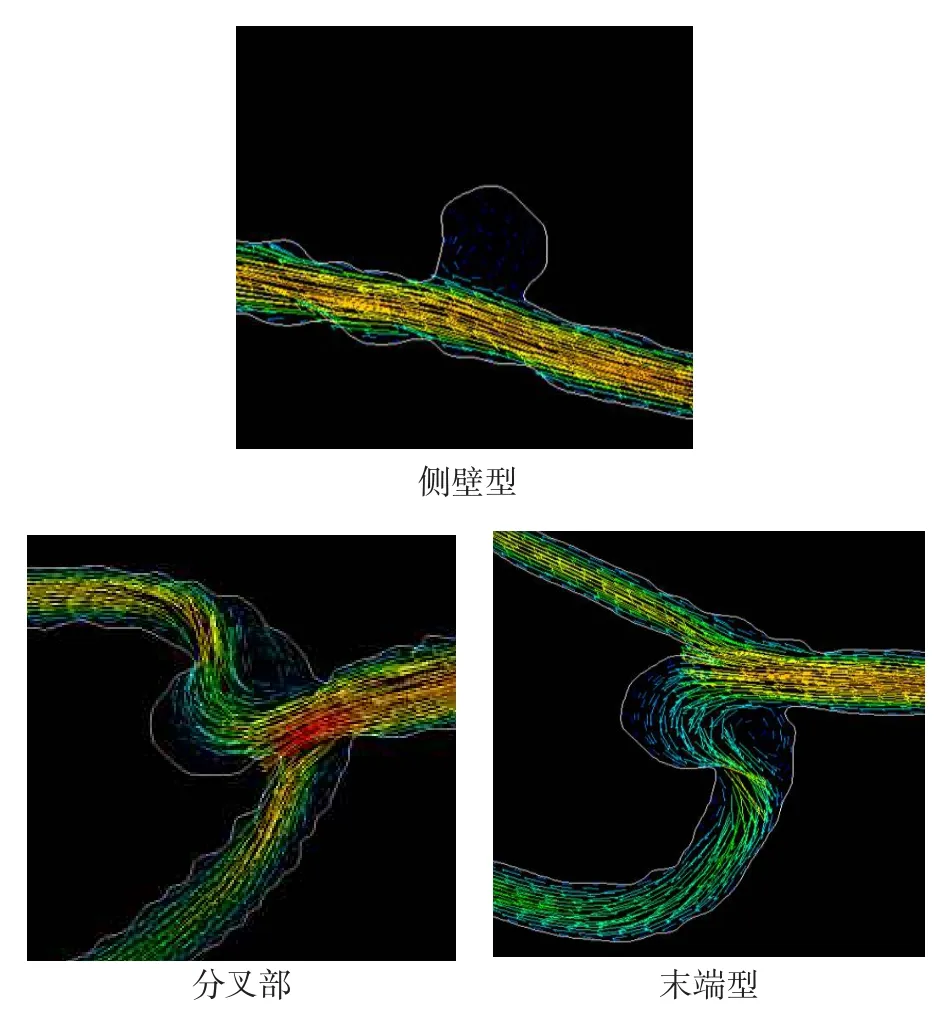
Fig.5Constant speed gradient map of canine aneurysm model图5 犬动脉瘤模型定常速度梯度图
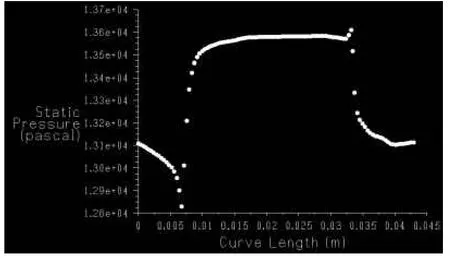
Fig.6Distribution curve of bifurcation aneurysm wall pressure(absolute value)that changes along curve of tumor wall(distal→tumor top→proximal)图6 分叉部动脉瘤瘤壁上压力(绝对值)随瘤壁曲线长度(由远端→瘤顶→近端)变化的分布曲线
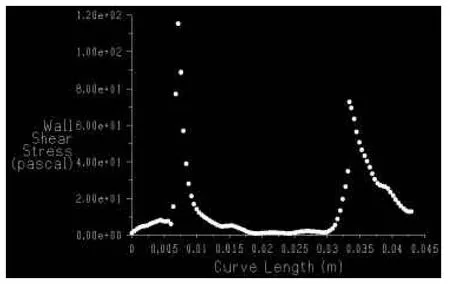
Fig.7Distribution curve of bifurcation aneurysm tumor wall shearing stress(absolute value)that changes along curve of tumor wall(distal→tumor top→proximal)图7 分叉部动脉瘤瘤壁上切应力(绝对值)随瘤壁曲线长度(由远端→瘤顶→近端)变化的分布

Fig.8Constant speed gradient map of genuine combined with pseudo canine aneurysm model图8 犬真性合并假性动脉瘤模型定常速度梯度图
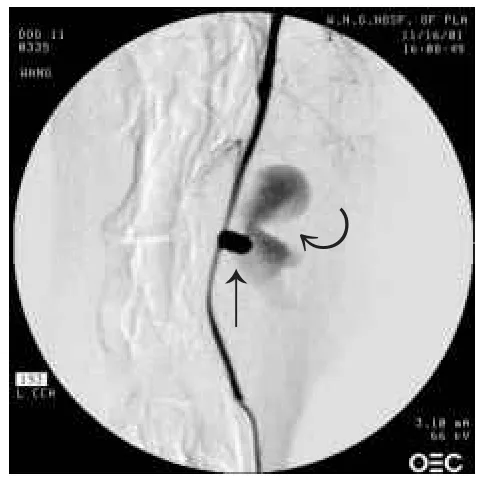
Fig.9Saccular intracranial aneurysm of the left common carotid artery(side wall type indicated by straight arrow)which combined false intracranial aneurysm(curved arrow)detected by the left carotid artery angiography图9 左颈总动脉侧壁型囊状颅内动脉瘤(直箭头)合并假性颅内动脉瘤(弯箭头)
3 讨论
颅内动脉瘤是中老年人群常见的神外急症。它引起的蛛网膜下腔出血、脑血管意外的发生率日渐升高。为探寻人类颅内动脉瘤的病因,很多研究者设计了多种动脉瘤模型,如静脉囊袋移植动脉瘤模型[5],利用弹性蛋白酶消化颈动脉残端动脉瘤模型[6-7],但这些模型与人类动脉瘤生成没有因果关系,仅适合栓塞材料等方面的研究,不适合病因学研究。此外,还有利用血流动力学改变如结扎颈总动脉,结合诱导高血压和破坏弹力纤维诱导大鼠、小鼠颅内动脉瘤模型[8-9],但这些小动物模型的脑血管过于细小,无法进行血流动力学研究。而灵长类如猴动脉瘤动物模型因伦理问题及费用昂贵等问题难以广泛应用[10]。犬颈总动脉直径与人类大脑中动脉起始段非常接近,同时凝血系统与人类相当接近;单纯改变血流动力学从病因学上更符合人类动脉瘤的发病特点[11]。
本研究选取28只健康犬,在双侧颈动脉成功制作4种囊性动脉瘤模型。术后实验动物均健康成活,无明显神经系统并发症。颅内动脉血管壁由完整的内弹力层、相对薄的中膜及外膜构成。这种结构特征一旦出现完整性破坏很容易形成动脉瘤[12-13]。血流动力学不稳定是早期颅内动脉瘤发生和破裂的重要因素[14]。制作这种动脉瘤模型可行性高,术后
存活率较高,适合常规实验研究。通过犬颈总动脉结扎,增加基底动脉顶端血流动力学,不附加其他任何危险因素,能够诱导出颅内动脉瘤。这与人颅内血管偶然闭塞或外科手术闭塞后其他血管血流增加,逐渐形成颅内动脉瘤的机制一致[15]。
本实验采用多种影像学技术检查该模型,不仅能显示动脉瘤的位置、形态、类型、瘤颈和瘤体的伸展方向,而且可明确动脉瘤内的血流方向、状态和与周围动脉的关系。微弹簧圈栓塞和血栓闭塞动脉瘤后可阻止载瘤动脉的血流继续进入瘤体,清除异常血流,使整个瘤体不再显影。各种影像学技术相比较,DSA既能清楚地显示AN,又能清晰地反映其与载瘤动脉的关系。
脑内动脉血管组织结构上的特点为中层平滑肌较少,弹力纤维贫乏,外膜很薄,这种血管的收缩力较弱,而扩张性却很强[16]。彩超可以诊断AN,也可以观察其大小及空间位置,并同时了解颅内血流动力学的改变。从彩超和定常速度梯度图可以看出,末端型AN中的血流沿动脉的中心线经AN口流入,沿AN的对侧边缘流出,几乎全部流进最接近AN口边缘的那支动脉。瘤腔内血流速度快,且呈旋转方式,其中心没有慢速的涡流。这种模型更易接受载瘤动脉血流的冲击,因而有生长和破裂的倾向,故血流动力学方面能模仿相对多发的颅内分叉部AN和基底动脉顶端AN。本实验对于4种动脉瘤进行了影像学和血流动力学方面的研究,为这类疾病的临床诊治提供了参考。
(图1~3见插页)
[1]Girardi LN,Rabotnikov Y,Avgerinos DV.Preoperative percutaneous coronary intervention in patients undergoing open thoracoabdominal and descending thoracic aneurysmrepair[J].J Thorac Cardiovasc Surg,2013,147(1):163-168.doi:10.1016/j.jtcvs.2013.09.008.
[2]Cebral JR,Pergolizzi RS,Putman CM.Computational fluid dynam⁃ics modeling of intracranial aneurysms:qualitative comparison with cerebral angiography[J].Acad Radiol,2007,14(7):804-813.
[3]Zund G,Ye Q,Hoerstrup SP,et al.Tissue engineering in cardiovas⁃cular surgery:MTT,a rapid and reliable quantitative method to as⁃sess the optimal human cell seeding on polymeric meshes[J].Eur J Cardiothorac Surg,1999,15(4):519-524.
[4]Zhang XH,Chen JH,Wang XF,et al.Application of dual volume re⁃construction technique in embolization of intracranial aneurysms[J]. Med J Chin PLA,2014,39(2):144-148.[张祥海,陈金华,王晓峰,等.双容积重建技术在颅内动脉瘤栓塞术中的应用研究[J].解放军医学杂志,2014,39(2):144-148].doi:10.11855/j.issn.0577-740 2.2014.02.13.
[5]Zhang Z,Yang K,Wang C,et al.Congenital pial arteriovenous fistula in the tem poral region draining into cavernous sinus:a case report[J]. Korean J Radiol,2013,14(3):497-500.doi:10.3348/kjr.2013.14.3.497.
[6]Plowman RS,Clarke A,Clarke M,et al.Sixteen-year single-surgeon experience with coil embolization for ruptured intracranial aneurysms: recurrence rates and incidence of late rebleeding.Clinical article[J]. J Neurosurg,2011,114(3):863-874.doi:10.3171/2010.6.JNS09 1058.
[7]Chen C,Li Q,Tao J,et al.The use of contrast-enhanced ultra⁃sound in the treatment of limb pseudoaneurysm with percutane⁃ous prothrombin injection[J].Med J Chin PLA,2014,39(1):40-44.[陈重,李茜,陶杰,等.超声造影在经皮注射凝血酶原治疗肢体假性动脉瘤中的应用[J].解放军医学杂志,2014,39(1):40-44].doi:10.11855/j.issn.0577-7402.2014.01.09.
[8]Wang CH,Xie XD,Liu Y,et al.Establishment of saccular aneu⁃rysms models of carotid arteries in chinese rural dogs[J].Journal of Chengdu Medical College,2014,9(3):245-248.[王朝华,谢晓东,刘翼,等.犬颈动脉囊性动脉瘤模型构建与血流动力学观察[J].成都医学院学报,2014,9(3):245-248].doi:10.3969/j.issn.1674-2257.2014.03.001.
[9]Zhou JH,Xu SS,Fang XG,et al.Preliminary study of the repair process in elastase-induced aneurysms in rabbits[J].Acta Academiae Me⁃dicinae Wannan,2013,32(4):267-270.[周加浩,徐善水,方兴根,等.弹力酶诱导兔动脉瘤模型修复过程初步研究[J].皖南医学院学报, 2013,32(4):267-270].doi:10.3969/j.issn.1002-0217.2013.04. 004.
[10]Vlak MH,Algra A,Brandenburg R,et al.Prevalence of unrup⁃tured intracranial aneurysms,with emphasis on sex,age,comorbidi⁃ty,country,and time period:a systematic review and meta-analysis[J].Lancet Neurol,2011,10(7):626-636.
[11]Nieuwkamp DJ,Setz LE,Algra A,et al.Changes in case fatality of aneurysmalsubarachnoid haemorrhage over time,according to age,sex,and region:a meta-analysis[J].Lancet Neurol,2009,8(7):635-642.
[12]Bouzeghrane F,Naggara O,Kallmes DF,et al.In vivo experimental intracranialaneurysm models:a systematic review[J].AJNR Am J Neuroradiol,2010,31(3):418-423.doi:10.3174/ajnr.A1853.
[13]Liu D,Zeng M,Zhang A,et al.The fluid-structure interaction anal⁃ysis of intracranial aneurysm model based on volume CT digital sub⁃traction angiography[J].Med J Chin PLA,2014,39(11):888-892.[刘丹,曾鸣,张翱,等.基于VCTD SA数据的颅内动脉瘤模型流固耦合分析[J].解放军医学杂志,2014,39(11):888-892].doi: 10.11855/j.issn.0577-7402.2014.11.09.
[14]Metaxa E,Tremmel M,Natarajan SK,et al.Characterization of critical hemodynamics contributing to aneurysmal remodeling at the basilar terminus in a rabbit model[J].Stroke,2010,41(8):1774-1782.
[15]Fourtrakis CF,Yonas H,Sclabassi RJ.Saccular aneurysm formation in curved and bifurcating arteries[J].AJNR,1999,20:1309-1317.
[16]Huang QL,Li MH,Jiang QH,et al.Relationship between Aneurysm clip position and aneurysm model[J]Shandong Medicine,2013,53(40):28-30.[黄乾亮,李美华,蒋秋华,等.动脉瘤夹位置与动脉瘤模型的关系[J].山东医药,2013,53(40):28-30].doi:10.3969/ j.issn.1002-266X.2013.40.009.
(2015-02-26收稿 2015-05-01修回)
(本文编辑 闫娟)
Haemodynamic analysis in canine aneurysm model
LI Hao1,2,MA Bo3,LI Zhiqiang2△,WANG Qihong4
1 Southern Medical University,Guangzhou 510515,China;2 Fengxian Hospital Affiliated to Southern Medical University;3 Anhui Science and Technology University,Department of Pathogenology and Immunology;4 Ruijin Hospital Affiliated to Shanghai Jiaotong University School of Medicine△
ObjectiveTo explore a way to establish a stable,ideal and handy intracranial aneurysm model for related studies.MethodsModified microsurgery technology was applied to establish sidewall,bifurcation,terminal and merged types of aneurysm(n=7 in each type).Two weeks after operation,color Doppler ultrasound,magnetic resonance imaging(MRI),magnetic resonance angiography(MRA)and intra-arterial digital subtraction angiography(IADSA)were performed and computational fluid dynamics(CFD)was used for simulation analysis of aneurysm models.Biomechanical properties of aneurysm wall tissues was analyzed by cell culture,then the above examinations were performed again after the aneurysm was embolized by micro coil(MC).ResultsAll models were successfully established,and the MC embolization of aneurysm cavity achieved good efficacy.Vascular endothelial cells(VECs)proliferate well in vitro,and the VECs adhered to the sur⁃face of biodegradable polymeric materials successfully and grow into VEC layer structure.Hemodynamics analysis was per⁃formed in aneurysms model before and after embolization and relevant hemodynamic parameters was obtained.,Blood flow velocity are 2-7 cm/s in aneurysm and 8-26 cm/s in its parental artery.ConclusionA stable,ideal and handy intracranial aneurysm model was established and are essential in aneurysm related research.
hemodynamics;intracranial aneurysm;animal models
R743.4
A
10.11958/j.issn.0253-9896.2015.10.013
国家自然科学基金资助项目(30872676)
1南方医科大学,广州(邮编510515);2南方医科大学附属奉贤医院(上海交通大学附属第六人民医院南院)神经外科;3安徽理工大学病原免疫学教研室;4上海交通大学医学院附属瑞金医院神经外科
李浩(1988),男,硕士在读,主要从事脑血管病和脑肿瘤基础与临床研究
△通讯作者E-mail:zhiqiangli2013@126.com



