梁雅灵,陈娇,龙洋,李衍辉,黎秋晗,范芳,徐勇
去泛素化酶A20在糖尿病肾病大鼠肾脏及脂多糖诱导的系膜细胞中的表达及变化
梁雅灵,陈娇,龙洋,李衍辉,黎秋晗,范芳,徐勇
摘要:目的观察去泛素化酶A20在糖尿病肾病(DN)大鼠肾脏及脂多糖(LPS)诱导的系膜细胞中的表达变化及可能的作用机制。方法 (1)Wistar雄性大鼠30只,随机均分为2组,模型组给予链脲佐菌素(STZ)60 mg/kg腹腔注射建立早期DN大鼠模型;对照组给予60 mg/kg枸椽酸缓冲液腹腔注射。分析2组6、8周时血糖和尿微量白蛋白变化。HE染色分析2个时间点的肾脏病理变化。采用免疫组化检测A20在肾脏中的表达。(2)体外培养肾脏系膜细胞,采用不同时间(0、2、4、6、12、24、48、72 h)和不同浓度(0.1、1、10 μg/L)的LPS处理细胞后,检测A20、核因子(NF)-κB、核因子κB抑制因子(IκB)、IκB激酶γ(IKKγ)、单核细胞趋化蛋白(MCP)-1蛋白及基因的表达变化。结果 (1)模型组较对照组血糖和尿微量白蛋白含量均升高(均P<0.01)。模型组肾小管上皮细胞呈玻璃样变,8周时更明显。模型组较对照组A20蛋白在肾小管表达明显减弱,而肾小球中基本无表达,8周时表达更少。(2)IKKγ不同浓度与时间下差异均无统计学意义。与0 h相比,2、4 h时A20蛋白和基因水平呈高表达,6 h后表达降低(均P<0.05);各时间点NF-κB表达水平均较0 h增高,IκB表达均降低(均P<0.05)。A20和IκB的蛋白和基因表达呈浓度依赖性降低(均P<0.05),NF-κB蛋白和基因以及MCP-1基因表达呈浓度依赖性升高(均P<0.05)。结论A20可通过调节NF-κB信号通路来导致炎症信号通路的持续激活,可能在DN的发生发展中发挥作用。
关键词:糖尿病肾病;肾小球系膜细胞;脂多糖类;血糖;NF-κB;尿微量白蛋白;A20基因
糖尿病肾病(diabetic nephropathy,DN)是糖尿病一种严重的微血管并发症。免疫炎症反应是DN起病的中心环节,在DN早期肾组织中可见大量炎症因子增加[1]。核因子(NF)-κB为炎症调节的关键核转录因子,可调节多种炎性因子的表达。笔者前期研究也发现,NF-κB在DN发生发展中起重要作用,泛素化修饰在NF-κB信号通路的活化中起重要调节作用[2]。NF-κB信号受泛素化和去泛素化共同调控,两者处于动态平衡。在众多调控NF-κB信号的去泛素化酶中,去泛素化酶A20又称肿瘤坏死因子α诱导蛋白3(tumor necrosis factor,alp-induced protein 3,TNFAIP3),是NF-κB信号的主要负性调控因子和炎症抑制因子[3]。目前,A20在1型糖尿病(T1DM)起病中的重要作用已被肯定[4],但是A20在2型糖尿病(T2DM)和DN中的作用研究尚少见相关报道。本研究旨在探讨A20在DN动物模型以及脂多糖(LPS)诱导的系膜细胞炎症反应中的作用和可能的作用机制。
1 材料与方法
1.1一般资料SPF级Wistar雄性大鼠30只,体质量(175± 5)g,6~8周龄,购自重庆腾鑫生物技术有限公司。大鼠肾小球系膜细胞(HBZY-1)购自复旦IBS细胞资源中心;Mini-P3垂直电泳仪、Western blot仪器、紫外凝胶成像分析系统购自Bio-Rad公司;恒温细胞培养箱和高温低速离心机购自Thermo公司;A20、NF-κB、核因子κB抑制因子(inhibitor of nuclear factor-kappa B,IκB)、IκB激酶γ(IκB kinase,IKKγ)、单核细胞趋化蛋白(monocyte chemotactic protein,MCP)-1、GAPDH的PCR引物序列由上海生工生物合成。A20/TNFAIP3兔抗大鼠多克隆抗体、NF-κB p65小鼠抗大鼠多克隆抗体和IκB小鼠抗大鼠多克隆抗体(Cell Signaling公司),IKKγ兔抗大鼠单克隆抗体(abcam公司),β-actin小鼠抗大鼠单克隆抗体、辣根过氧化物酶标记山羊抗小鼠IgG、辣根过氧化物酶标记山羊抗兔IgG和蛋白预染Maker(碧云天生物技术研究所)。Trizol试剂盒(TIANGEN公司)、化学发光试剂盒和PVDF膜(Millipore公司)、RT-PCR试剂盒(博瑞克生物技术有限公司)。
1.2动物模型制作及分组30只大鼠于18~29℃室温、40%~70%相对湿度下自由饮水、分笼适应性喂养1周。随机分为模型组(15只)及对照组(15只),禁食不禁水12 h。模型组给予链脲佐菌素(STZ)60 mg/kg腹腔注射;对照组给予60 mg/kg枸椽酸缓冲液腹腔注射。1周后检测各组血糖含量,模型组连续3 d血糖>16.7 mmol/L,判定为成功构建糖尿病模型[5]。造模成功12只,第6周和第8周2组分别处死模型组和对照组大鼠各6只,处死前空腹24 h,收集尿液和血样,分别检测血糖含量和尿微量白蛋白。2组于第6、8周无菌条件下迅速取出右肾上半部,用4%中性甲醛固定,乙醇脱水、氯仿透明、浸蜡、石蜡包埋,用切片机切成4 μm厚的石蜡切片,行HE染色,光学显微镜(×200)下观察大鼠肾脏形态学变化。
1.3免疫组化法观察A20表达情况石蜡切片脱蜡至水,高温蒸汽抗原修复后滴加5%BSA封闭液,弃去封闭液后,滴加兔抗大鼠A20抗体(1∶80)50 μL,充分覆盖切片,4℃冰箱孵育过夜,次日PBS漂洗后。加羊抗兔抗体50 μL。37℃湿盒孵育1 h,DAB显色、苏木素复染、脱水透明封片,于光学显微镜(×200)下观察,A20阳性表达者呈棕黄色。
1.4细胞培养与分组大鼠肾小球系膜细胞(HBZY-1)置于含10%的胎牛血清,体积分数1%的青/链霉素的DMEM低糖培养基中,于37℃和5%CO2恒温细胞培养箱培养,待细胞融合为70%~80%时将其接种于6孔板,培养24 h,将1 mL 的10 μg/L LPS添加其中,0、2、4、6、12、24、48、72 h收集细胞。在接种的另外的6孔板中,选取12 h这个时间点再分别用不同浓度(0.1、1、10 μg/L)的LPS作用细胞后同样收集细胞。
1.5Western blot检测A20、NF-κB、IκB及IKKγ蛋白表达水平将细胞所提蛋白经12%SDS-PAGE进行电泳,并且转膜、封闭、加一抗孵育(一抗稀释浓度分别是A20为1∶600、NF-κB为1∶2 000、IκBα为1∶1 000、IKKγ为1∶5 000、β-actin为1∶2 000),4℃孵育过夜;次日加入二抗孵育,二抗稀释浓度分别为:羊抗兔按1∶2 000,羊抗鼠按1∶3 000,室温孵育1 h;洗膜后加入ECL发光液显色,结果用凝胶定量分析软件Quantity One 4.62分析A20、NF-κB、IκB、IKKγ的灰度值,并以β-actin的灰度值作为内参校正。
1.6半定量PCR检测A20、NF-κB及IκB等表达水平利用Trizol法从细胞内提取总RNA,反转录为cDNA,再于PCR反应管中扩增,引物见表1。扩增程序为:94℃预变性5 min;94℃变性30 s,56℃退火20 s,72℃延伸30 s,30个循环。PCR产物使用2%琼脂糖凝胶进行电泳,将琼脂糖凝胶放入紫外成像仪,用Quantity One软件分析A20、NF-κB、IκB、IKKγ、MCP-1的灰度值,并以GAPDH的灰度值作为内参校正。

Tab.1 Primer sequences of A20,NF-κB,IκB,IKKγ and MCP-1表1 A20、NF-KB、IKKγ、IKB、MCP-1引物序列基因
1.7统计学方法采用SPSS 16.0统计软件进行数据处理分析。符合正态分布的计量资料以x±s表示,2组间均数比较采用t检验,组内不同时点比较用配对t检验,多组间均数比较采用单因素方差分析,组间多重比较用LSD-t法。P<0.05为差异有统计学意义。
2 结果
2.12组血糖、尿微量白蛋白及HE染色结果比较第6周和第8周,模型组的血糖和尿微量白蛋白含量较对照组均升高(均P<0.01);且第8周与第6周相比,模型组的尿微量白蛋白含量明显增高(P<0.05),但血糖含量差异无统计学意义(P>0.05),见表2。6周和8周时,模型组较对照组肾小球系膜细胞和内皮细胞轻度增生,肾小球体积增大,肾小管上皮细胞稍呈玻璃样变;模型组8周较6周肾小球体积进一步增大,肾小管上皮细胞玻璃样变更加明显,见图1。
2.2A20表达分析对照组肾脏组织中可见A20蛋白表达在肾小管上皮细胞内表达较强,肾小球中较弱,6周与8周表达量无明显改变;而模型组可见在肾小管表达明显减弱,肾小球中基本无表达,且8周较6周肾小管及肾小球中表达量明显减少,见图2。
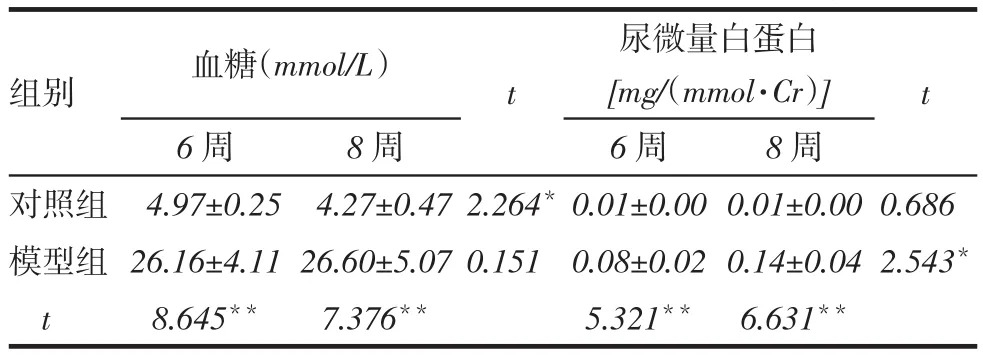
Tab.2 Changes of blood glucose and urinarymicro albumin in model group and control group表2 模型组与对照组血糖和微量蛋白量变化 (n=12,x±s)
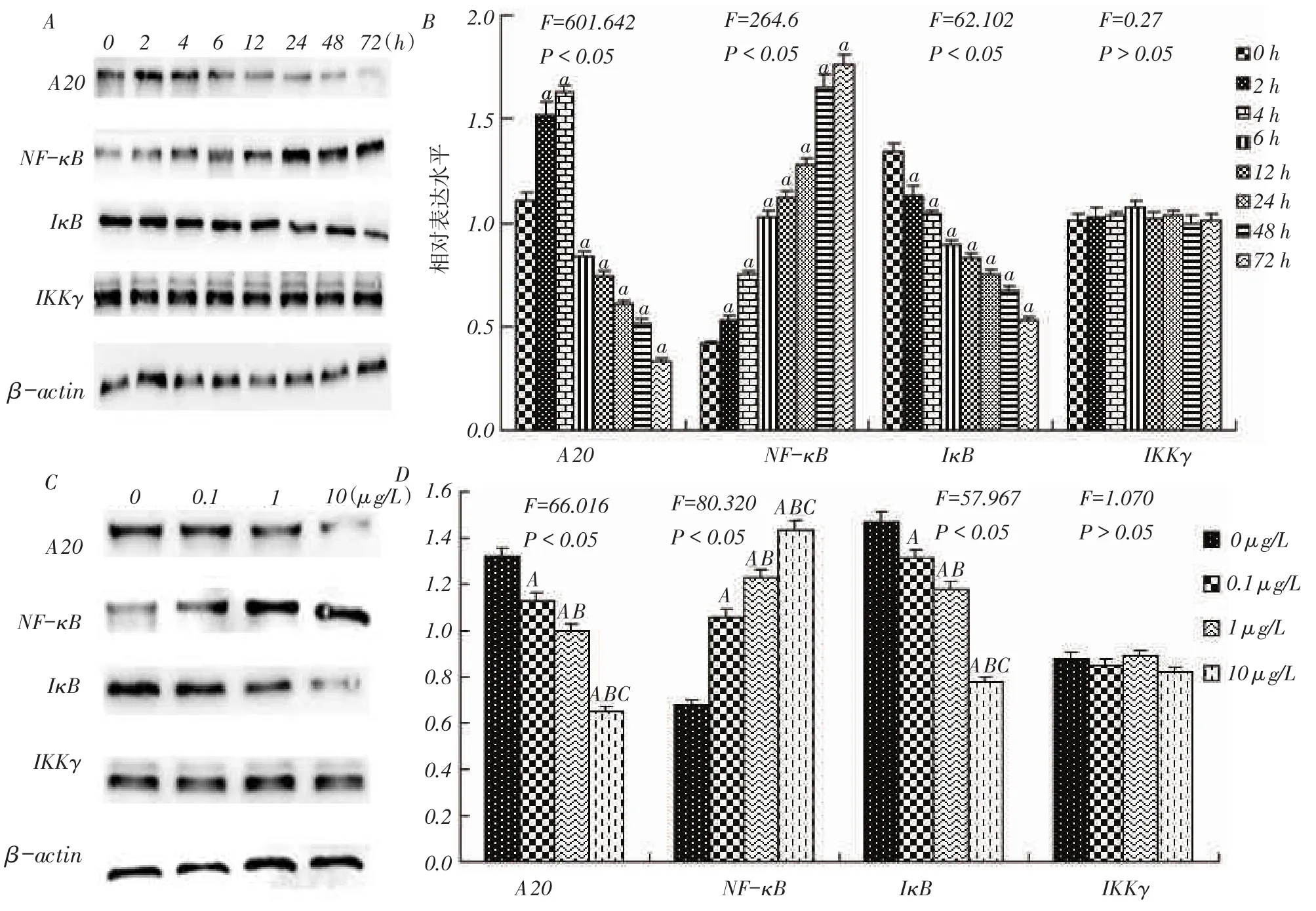
Fig.3 Changes of A20,NF-κB,IκB and IKKγ expressions in rat mesangial cells with the treatment of different times and different concentrations of LPS图3 A20、NF-κB、IκB和IKKγ蛋白表达随LPS处理时间和浓度的变化
2.32组A20、NF-κB、IκB及IKKγ蛋白表达水平比较 (1)蛋白表达水平随时间变化情况。与0 h相比,2、4 h时A20蛋白高表达,6 h后表达显着降低(均P<0.05);各时间点NF-κB表达水平均较0 h增高,IκB表达均降低(均P<0.05);各时间点IKKγ表达差异无统计学意义,见图3A、B。(2)各蛋白表达水平随浓度变化情况。除IKKγ各浓度组间差异无统计学意义外,A20和IκB的表达均呈浓度依赖性降低;NF-κB表达呈浓度依赖性升高(均P<0.05),见图3C、D。
2.42组A20、NF-κB、IκB、IKKγ及MCP-1基因表达水平比较 (1)基因表达水平随时间变化情况。与0 h比较,2、4、6 h A20基因表达增高,此后降低(均P<0.05);各时点NF-κB及MCP-1基因表达均增高,IκB表达降低(均P<0.05);各时点IKKγ差异无统计学意义(P>0.05),见图4A、B。(2)基因表达水平随浓度变化情况。除IKKγ各浓度组间差异无统计学意义外,A20和IκB均呈浓度依赖性降低,NF-κB和MCP-1呈浓度依赖性升高(均P<0.05),见图4C、D。
3 讨论
目前,研究显示,DN在早期肾单位中即可出现大量单核/巨噬细胞浸润,分泌过多的炎症因子造成了肾组织破坏,加速了肾纤维化,炎症反应是DN持续进展的首要因素之一[6]。在多条参与DN的炎症信号通路中,NF-κB信号通路是其中最重要信号通路之一。泛素化调节对DN的NF-κB信号通路激活发挥显着影响,但是调控机制复杂。NF-κB信号同时受到泛素化和去泛素化调节,正常情况下两者处于可逆的动态平衡。去泛素化酶A20是NF-κB信号通路中关键的负性调控因子和炎症抑制因子。
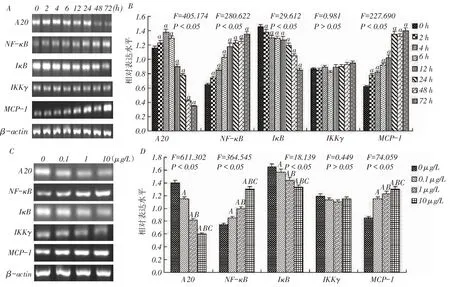
Fig.4 Changes of A20,NF-κB,IκB,IKKγ and MCP-1 expressions in rat mesangial cells with the treatment of different times and different concentrations of LPS图4 A20、NF-κB、IκB、IKKγ和MCP-1基因表达随LPS不同处理时间和浓度的变化
大量的研究发现,A20在众多炎症性疾病如系统性红斑狼疮(SLE)、风湿性关节炎、炎症性肠病、乳糜泻均起着重要作用[7-8]。并且A20可作为细胞保护因子,改善炎症、提高胰岛β细胞存活率;作为基因治疗应用于T1DM的胰岛移植以及其他干预性治疗中[9]。但目前A20在T2DM及DN中的作用研究尚少。本研究通过构建DN大鼠模型发现,模型组大鼠建模后第6周和第8周的血糖和尿微量白蛋白含量较对照组均明显升高,并且模型组较对照组肾小球系膜细胞和内皮细胞轻度增生,肾小球体积增大,肾小管上皮细胞稍呈玻璃样变;且8周较6周病理改变更加明显,表明模型组肾脏有明显病理改变;进一步免疫组化结果示,A20蛋白在正常肾组织的肾小管上皮细胞内表达较强,在肾小球中表达较弱;而模型组在肾小管上皮细胞中表达明显减弱,肾小球中基本无表达,且8周较6周肾小管及肾小球中表达量明显减少,表明A20可能对肾脏起保护作用,A20的低表达可能促进了肾脏的病理改变。这与众多研究报道的体内发生严重炎症反应时,A20在其他组织器官如肝脏[10]、胰腺[11]等中表达发生改变相一致,同样对机体发挥了重要的保护作用。
研究表明,T2DM和DN尿毒症患者的体内LPS较正常患者明显上调,并且认为这可能与肠道屏障功能障碍所引起的肠源性内毒素血症有关[12]。LPS作为TLR4的主要配体,可通过一定的转导通路激活IKK复合物,导致IκB磷酸化降解,NF-κB活化,并促进下游多种促炎因子和趋化因子如MCP-1的表达及释放[13]。大量炎症因子及趋化因子MCP-1的表达则可加重肾脏损伤、促进肾小球变硬、肾小管收缩等,参与DN的发生。去泛素化酶A20参与体内炎症调控,使组织免受过度炎症反应带来的损害,可作用于TLR4/NF-κB信号通路中IKK复合物的上游关键的衔接蛋白如受体相互作用蛋白1 (RIP1)、肿瘤坏死因子受体相关蛋白6(TRAF6)、IKKγ,反馈抑制NF-κB的活化,最终抑制炎症信号的表达上调[14]。
本研究发现LPS作用不同时间刺激大鼠肾小球系膜细胞后,LPS短期刺激(<6 h)时,与0 h比较,A20基因高表达,此后显着降低,而NF-κB、MCP-1基因表达均持续增高,表明LPS长时间作用下明显抑制A20表达,同时NF-κB信号持续激活、MCP-1进行性表达上调,而短时间内高表达的A20对NF-κB信号负性调节作用较小,考虑可能原因为在较短时间内A20对相应靶蛋白调控作用还未完全发挥,或是因为NF-κB信号通路同时存在多种调节机制,如SUMO化修饰,其重要的SUMO化修饰酶PIASy,可与A20竞争同一靶蛋白IKKγ进行SUMO化修饰,激活NF-κB信号[15]。另外,不同浓度的LPS刺激12 h下,A20和IκB蛋白和基因表达水平呈浓度依赖性表达下调,NF-κB和MCP-1基因表达水平则呈浓度依赖性表达上调,考虑可能机制为LPS长期作用后,A20表达显着下调,不能有效地抑制NF-κB信号的激活,最终导致炎症的持续激活,促进了DN的产生,表明A20的转录迅速而短暂,作为重要的“细胞保护”基因,迅速减少的A20无法抑制炎症反应,导致炎症进一步对靶器官的损伤。
(图1、2见插页)
参考文献
[1]Donath MY.Targetinginflammation in the treatment of type 2 diabetes:time to start[J].Nat Rev Drug Discov,2014,13(6):465-476.doi:10.1038/nrd4275.
[2]Huang W,Xu L,Zhou X,et al.High glucose induces activation of NF-κB inflammatory signaling through IκBα sumoylation in rat mesangial cells[J].Biochem Biophys Res Commun,2013,438(3):568-574.doi:10.1016/j.bbrc.2013.07.065.
[3]Catrysse L,Vereecke L,Beyaert R,et al.A20 in inflammation and autoimmunity[J].Trends Immunol,2014,35(1):22-31.doi:10.1016/j.it.2013.10.005.
[4]Yu LY,Lin B,Zhang ZL,et al.Direct transfer of A20 gene into pancreas protected mice from streptozotocin-induced diabetes[J].Acta Pharmacol Sin,2004,25(6):721-726.
[5]Gao CL,Aqie K,Zhu JH,et al.MG132 ameliorates kidney lesions by inhibiting the degradation of Smad7 in streptozotocin-induced diabetic nephropathy[J].J Diabetes Res,2014,2014:918396.doi:10.1155/ 2014/918396.
[6]Wada J,Makino H.Inflammation and the pathogenesis of diabetic nephropathy[J].Clin Sci,2013,124(3):139-152.doi:10.1042/ CS20120198.
[7]Majumdar I,Paul J.The deubiqutinase A20 in immunopathology of autoimmune diseases[J].Autoimmunity,2014,47(5):307-319. doi:10.3109/08916934.2014.900756.
[8]Catrysse L,Vereecks L,Beyaert R,et al.A20 in inflammation and autoimmunity[J].Trends Immunol,2014,35(1):22-31.doi:10.1016/j.it.2013.10.005.
[9]Zanmmit NW,Grey ST.Emerging roles for A20 in islet biology and pathology[J].Adv Exp Med Biol,2014,809:141-162.
[10]Zhang H,Huang C,Wang Y,et al.Hepatitis B Virus X Protein Sensitizes TRAIL-Induced Hepatocyte Apoptosis by Inhibiting the E3 Ubiquitin Ligase A20[J].PLoS One,2015,10(5):e0127329. doi:10.1371/journal.pone.0127329.
[11]Liu Y,Dan G,Wu L,et al.Functional effect of polymorphisms in the promoter of TNFAIP3(A20)in acute pancreatitis in the Han chinese population[J].PLoS One,2014,9(7):e103104.doi:10.1371/journal.pone.0103104.
[12]Yang M,Gan H,Shen Q,et al.Proinflammatory CD14+CD16+monocytes are associated with microinflammation in patients with type 2 diabetes mellitus and diabetic nephropathy[J].Inflammation,2012,35(1):388-396.doi:10.1007/s10753-011-9374-9.
[13]Mourad Z,Youssef E,Amarjit SN,et al.Poly(ADP-ribose)polymerase-1 is a determining factor in Crm1-mediated nuclear export and retention of p65 NF-κB upon TLR4 stimulation[J].J Immunol,2010,185(3):1894-1902.doi:10.4049/jimmunol.1000646.
[14]Harhaj EW,Dixit VM.Regulation of NF-kappaB by deubiquitinases [J].Immunol Rev,2012,246(1):107-124.doi:10.1111/j.1600-065X.2012.01100.x.
[15]Mabb AM,Wuerzberger-Davis SM,Miyamoto S.PIASy mediates NEMO sumoylation and NF-kappaB activation in response to genotoxic stress[J].Nat Cell Biol,2006,8(9):986-993.
(2015-08-20收稿2015-11-13修回)
(本文编辑陆荣展)
Changes of A20 expression in mesangial cells of LPS-induced diabetic nephropathy rat model
LIANG Yaling,CHEN Jiao,LONG Yang,LI Yanhui,LI Qiuhan,FAN Fang,XU Yong
Department of Endocrinology,the Affiliated Hospital of Southwest Medical University,Luzhou,Sichuan 646000,China Corresponding AutorE-mail:xywyll@aliyun.com
Abstract:ObjectiveTo observe the changes of A20 in mesangial cells of diabetic nephropathy(DN)rat model induced by lipopolysaccharide(LPS)-rat,and to explore its possible mechanism.Methods(1)Thirty health male Wistar rats were randomly divided into two group.Model rats were given streptozotocin(STZ)at a dose of 60 mg/kg by intraperitoneal injection.Rats in the control group received the same volume of citrate buffer in the same way.Levels of blood glucose and urinary microalbumin were detected in two groups at the 6thand the 8thweek.Changes of renal pathology were observed by HE staining.Changes of protein A20 were observed by immunohistochemistry.(2)Expression changes of gene and proteins A20,nuclear factor(NF)-κB,IκB,IKKγ and MCP-1 in renal cells treated with LPS were determined after treatment with different time points(0,2,4,6,12,24,48 and 72 h)and different concentrations(0.1,1 and 10 μg/L).Results(1)Levels of blood glucose and urinary microalbumin were significantly increased in model group compared with those of control group(P<0.01).HE stainig showed that hyaline degeneration in tubular epithelial cells was found in model group,especially at the 8thweek.Results of immunohistochemistry showed that expression of protein A20 significantly decreased in kidney tubules and nearly disappeared in glomerulus in model group compared with that of control group,which expressed less at the 8thweek. (2)There was no significant difference in the expression of IKKγ between different concentrations and different times.Compared with 0 h,the expression of A20 protein was increased at 2 h and 4 h,except that the expression of A20 protein increased after 6 h(P<0.05).Meanwhile NF-κB expression increased and IκB expression decreased in different time points (P<0.05).In addition,the expressions of A20 and IκB were decreased concentration-dependently(P<0.05).The expression levels of NF-κB and MCP-1 were increased concentration-dependently(P<0.05).ConclusionA20 may involve in the development of diabetic nephropathy by regulatingthe NF-κB pathway.
Key words:diabetic nephropathy;mesangial cells;lipopolysaccharides;blood glucose;NF-kappa B;micro albuminuria;A20 gene
中图分类号:R587.1,R587.24
文献标志码:A
DOI:10.11958/20150120
基金项目:四川省教育厅重点项目(10ZA036);四川省国际合作项目(14GH0003)
作者单位:西南医科大学附属医院内分泌科(邮编646000)
作者简介:梁雅灵(1989),女,硕士在读,主要从事糖尿病肾病研究
通讯作者E-mail:xywyll@aliyun.com



