李剑,曲芃芃
HPV E6/E7 mRNA与HPV DNA检测在宫颈癌早期筛查中的临床价值
李剑1,2,曲芃芃2
摘要:目的分析不同病变程度的宫颈病变患者高危型人乳头瘤病毒(HPV)DNA和高危型HPV E6/E7 mRNA表达阳性率及拷贝数的差异,评估两者对宫颈癌早期筛查的临床价值。方法收集天津市中心妇产科医院2014年因宫颈疾患行阴道镜下宫颈活检的154例患者资料和因其他良性妇科疾患行全子宫切除术的32例患者资料(对照组),154例根据宫颈活检病理结果分为宫颈上皮内瘤变低级别组(51例)、高级别组(71例)及宫颈浸润癌组(32例)。应用杂交捕获技术(HC2)HPV DNA检测和荧光定量杂交捕获技术HPV E6/E7 mRNA检测进行定量测定,并对全部患者的术后或宫颈活检石蜡标本进行E6/E7蛋白免疫组化检测。结果HC2 HPV DNA检测和HPV E6/E7 mRNA检测显示对照组阳性率低于各级别病变组(P<0.05),高危型HPV E6/E7 mRNA检测的拷贝数随着病变级别的加重而明显增高,而HC2 HPV DNA检测的拷贝数不随病变级别的加重而改变。高级别组及宫颈浸润癌组患者中,高危型HPV E6/E7 mRNA检测拷贝数>10 000的患者比例明显增多。免疫组化结果显示对照组E6/E7阳性率低于各级别病变组,高级别组、宫颈浸润癌组的E6/E7阳性率高于低级别组(均P<0.05)。结论HPV E6/E7 mRNA的表达及拷贝数的测定与宫颈病变程度密切相关,是宫颈癌早期筛查的有效措施之一,HPV DNA检测结果为阴性时,其排除疾病意义更高,而mRNA检测结果为阳性时,其预测疾病发生及进展的价值更好,两者结合使用有利于综合评价发生宫颈病变的风险。
关键词:宫颈肿瘤;乳头瘤病毒;HPV E6/E7 mRNA检测;HPV DNA检测;宫颈癌早期筛查
宫颈癌是妇科最常见的恶性肿瘤之一,全球每年约有23万女性死于宫颈癌[1]。目前普遍认为高危型人乳头瘤病毒(human papillomavirus,HPV)的持续感染是发展成宫颈癌的主要因素,而基因E6、E7 是HPV致癌机制研究中的重点[2-3]。目前美国食品和药品管理局(FDA)已批准了Aptima HPV作为唯一针对高危型HPV E6/E7 mRNA的检测方法,属于新一代的检测技术,但在国内尚处于起步阶段。本研究应用杂交捕获技术(HC2)HPV DNA检测和荧光定量杂交捕获技术HPV E6/E7 mRNA检测对186例患者宫颈脱落细胞标本进行测定,并对全部患者术后或宫颈活检石蜡标本进行E6/E7蛋白免疫组化检测,探讨HPV E6/E7 mRNA检测与HPV DNA检测在宫颈癌早期筛查中的临床价值及意义。
1 资料与方法
1.1一般资料收集2014年2月—11月我院门诊因宫颈疾患行阴道镜下宫颈活检的154例患者资料,根据病理活检结果分为3组,包括低级别宫颈上皮内瘤变患者(低级别组)51例,年龄22~64岁,平均(40.6±9.3)岁;高级别宫颈上皮内瘤变患者(高级别组)71例,年龄25~62岁,平均(41.9±9.0)岁;宫颈浸润癌患者(宫颈浸润癌组)32例,FIGO分期为Ⅰa1~Ⅲb期,年龄32~64岁,平均(42.3±9.1)岁;因其他良性妇科疾患行全子宫切除术的32例患者作为对照组,年龄35~68岁,平均(42.8±8.9)岁。4组患者年龄差异无统计学意义(F=1.317,P>0.05)。4组既往均无盆腔放疗史、急性生殖道炎症及宫颈物理治疗史。
1.2试剂及设备高危型HPV E6/E7 mRNA检测:96孔检测板及宫颈稳态试剂盒购自河南科帝亚生物技术有限公司。HPV DNA检测:检测板及采样工具包购自美国Digene公司。两实验均使用美国Diacarta公司台式冷光仪及QS071型恒温箱;DAB显色试剂盒及免疫组织化学SP试剂盒购自北京中杉金桥生物技术有限公司;抗HPV16/18 E6单抗购自美国Miltenyi-Biotec公司;HPV16 E7鼠抗人单克隆抗体购自美国Invitrogen公司。
1.3方法
1.3.1高危型HPV E6/E7 mRNA检测标本采集:使用新柏氏液基细胞学(TCT)检测专用刷插入患者宫颈管旋转8~10周,收集宫颈口及宫颈管脱落的上皮细胞,将刷头置入CytoRich保存液瓶中待检。实验步骤:将待检标本液经2次水平离心(3 000 r/min)5 min后,倒掉上清液,加入裂解液及蛋白酶K,放入恒温箱65℃约1.5 h,中间每隔30 min取出标本振荡摇匀,加入96孔检测板,同时设立空白对照2孔及阳性质控2孔。通过2种捕获探针捕获目的mRNA,经3级信号放大,添加底物及底物催化剂,使连接了碱性磷酸酶的标记探针杂交结合放大分子,添加底物,再使其与底物结合,从而产生化学发光信号,信号强度与mRNA数量呈正相关,经冷光仪检测出目的mRNA数量,以拷贝数为单位计算。拷贝数>0为阳性;拷贝数<4 000为低危风险;4 000~10 000为中危风险;拷贝数>10 000为高危风险。
1.3.2HPV DNA检测标本采集:使用采样工具包检测专用刷插入患者宫颈管旋转8~10周,收集宫颈口及宫颈管脱落的上皮细胞,将刷头置入CytoRich保存液瓶中待检。将待检标本首先溶解,解链和变性核酸,释放HPV DNA单链;再将全长病毒RNA探针与HPV病毒靶DNA结合,形成RNA/ DNA复合物,该复合物被包被在微孔板上的抗体捕获,抗体特异性结合RNA/DNA复合物;最后用二抗结合捕获后的复合物,二抗偶联有碱性磷酸酶,加入碱性磷酸酶的底物,产生化学发光信号,经冷光仪检测出目的DNA的数量,以拷贝数为单位计算,拷贝数>0者为阳性。
1.3.3E6/E7蛋白免疫组织化学SP法检测对全部186例患者术后或宫颈活检石蜡标本进行切片,本实验使用的SP法,采用生物素标记的二抗与链霉素抗生素蛋白链接的过氧化物酶及底物色素相混合,测定细胞或组织中的抗原。实验结果以细胞核内出现棕黄色颗粒作为阳性判断标准。
1.4统计学方法采用SPSS 17.5统计软件进行数据分析,计量数据用均数±标准差(x±s)表示,组间比较采用方差分析,组间多重比较采用Dunnett's T3法。计数资料采用例(%)表示,组间比较用Χ2检验,多组比较检验水准α=0.05,进一步4组两两比较时检验水准进行Bonferroni校正α′=0.008 3。
2 结果
2.1高危型HPV E6/E7 mRNA检测结果低级别组、高级别组和宫颈浸润癌组HPV E6/E7 mRNA阳性率及拷贝数均高于对照组,且后2组HPV E6/E7 mRNA阳性率(90.1%、93.8%)高于低级别组(72.5%)和对照组(21.9%)。HPV E6/E7 mRNA检测的拷贝数随病变级别的加重而增多,高级别组与宫颈浸润癌组mRNA拷贝数多>10 000,对照组和低级别组mRNA拷贝数多<4 000。见表1。
2.2HPV DNA检测结果低级别组、高级别组和宫颈浸润癌组DNA阳性率及拷贝数均高于对照组,但3个病变组之间差异无统计学意义,见表2。

Tab.1 Results of HPV E6/E7 mRNA test in four groups of patients表1 4组患者HPV E6/E7 mRNA检测结果
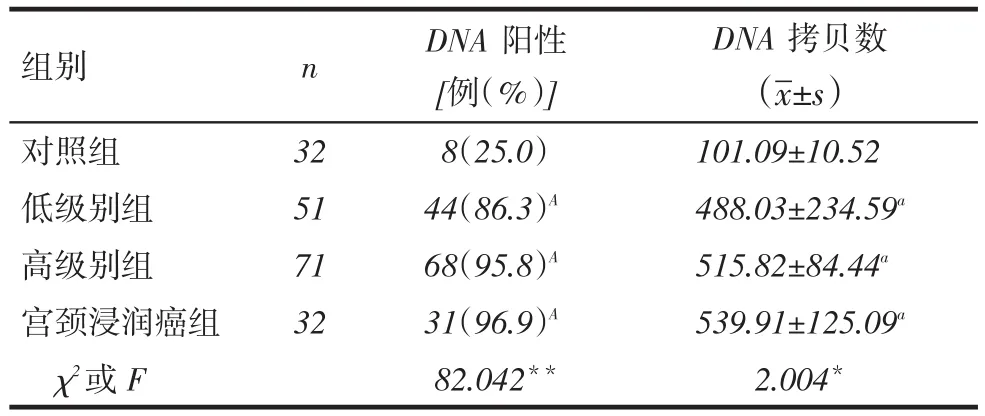
Tab.2 Results of HPV DNA test in four groups of patients表2 4组患者HPV DNA检测结果
2.3HPV病毒E6/E7蛋白的表达结果4组患者E6/E7阳性率差异有统计学意义。低级别组、高级别组与宫颈浸润癌组均高于对照组,且后2组蛋白阳性率均高于低级别组,但该2组差异无统计学意义,见表3,图1、2。
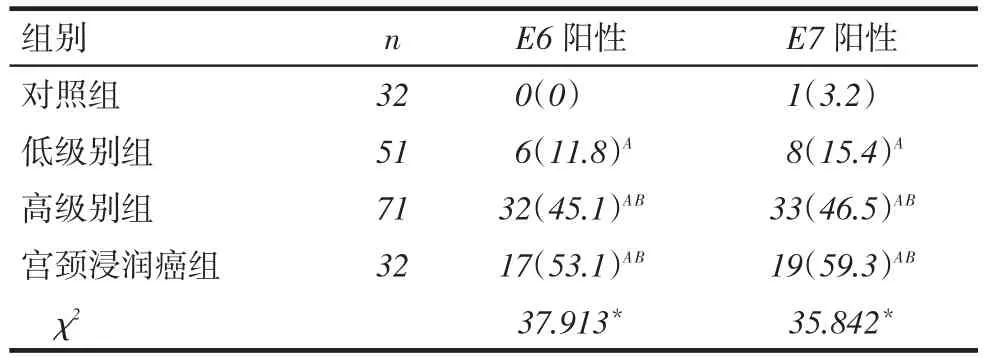
Tab.3 Results of HPV E6/E7 protein expression in four groups of patients表3 4组患者HPV病毒E6/E7蛋白表达结果 例(%)
Fig.1 Expression of E6/E7 by immunohistochemistry(SP,×100)图1 E6/E7免疫组织化学染色结果(SP,×100)
3 讨论
3.1高危型HPV E6/E7 mRNA检测的研究现状研究预计宫颈癌的死亡人数将在近十年内上升25%,发达国家因宫颈癌筛查防治措施逐步完善,发病率已逐年减低,但大多数发展中国家的宫颈癌发病率却呈上升趋势[3]。目前普遍认为高危型HPV的持续感染是发展成宫颈癌的主要因素[4],而早期基因E6、E7是HPV致癌机制研究中的重点。当其表达失去抑制后将逐步导致宫颈癌。E6结合并灭活肿瘤抑制因子P53,E7结合并降解抑制蛋白pRb,最终导致细胞无限分裂而不发生凋亡[5]。早诊断、早治疗是提高子宫颈癌患者生存率及改善其生存质量的关键。目前美国FDA相继批准了4个宫颈癌相关高危型HPV检测,前3种属于第一代的高危型HPV DNA检测方法,而AptimaHPV属新一代唯一针对高危型HPV E6/E7 mRNA的检测方法。本研究显示,低级别组与高级别组及宫颈浸润癌组HPV DNA阳性率相似,且HPV DNA检测的拷贝数并未随着病变级别的加重而增加;而高危型HPV E6/E7 mRNA检测中,低级别组阳性率低于高级别组及宫颈浸润癌组,且高危型HPV E6/E7 mRNA检测的拷贝数随着病变级别的加重而明显增多。提示HPV E6/E7 mRNA检测可能敏感度较高。
3.2高危型HPV E6/E7 mRNA检测的临床价值高危型HPV E6/E7 mRNA检测中危风险以上(拷贝数>4 000)的阳性表达提示:宫颈上皮细胞有高危型HPV病毒的感染,癌基因E6/E7处于复制活动期,病变处于转化活跃期,患者癌变风险逐渐增加;在病毒感染的早期,病毒基因在细胞内为游离状态,此时E6/E7基因处于静默期,不表达或低表达mRNA,一过性感染大多数处于这个阶段[6]。有研究指出HPV DNA检测敏感度约为95%,而mRNA检测的敏感度为75%~91%;但特异度mRNA检测为56%~97%,而DNA仅为40%~47%[7-8]。HPV DNA检测阳性似然比为1.1~1.9,而mRNA检测阳性似然比为2.0~5.8。也就是说,当mRNA检测阳性时,患者有宫颈病变的可能性更高。HPV DNA检测阴性似然比为0.03~0.20,mRNA检测阴性似然比为0.16~0.29,提示DNA阴性时,患者无宫颈病变的可能性更大。总之,宫颈癌筛查时,HPV DNA检测结果为阴性时排除疾患的价值更高,而mRNA检测结果为阳性时预测疾患的价值更好[9]。评价一个好的筛查方法,虽然难以要求其确诊功能,但其应该既不遗漏真正患病的患者,也能较好地排除非患病人群,不给随访者带来较大的心理负担。根据美国癌症协会(American Cancer Society,ACS)、美国阴道镜和宫颈病理学会(American Society for Colposcopy and Cervical Pathology,ASCCP)发布的宫颈癌筛查指南,不建议对30岁以下人群采取常规HPV DNA检测,因约70%~80%的女性在一生中有可能感染HPV,90%感染者可在8~24个月内自然清除,只有少数持续性、高危型HPV感染有可能导致宫颈病变或宫颈癌[10-11]。由于宫颈癌患者有年轻化趋势,而HPV E6/ E7 mRNA检测具有良好的阳性预测功能,应用该指标进行30岁以下人群的筛查,找出高危人群,对宫颈癌的早期发现具有一定的临床意义[12]。联合细胞学检测,有效分流意义未明的不典型鳞状细胞(ASCUS)及低度鳞状上皮内病变(LSIL)者,可以减轻患者的心理负担,节约宝贵的医疗资源,具有极大的社会经济学效益。此外,对于宫颈上皮内瘤变患者治疗后的随访,利用HPV E6/E7 mRNA检测可有效评估复发风险。
总之,对于HPV DNA检测已日趋成熟,HPV E6/E7 mRNA检测方兴未艾,两者结合使用有利于综合评估患者发生宫颈病变的风险。
参考文献
[1]Li HL,Yin LR,Sun JJ.Association between hTERT gene amplification and high-risk HPV infection in cervical lesions[J].Tianjin Med J,2014,42(2):127-130.[李洪林,尹利荣,孙俊杰.宫颈病变中hTERT基因扩增与高危型HPV感染的关系[J].天津医药,2014,42(2):127-130].doi:10.3969/j.issn.0253-9896.2014.02.009.
[2]Liu SJ,Yin LR,Li HL.E6/E7 mRNA expression level in cervical lesions with high-risk HPV infection[J].Tianjin Med J,2015,43(2):186-188.[刘甚佳,尹利荣,李洪林.高危型HPV感染宫颈病变中E6/E7 mRNA的表达水平[J].天津医药,2015,43(2):186-188].doi:10.3969/j.issn.0253-9896.2015.02.019.
[3]Matsukura T,Sugase M.Pitfalls in the epidemiologic classification of human papillomavirus types associated with cervical cancer using polymerase chain reaction:driver and passenger[J].Int J Gynecol Cancer,2008,18(5):1042-1050.doi:10.1111/j.1525-1438.2007. 01157.x.
[4]Clifford GM,Smith JS,Plummer M,et al.Human papillomavirus types in invasive cervical cancer worldwide:a meta-analysis[J].Br JCancer,2003,88(1):63-73.
[5]Pim D,Banks L.Interaction of viral oncoproteins with cellular target molecules:infection with high-risk vs low-risk human papillomaviruses[J].APMIS,2010,118(6/7):471-493.doi:10.1111/ j.1600-0463.2010.02618.x.
[6]Mockel J,Quaas J,Meisel H,et al.Human papillomavirus E6/E7 mRNA testing has higher specificity than liquid-based DNA testing in the evaluation of cervical intraepithelial neoplasia[J].Anal Quant Cytol Histol,2011,33(6):311-315.
[7]Clda A,Reuschenbach M,Weinschenk J,et al.Performance of the Aptima high-risk human papillomavirus mRNA assay in a referral population in comparison with Hybrid Capture 2 and cytology[J].J Clin Microbiol,2011,49(3):1071-1076.doi:10.1128/JCM.01674-10.
[8]Burger EA,Kornor H,Klemp M,et al.HPV mRNA test for the detection of cervical intraepithelial neoplasia:a systematic review[J].Gynecol Oncol,2011,120(3):430-438.doi:10.1016/j.ygyno.2010.11.013.
[9]Benevolo M,Vocaturo A,Caraceni D,et al.Sensitivity,specificity,and clinical value of human papillomavirus(HPV)E6/E7 mRNA assay as a triage test for cervical cytology and HPV DNA test[J].J Clin Microbiol,2011,49(7):2643-2650.doi:10.1128/JCM.02570-10.
[10]Moyer VA,U.S.Preventive Services Task Force.Screening for cervical cancer:U.S.Preventive Services Task Force recommendation statement[J].Ann Intern Med,2012,156(12):880-891.doi:10.7326/0003-4819-156-12-201206190-00424.
[11]Saslow D,Solomon D,Lawson HW,et al.American Cancer Society,American Society for Colposcopy and Cervical Pathology,and American Society for Clinical Pathology screening guidelines for the prevention and early detection of cervical cancer[J].Am J Clin Pathol,2012,137(4):516-542.doi:10.1309/AJCPTGD94EVRSJCG.
[12]Molden T,Kraus I,Karlsen F,et al.Comparison of human papillomavirus messenger RNA and DNA detection:a cross-sectional study of 4,136 women>30 years of age with a 2-year follow-up of high-grade squamous intraepithelial lesion[J].Cancer Epidemiol Biomarkers Prev,2005,14(2):367-372.
(2015-11-25收稿2015-12-06修回)
(本文编辑李鹏)
The clinical value of HPV E6/E7 mRNA and HPV DNA in early screening of cervical cancer
LI Jian1,2,QU Pengpeng2
1 Graduate School of Tianjin Medical University,Tianjin 300070,China;2 Tianjin Central Hospital of Gynecology Obstetrics Corresponding AuthorE-mail:18622059808@163.com
Abstract:ObjectiveTo analyze the differences of positive detection rate and copy number of human papillomavirus (HPV)DNA and E6/E7 mRNA between different grades of cervical lesions,and evaluate their clinical values in early screening of cervical cancer.MethodsThe cervical exfoliated cell samples from 154 women undergoing biopsy examination and 32 objects undergoing hysterectomy(control group)were collected in Tianjin Central Hospital of Gynecology Obstetrics in 2014.According to the pathological results of cervical biopsy,154 samples were divided into low-grade squamous intraepithelial lesion group(LSIL,n=51),high-grade squamous intraepithelial lesion group(HSIL,n=71),and squamous cell carcinoma group(SCC,n=32).HPV DNA was tested with hybrid capture technology,and E6/E7 mRNA was detected with fluorescence quantitative hybridization.Immunohistochemistry was performed by detecting E6/E7 protein in all patients after surgery or cervical biopsy.ResultsCombined results of HPV DNA and E6/E7 mRNA demonstrated that the positive detection rate was significantly lower in control group than that of all levels of lesion groups(P<0.05).The copy number of high risk HPV E6/E7 mRNA was significantly increased with the aggravation of lesions(P<0.05),whereas no difference was found in that of HPV DNA.Compared with the normal control and low-grade squamous intraepithelial lesion group,cervical cancer patients with mRNA copies>10 000 E6/E7 were significantly increased in high-grade squamous intraepithelial lesion group.Immunohistochemical results showed that the positive detection rate of E6/E7 was significantly lower in control group than that of all levels of lesion groups(P<0.05).The positive rate of E6/E7 was significantly higher in the high-grade squamous intraepithelial lesion group than that of low-grade group(P<0.05).ConclusionHPV infection is closely related tocervical abnormalities,which is one of effective measures for early screening of cervical cancer.The negative result of HPV DNA is very helpful to exclude the cervical abnormality,whereas the positive detection of mRNA has great value in predicting the disease.Combined results of positive detection and copy number make a comprehensive evaluation for the risk of cervical lesions.
Key words:uterine cervical neoplasms;human papillomavirus;HPV E6/E7 mRNA detection;HPV DNA detection;early cervical cancer screening
中图分类号:R737.33
文献标志码:A
DOI:10.11985/20150342
基金项目:天津市科技计划项目(09ZCZDSF03900)
作者单位:1天津医科大学研究生院(邮编300070);2天津市中心妇产科医院
作者简介:李剑(1978),女,主治医师,主要从事妇科肿瘤临床研究
通讯作者E-mail:18622059808@163.com



