陈振华,丘新才 ,林淑芳,甘振勇
去氧鬼臼毒素抑制肺癌NCI-H358细胞增殖和体外迁移的研究
陈振华,丘新才 ,林淑芳,甘振勇
目的探讨去氧鬼臼毒素对人肺癌NCI-H358细胞增殖和体外迁移的影响,并初步探讨其作用机制。方法应用CCK-8法、流式细胞术、细胞划痕实验和DCFH-D法分别检测去氧鬼臼毒素对NCI-H358细胞增殖、周期分布、凋亡、体外迁移能力和细胞内活性氧(ROS)的影响,并通过Western blot检测去氧鬼臼毒素对细胞周期蛋白(Cyclin)B1、细胞分裂周期蛋白25同源蛋白(Cdc25c)、细胞周期蛋白依赖性激酶(CDK)1、半胱氨酸天冬氨酸蛋白酶(Caspase)-3、p53肿瘤蛋白、B淋巴细胞瘤(Bcl)-2和基质金属蛋白酶(MMP)9的表达水平,以及细胞外信号调节激酶(ERK)1/2、p38分裂原激活蛋白激酶(MAPK)和c-Jun氨基末端激酶(JNK)的磷酸化水平的影响。结果去氧鬼臼毒素能明显抑制肺癌NCI-H358细胞的生长,流式细胞结果显示其能诱导细胞停滞在G2/M和S期,诱导细胞凋亡和细胞ROS产生,同时细胞体外迁移能力也明显下调。Western blot结果显示,去氧鬼臼毒素能使Cyclin B1、Cdc25c、CDK1、Bcl-2和MMP9的蛋白表达明显下调,而Caspase-3和p53的表达明显上调,且ERK1/2、p38MAPK和JNK的磷酸化水平明显受到抑制。结论去氧鬼臼毒素可抑制肺癌NCI-H358细胞的增殖和体外迁移,是一种潜在的抗肿瘤药物。
鬼臼毒素;肺肿瘤;细胞增殖;细胞运动;去氧鬼臼毒素
肺癌是最常见的恶性肿瘤之一,其发病率有逐年增加的趋势。目前,肺癌总的5年生存率仅为10%~13%[1]。如何改善肺癌的治疗效果、提高肺癌患者的总生存率是亟待解决的向题。由于化疗药的不良反应,许多患者往往无法耐受而放弃化疗,这严重影响其生活质量。因此寻求低毒、高效的天然植物成分成为近几年来抗肿瘤研究的重要热点。
去氧鬼臼毒素(deoxypodophyllotoxin,DPPT)是从中药桃儿七Sinopodophyllum emodi(wall)、八角莲和欧洲刺柏Juniperus communis等植物中分离得到的活性成分[2]。研究表明,DPPT具有较强的抗白血病[3]、抗肿瘤[4]、抗病毒[5]活性,是一种潜在的抗癌新药,但其作用机制尚不清楚。本研究通过观察DPPT对人肺癌NCI-H358细胞增殖、周期分布、凋亡以及迁移的影响,探讨其对肺癌的作用机制,为临床研究提供实验基础。
1材料与方法
1.1药品与试剂DPPT购自上海源叶生物科技有限公司;NCI-H358细胞购自中国科学院上海生命科学研究院生物化学与细胞生物学研究所;RPMI 1640培养基、胎牛血清、Trizol 和0.25%胰酶均购自美国Life Technologies公司;cDNA反转录试剂盒购自Fermentas公司;荧光定量SYBR Premix Ex Taq试剂盒购自大连宝生物有限公司;活性氧(ROS)检测试剂盒、青霉素和链霉素均购自江苏海门碧云天生物技术研究所。CCK-8检测试剂盒、Western blot的细胞周期蛋白(Cyclin)B1、细胞分裂周期蛋白25同源蛋白(Cdc25c)、细胞周期蛋白依赖性激酶(CDK)1、半胱氨酸天冬氨酸蛋白酶(Caspase)-3、p53肿瘤蛋白、B淋巴细胞瘤(Bcl)-2和基质金属蛋白酶(MMP)9、细胞外信号调节激酶(ERK)1/2、p38分裂原激活蛋白激酶(MAPK)和c-Jun氨基末端激酶(JNK)等一抗和辣根过氧化酶标记的山羊抗兔二抗均购自美国Santa Cruz公司。
1.2主要仪器培养箱购自美国Thermro公司;96孔板购自美国Corning公司;ELX800UV酶标仪购自美国Bio-Tek公司;FACScanTM流式细胞仪购自美国BD Biosciences公司;7500 PCR仪购自美国ABI公司;凝胶成像系统购自美国Bio-Rad公司;酶标仪购自美国Molecular Devices公司。
1.3细胞培养及实验分组NCI-H358细胞用含10%胎牛血清、100 U/mL青霉素和100 mg/L链霉素的RPMI 1640培养液,于37℃、5%CO2饱和湿度下常规传代培养。实验分为对照组(0 μmol/L DPPT)、3 μmol/L DPPT组和6 μmol/L DPPT组。
1.4 CCK-8检测细胞增殖取对数生长期NCI-H358细胞,以2×103个/mL接种到96孔微孔板中,每孔100 μL,培养过夜使细胞贴壁。使用不同浓度的DPPT(0、0.5、1、2、4、6、8、10、15 μmol/L)分别处理细胞24 h和48 h,每组设置4个复孔。按照试剂盒说明书每孔加入10 μL CCK-8试剂,继续培养2 h。最后用酶标仪测定450 nm波长下的光密度(OD)值。以处理组OD值/对照组OD值×100%作为生存率。
1.5流式细胞术检测细胞周期和凋亡率取对数生长期NCI-H358细胞,以2×105个/mL接种于6孔板中,0、3、6 μmol/L DPPT处理48 h后,用0.25%胰酶消化,2 000 r/min离心5 min,收集细胞,PBS洗2次,1 000 r/min离心10 min后弃上清液,500 μL 70%乙醇4℃固定过夜。加入RNA酶消化,使用碘化丙啶(PI)避光染色30 min,FACScanTM流式细胞仪进行细胞周期分析,重复实验3次。细胞凋亡采用PI/ Annexin V-FITC双染法,将细胞重悬于200 μL Binding Buffer中,加入10 μL Annexin V-FITC,室温避光孵育15 min,使用FACScanTM流式细胞仪检测细胞凋亡率。
1.6 DCFH-DA法检测细胞ROS含量NCI-H358细胞培养在6孔板中,经3 μmol/L和6 μmol/L DPPT作用48 h后,PBS洗涤2次,每孔加入经无血清RPMI 1640培养基稀释的终浓度为10 μmol/L的DCFH-DA,37℃避光孵育20 min,用无血清RPMI 1640培养液洗涤细胞3次,流式细胞仪在激发波长488 nm、发射波长525 nm下检测细胞平均荧光强度,分析细胞内ROS含量。
1.7细胞划痕实验检测细胞迁移情况NCI-H358细胞接种于6孔板中直至形成单层融合,待细胞融合达95%以上,用200 μL吸头在细胞层中划痕,PBS洗2次,加入0、3和6 μmol/L DPPT放置于培养箱中继续培养24 h,取0 h和24 h两时间点在倒置显微镜下观察并拍照,统计划痕的间隙距离。迁移率(%)=1-[间隙距离(24 h)/间隙距离(0 h)]×100%。1.8 Western blot检测肿瘤相关蛋白的表达NCI-H358细胞以5×103个/mL密度接种于6孔板,0、3和6 μmol/L DPPT作用48 h后收集各组细胞,用RIPA裂解液进行裂解,加入40 μg蛋白样品,经10%SDS-PAGE电泳后转移至PVDF膜(150 mA,1 h),5%脱脂牛奶封闭1 h后,各目标分子特异性一抗4℃过夜。洗去一抗,以HRP连接的二抗温育1 h,洗涤,以ECL试剂盒显示免疫反应条带。β-actin作内参,检测各组细胞中Cyclin B1、Cdc25c、CDK1、Caspase-3、p53、Bcl-2、MMP9的表达水平,以及ERK1/2、p38 MAPK和JNK的磷酸化水平。
1.9统计学方法所得数据用SPSS 13.0统计软件分析,计量资料以均数±标准差(x ±s)表示,多组间比较采用ANOVA分析,组间多重比较用LSD-t法。以P<0.05表示差异有统计学意义。
2 结果
2.1 DPPT抑制NCI- H358细胞的增殖NCIH358细胞经DPPT处理,细胞活性呈浓度依赖性抑制,同一浓度下DPPT处理48 h的细胞生存率低于24 h,见图1。DPPT处理24 h和48 h的半数抑制浓度(IC50)分别为(7.62±0.57)μmol/L和(3.77±0.23)μmol/L(t=14.011,P<0.01)。后续实验均以DPPT处理48 h为准。2.2 DPPT对NCI-H358细胞周期分布的影响与对照组相比,DPPT处理后G2/M和S期NCI-H358细胞的比例显着升高,而G0/G1期的细胞比例明显减少,见表1、图2。
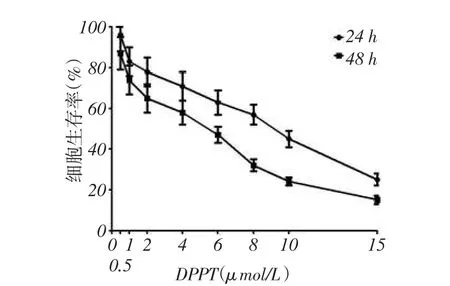
Fig. 1 The effects of different concentrations of DPPT on the cell proliferation of NCI-H358 cells图1 DPPT不同浓度和处理时间对NCI-H358细胞增殖的影响
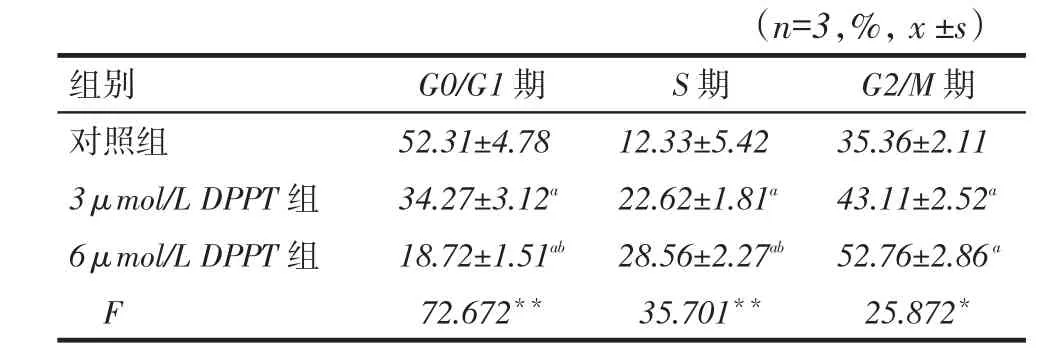
Tab. 1 The effects of DPPT on the cell cycle of NCI-H358 cells表1 DPPT对NCI-H358细胞周期分布的影响
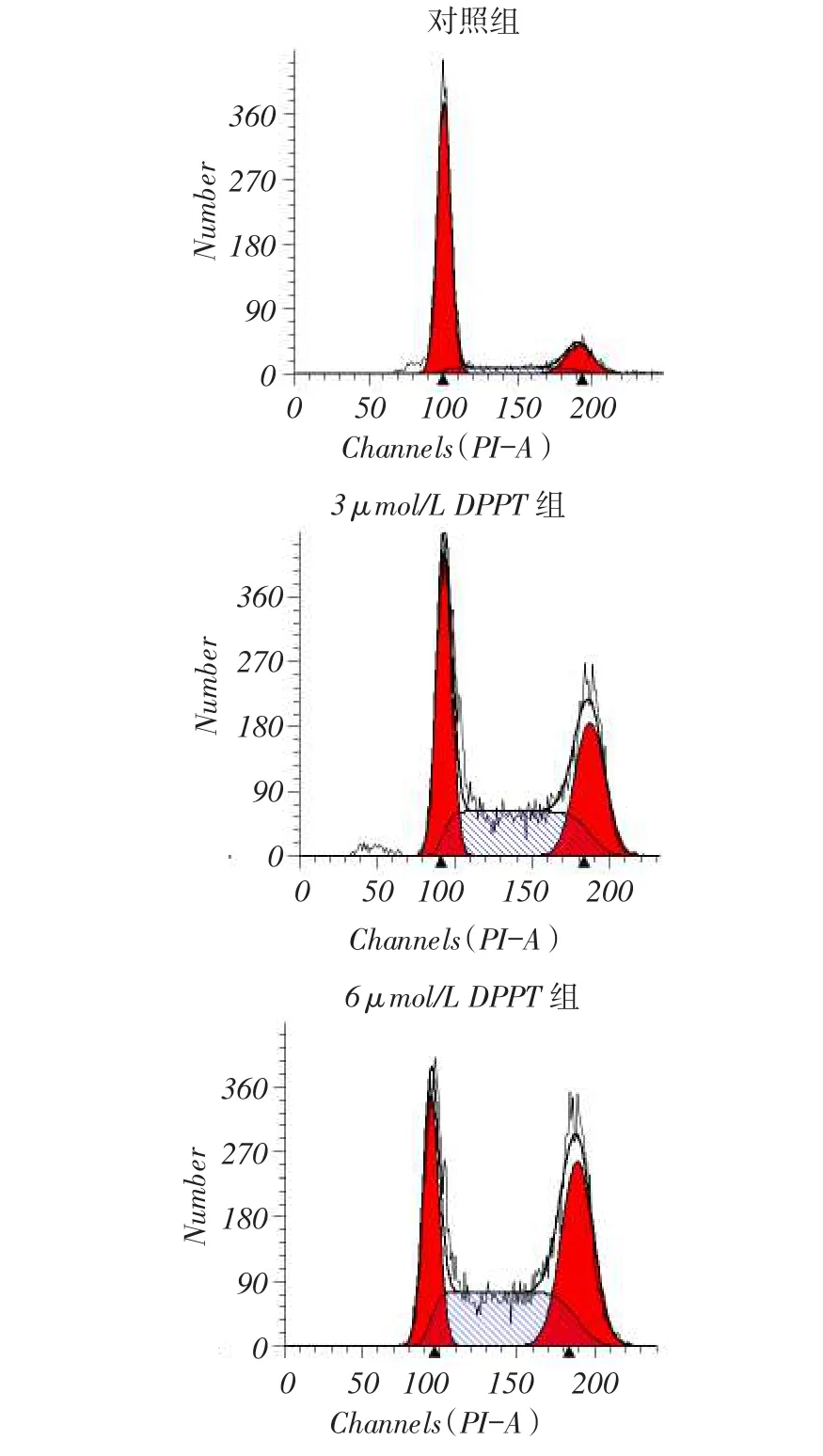
Fig. 2 The effects of DPPT on the cell cycle of NCI-H358 cells 图2 DPPT对NCI-H358细胞周期的影响
2.3 DPPT诱导NCI-H358细胞凋亡3、6 μmol/L DPPT作用48 h后,NCI-H358细胞凋亡率[(43.32± 2.77)%、(56.26±3.18)%]均高于对照组[(10.15± 0.96)%,n=3,F=192.513,P<0.01],见图3,提示DPPT可诱导NCI-H358细胞凋亡。
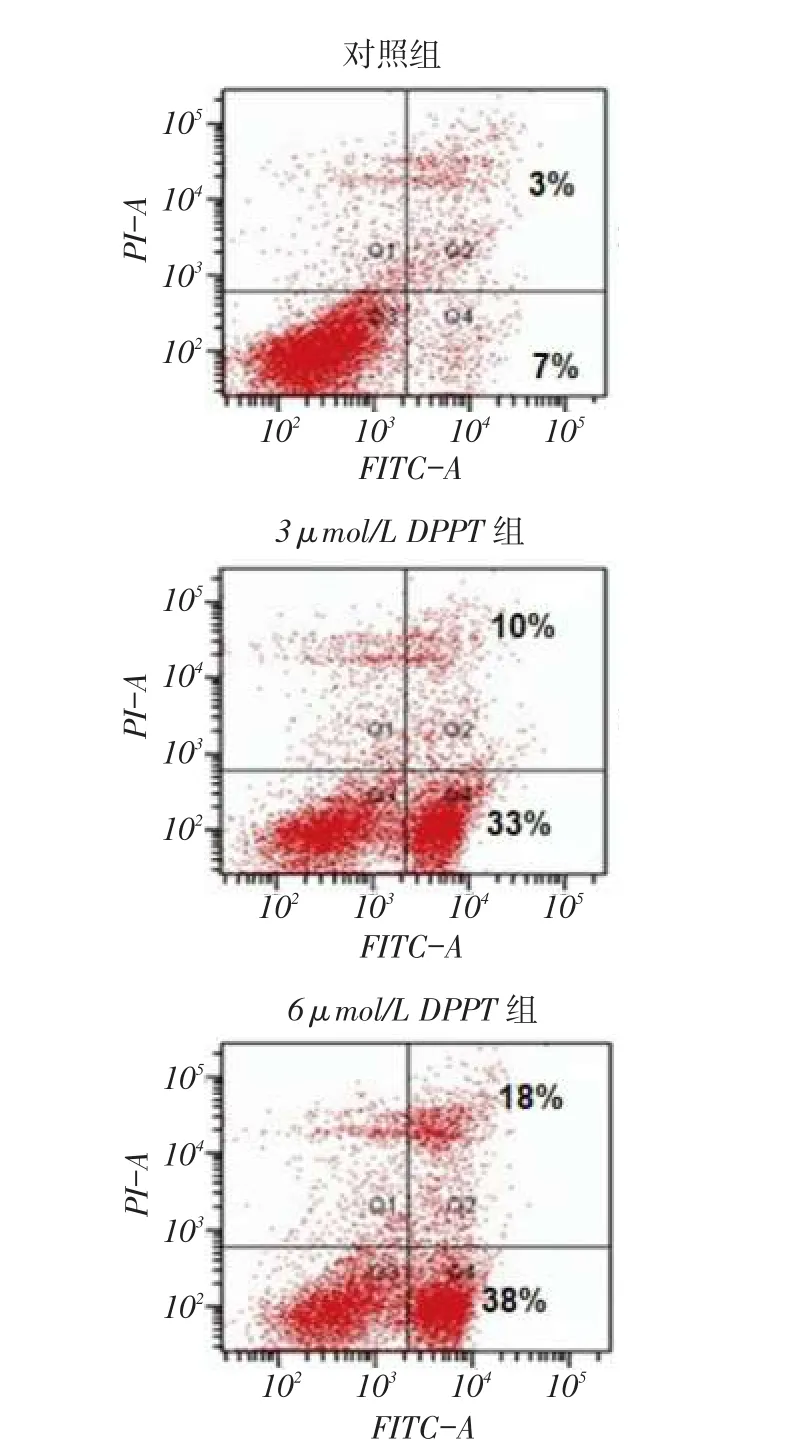
Fig. 3 The effects of DPPT on the apoptosis of NCI-H358 cells图3 DPPT对NCI-H358细胞凋亡的影响
2.4 DPPT促进NCI-H358细胞内ROS形成经3、6 μmol/L DPPT处理NCI-H358细胞48 h后,胞内的ROS浓度明显增加[(39.22±1.81)%、(62.53± 2.07)%],均高于对照组[(9.31±0.72)%,n=3,F= 242.347,P<0.01]。
2.5 DPPT抑制NCI-H358细胞的体外迁移3、6 μmol/L DPPT处理48 h后,NCI-H358细胞的体外迁移明显受到抑制,其细胞迁移率均低于对照组[(37.55±0.31)%、(23.49±0.21)%vs.(56.32±0.52)%,n=3,F=169.126,P<0.01],见图4。

Fig. 4 The effects of DPPT on the migration of NCI-H358 cells图4 DPPT对NCI-H358细胞体外迁移能力的影响
2.6 DPPT抑制Cyclin B1、Cdc25c和CDK1蛋白的表达3、6 μmol/L DPPT处理后,NCI-H358细胞中Cyclin B1、Cdc25c和CDK1的蛋白表达水平均较对照组明显下调,见图5。
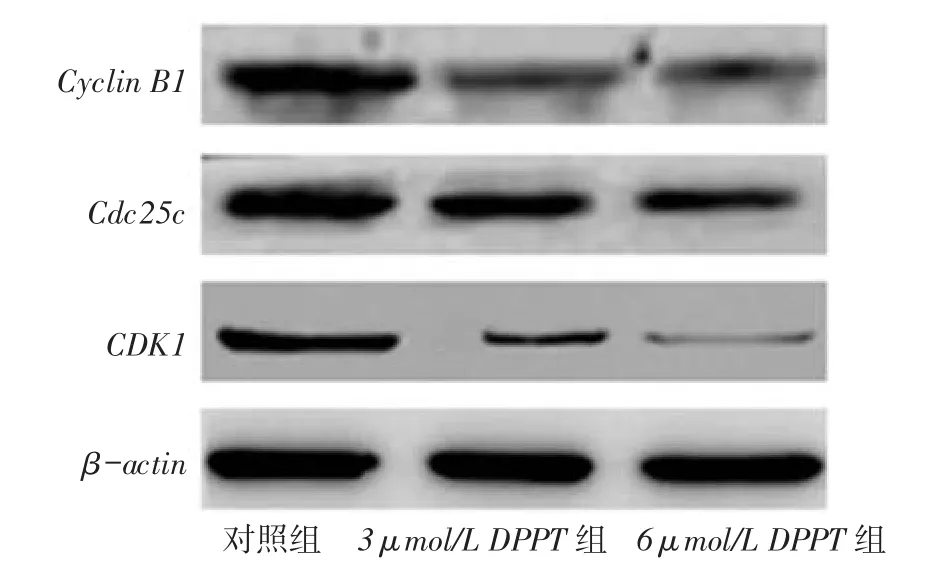
Fig. 5 The effects of DPPT on the expressions of Cyclin B1,Cdc25c and CDK1 of NCI-H358 cells图5 DPPT对Cyclin B1、Cdc25c和CDK1蛋白表达的影响
2.7 DPPT对Caspase-3、p53、Bcl-2和MMP9蛋白表达的影响经3、6 μmol/L DPPT作用48 h后,NCI-H358细胞中Caspase-3和p53蛋白表达较对照组显着上升,而Bcl-2和MMP9蛋白的表达显着下调,见图6。
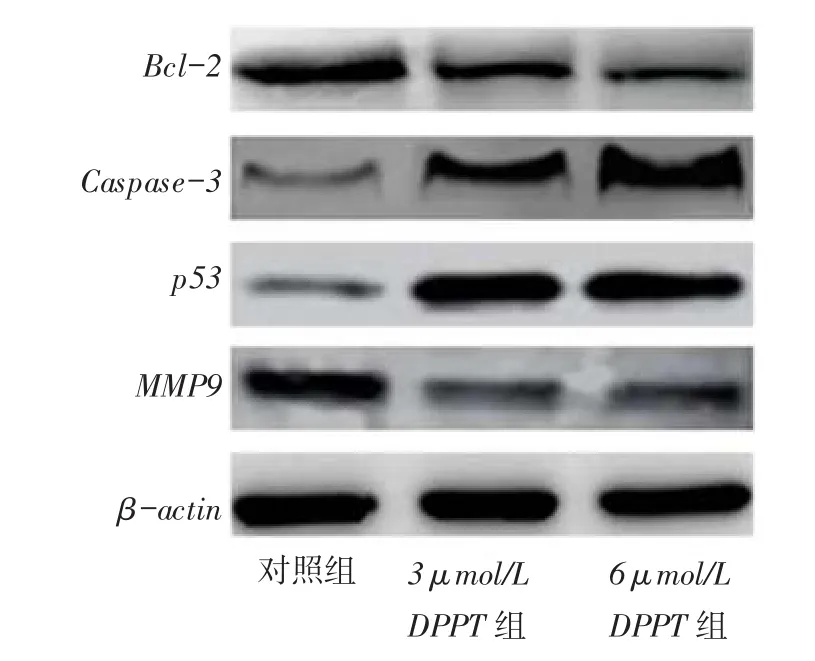
Fig. 6 The effects of DPPT on the expressions of Caspase-3,p53,Bcl-2 and MMP9 of NCI-H358 cells图6 DPPT对Caspase-3、p53、Bcl-2和MMP9蛋白表达的影响
2.8 DPPT抑制ERK1/2/MAPK信号通路3、6 μmol/L DPPT能明显降低ERK1/2、p38MAPK和JNK的磷酸化水平,而对ERK1/2、p38MAPK和JNK的作用不明显,见图7,提示DPPT可抑制ERK1/2/ MAPK信号通路的活化。
3 讨论
3.1 DPPT可以抑制肺癌NCI-H358细胞体外增殖DPPT是从天然植物中提取的活性小分子化合物,由于其具有消炎、抗病毒、抗血小板聚集和抗过敏等功效而受到人们的关注。近年文献报道,DPPT具有诱导肿瘤细胞凋亡、抗氧化作用等活性[6]。本研究显示,DPPT能明显抑制肺癌NCI-H358细胞增殖,且其抑制作用呈浓度依赖性增加。研究还发现,DPPT具有阻滞细胞周期和诱导细胞凋亡的作用,并抑制NCI-H358细胞的体外迁移。
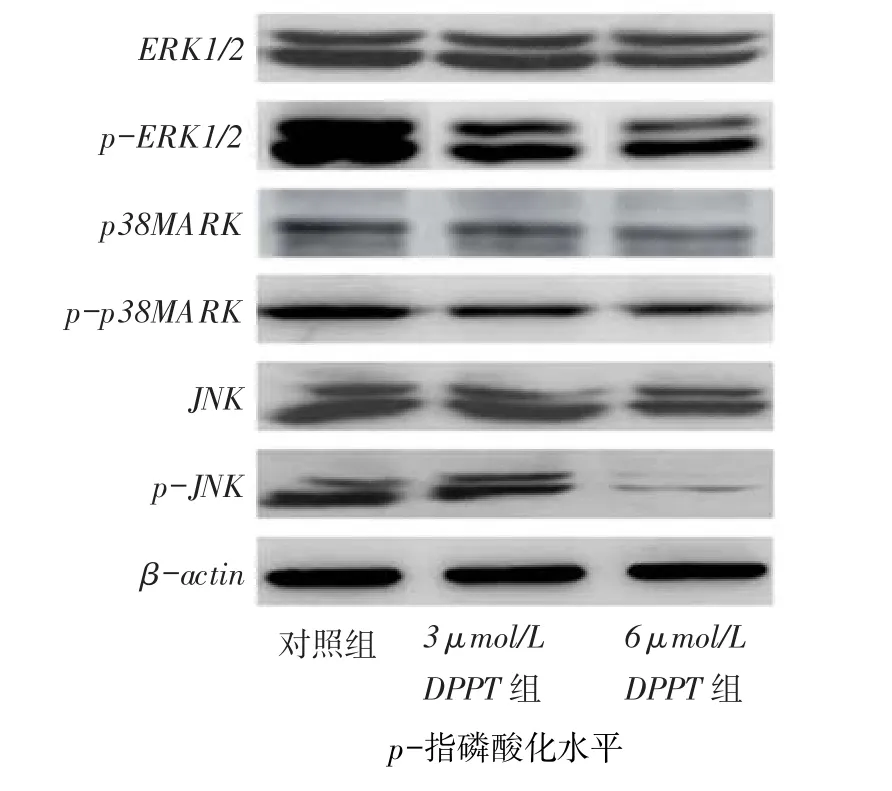
Fig. 7 The effect of DPPT on the ERK1/2/MAPK signal pathway of NCI-H358 cells图7 DPPT对ERK1/2/MAPK信号通路的影响
3.2 DPPT可阻滞肺癌NCI-H358细胞周期Cyclin B1是第一个被发现的细胞周期蛋白,其异常表达与肿瘤发生、发展以及预后相关。Cyclin B1的转录调控在细胞周期,特别是有丝分裂中起重要作用,其参与细胞周期检测点调控,维持基因组的稳定[7]。CDK1是蛋白激酶家族的重要一员,通过与Cyclin形成复合物磷酸化一系列的目标底物,从而导致细胞周期循环的产生[8]。Cdc25c是重要的细胞周期调控蛋白,作为M期的诱导物,在控制细胞周期进入M期和G2期检验点具有重要作用[9]。本研究显示,NCI-H358细胞经DPPT处理后,细胞内Cyclin B1、Cdc25c和CDK1的表达明显受抑制,因此DPPT抑制肺癌细胞的增殖可能与抑制Cyclin B1、Cdc25c和CDK1的表达相关。
3.3 DPPT可诱导肺癌NCI-H358细胞凋亡Bcl-2蛋白质家族是控制线粒体致凋亡因子释放的主要调节因子,Bcl-2基因是Bcl-2家族的重要成员,也是迄今研究得最深入、最广泛的凋亡调控基因之一[10]。研究表明,p53是重要的抑癌基因[11],在细胞周期捕获、DNA修复、细胞衰老、分化、凋亡等过程中均起着重要的作用,其能修复损伤细胞或除去严重损伤的细胞,从而避免这些细胞对机体的危害。Caspase是近年来发现的一组存在于胞质溶胶中的结构上相关的半胱氨酸蛋白酶,其中Caspase-3是细胞凋亡过程中最主要的终末剪切酶,也是细胞毒性T淋巴细胞杀伤机制的重要组成部分,主要通过干扰DNA修复过程参与细胞凋亡[12]。本研究中Western blot结果显示,DPPT作用NCI-H358细胞后,Caspase-3 和p53的表达明显上调,而Bcl-2表达明显下调。研究表明,ROS参与肿瘤的发生、发展过程,少量的ROS可以诱发肿瘤的产生,而过量的ROS反而会对细胞内的脂类、蛋白质和DNA造成氧化损伤[13]。ROS可作为第二信使通过上调促凋亡蛋白Caspase等的表达而参与凋亡调控。本研究显示,DPPT可上调细胞内ROS水平。MMP9是MMPs中的重要成员之一,在高浸润性肺癌细胞中大量表达,与肺癌的生长、浸润及转移关系最密切[14]。本研究还发现,MMP9的表达水平在DPPT处理后明显下调。因此,DPPT诱导细胞凋亡和抑制NCI-H358细胞体外迁移与Caspase-3、p53、Bcl-2和MMP9的表达调控有关。
3.4 DPPT可抑制肺癌NCI-H358细胞ERK1/2/ MAPK信号通路ERK1/2信号通路是最早发现的Ras/Raf/MAPK经典的MAPK信号转导途径,参与细胞增殖、分化、凋亡以及细胞迁移调控过程。p38MAPK可通过增强c-myc表达、激活c-Jun和c-fos、诱导bax转位等途径,参与细胞凋亡的调控。而活化的JNK能通过激活内源性通路,使Bcl-2参与促凋亡分子的释放(如细胞色素C),从而导致Caspase的激活和细胞凋亡[15]。本研究发现,DPPT可下调NCI-H358细胞中ERK1/2、p38MAPK和JNK的磷酸化水平。因此,DPPT抑制细胞增殖和体外迁移与抑制其上游ERK1/2/MAPK信号通路有关。
在今后的研究中,本课题组将进一步验证DPPT对其他肺癌细胞系的抑制作用,并考察其对正常上皮细胞的毒性,探讨其对肿瘤细胞和正常细胞毒性的差别,为临床应用提供理论依据和实验基础。
[1]Islami F,Torre LA,Jemal A. Global trends of lung cancer mortality and smoking prevalence[J]. Transl Lung Cancer Res,2015,4(4):327-338. doi:10.3978/j.issn.2218-6751.2015.08.04.
[2]Khaled M,Jiang ZZ,Zhang LY. Deoxypodophyllotoxin:a promising therapeutic agent from herbal medicine[J]. J Ethnopharmacol,2013,149(1):24-34. doi:10.1016/j.jep.2013.06.021.
[3]Guerram M,Jiang ZZ,Sun L,et al. Antineoplastic effects of deoxypodophyllotoxin,a potent cytotoxic agent of plant origin,on glioblastoma U-87 MG and SF126 cells[J]. Pharmacol Rep,2015,67(2):245-252. doi:10.1016/j.pharep.2014.10.003.
[4]Kim KY,Cho HJ,Yu SN,et al. Interplay of reactive oxygen species,intracellular Ca2+ and mitochondrial homeostasis in the apoptosis of prostate cancer cells by deoxypodophyllotoxin[J]. J Cell Biochem,2013,114(5):1124-1134. doi:10.1002/jcb.24455.
[5]Shin SY,Yong Y,Kim CG,et al. Deoxypodophyllotoxin induces G2/ M cell cycle arrest and apoptosis in HeLa cells[J]. Cancer Lett,2010,287(2):231-239. doi:10.1016/j.canlet.2009.06.019.
[6]Guan XW,Xu XH,Feng SL,et al. Synthesis of hybrid 4-deoxypodophyllotoxin-5-fluorouracil compounds that inhibit cellular migration and induce cell cycle arrest[J]. Bioorg Med Chem Lett,2016,26(6):1561-1566. doi:10.1016/j.bmcl.2016.02.013.
[7]Ma D,Lu B,Feng C,et al. Deoxypodophyllotoxin triggers parthanatos in glioma cells via induction of excessive ROS[J]. Cancer Lett,2016,371(2):194-204. doi:10.1016/j.canlet.2015.11.044.
[8]Carpagnano GE,Palladino GP,Martinelli D,et al. Exhaled matrix metalloproteinase-9 in lung cancer[J]. Rejuvenation Res,2012,15 (4):359-365. doi:10.1089/rej.2011.1254.
[9]Nissim Ben Efraim AH,Eliashar R,Levi-Schaffer F. Hypoxia modulates human eosinophil function[J]. Clin Mol Allergy,2010,19 (8):10. doi:10.1186/1476-7961-8-10.
[10]Zhao J,Han SX,Ma JL,et al. The role of CDK1 in apoptin-induced apoptosis in hepatocellular carcinoma cells[J]. Oncol Rep,2013,30(1):253-259. doi:10.3892/or.2013.2426.
[11]Wu M,Jiang Z,Duan H,et al. Deoxypodophyllotoxin triggers necroptosis in human non-small cell lungcancer NCI-H460 cells[J]. Biomed Pharmacother,2013,67(8):701-706. doi:10.1016/j.biopha.2013.06.002.
[12]Wen S,Yang XY,Zhang M,et al. The effect of miRNA-7 on chemoresistance in esophageal cancer cell TE-1[J]. Tianjin Med J,2016,44(2):155-158.[温爽,杨晓煜,张敏,等. miRNA-7对食管癌细胞TE-1化疗耐药的影响[J].天津医药,2016,44(2):155-158]. doi:10.11958/58919.
[13]Fu W,Sui D,Yu X,et al. Protective effects of ginsenoside Rg2 against H2O2-induced injury and apoptosis in H9c2 cells[J]. Int J Clin Exp Med,2015,8(11):19938-19947.
[14]Moirangthem A,Bondhopadhyay B,Mukherjee M,et al. Simultaneous knockdown of uPA and MMP9 can reduce breast cancer progression by increasing cell- cell adhesion and modulating EMT genes[J]. Sci Rep,2016,6:21903. doi:10.1038/srep21903.
[15]Guo YX,Ma YJ,Han L,et al. Role of sphingosine 1-phosphate in human pancreatic cancer cells proliferation and migration[J]. Int J Clin Exp Med,2015,8(11):20349-20354.
(2016-02-15收稿2016-03-23修回)
(本文编辑李鹏)
Research on mechanisms of deoxypodophyllotoxin-induced inhibition of cell proliferation and migration in human lung cancer NCI-H358 cells
CHEN Zhenhua,QIU Xincai ,LIN Shufang,GAN Zhenyong
Department of Respirology,The Nanhai Hospital Affiliated to Southern Medical University,Foshan 528200,China Corresponding Author E-mail:xincq6512@126.com
Objective To investigate the effects and mechanism of deoxypodophyllotoxin on cell proliferation and migration of human lung cancer NCI-H358 cells in vitro. Methods CCK-8 assay,flow cytometry assay,wound healing assay and DCFH-DA assay were used to detect the effects of deoxypodophyllotoxin on the proliferation,cells cycle,apoptosis,migration and reactive oxygen species(ROS). The protein expressions of Cyclin B1,Cdc25c,CDK1,Caspase-3,p53,Bcl-2,MMP9,ERK1/2,p38MAPK and JNK were measured by Western blot assay,respectively. Results Deoxypodophyllotoxin inhibited cell proliferation and reduced migration in human lung cancer NCI-H358 cells. Flow cytometry analysis showed that treatment with deoxypodophyllotoxin resulted in cell cycle G2/M and S phase arrest,cell apoptosis and ROS production. The result of Western blot assay showed that protein expressions of Cyclin B1,Cdc25c,CDK1,Bcl-2 and MMP9 were downregulated while Caspase-3 and p53 were up-regulated. Moreover,Deoxypodophyllotoxin treatment decreased the phosphorylated levels of ERK1/2,p38MAPK and JNK obviously. Conclusion Deoxypodophyllotoxin could suppress the proliferation and migration of human lungcancer NCI-H358 cells in vitro,which is apotential anti-tumor drug.
podophyllotoxin;lungneoplasms;cell proliferation;cell movement;deoxypodophyllotoxin
R734.2,R349.5
A
10.11958/20160058
广东省佛山市南海区人民医院呼吸科(邮编528200)
陈振华(1971),男,本科学历,副主任医师,主要从事慢性阻塞性肺疾病研究
E-mail:xincq6512@126.com



